Под фазой понимают гомогенную часть системы, отделенную от остальных частей системы поверхностями или границами раздела, вблизи которых происходит внезапное изменение физических свойств.
Степенями свободы системы называются изменяющиеся в определенных пределах физические факторы: температура, давление и концентрация, которые определяют состояние равновесия системы.
Под компонентами понимают отдельные вещества, которые входят в состав фаз.
Например: система лед – вода – пар содержит 1 компонент – воду. Это однокомпонентная система. Число фаз – 3 (вода – лед – пар).
В 1874 году Гиббсом было сформулировано правило фаз:
С = К+2-Ф,
где С – число степеней свободы,
К – число компонентов,
Ф – число фаз.
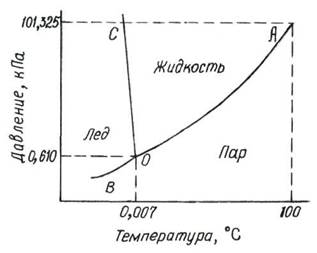
Диаграмма состояния воды
|
|
Диаграмма состояния представляет собой графическое изображение зависимости между различными величинами, характеризующими состояние системы. Для однокомпонентных систем обычно используют диаграммы состояния, показывающие зависимость между давлением и температурой (Р –Т).
Рис. 1. Диаграмма состояния воды.
Любой точке на диаграмме отвечают определенные значения температуры и давления. Диаграмма состоит из трех кривых, разграничивающих все возможные температуры и давления на 3 области, отвечающие льду, жидкости и пару.
Кривая ОА – называется кривой равновесия жидкость – пар или кривой кипения.
Точкам, лежащим на диаграмме состояния ниже или правее кривой ОА, отвечает область пара. Точкам, лежащим выше или левее кривой ОА отвечает область жидкого состояния.
Кривая ОС – кривая равновесия твердое состояние – жидкость, кривая плавления.
ОВ – кривая равновесия твердое состояние – пар – кривая сублимации.
Все три кривые пересекаются в точке О. Координаты этой точки – это единственная пара значений Т и р, при которых в равновесии могут находиться все три фазы: лед, жидкость и пар. Она носит название тройной точки.
Кривая ОА заканчивается в критической точке. При температуре отвечающей этой точке различие между жидким и парообразным состоянием исчезает. В точке О число степеней свободы (С):
С = К+2-Ф
С = 1+2-3 = 0,
то есть число степеней свободы = 0, то есть система инвариантна.
В точке К С =1+2-2=1, то есть система моновариантна.
В точке N С = 1+2-1=2, то есть система бивариантна, для нахождения этой точки необходимы две координаты температура и давление.
РАСТВОРИМОСТЬ ВЕЩЕСТВ В ВОДЕ
Растворимость – это количество (г.) вещества, насыщающее 100 г. растворителя при данных условиях.
Растворимость газов
А) Газы, состоящие из полярных молекул, растворяются в воде лучше, чем неполярные соединения.
Б) В дистиллированной воде растворимость газов выше, чем в растворах электролитов. Растворимость газа зависит от концентрации электролита (формула Сеченова)
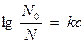
N0 – растворимость в чистой воде;
N – растворимость в электролите;
С – концентрация электролита;
к - постоянная, зависящая от природы газа, электролита и температуры.
Так, растворимость кислорода в воде с общим содержанием 40г/кг уменьшается на 25 %. Следовательно в соленых водах О2 меньше, чем в пресных.
В) Растворимость газов при повышении температуры падает. Уравнение Клапейрона – Клаузиуса:
 , где
, где
N1 и N2– растворимость при температурах Т1 и Т2;
Lисп - молярная теплота испарения;
R – универсальная газовая постоянная , равная Дж/моль ∙К.
Г) Зависимость растворимости от давления выражается законом Генри.
 , где
, где
С - концентрация растворенного газа;
р- давление газа над раствором;
к- коэффициент пропорциональности, зависящий от природы газа, растворитель и температура, но не зависящий от давления.
Если над раствором находится смесь газов, то растворимость каждого пропорциональна его парциальному давлению (закон Генри – Дальтона).
Дата: 2019-02-02, просмотров: 368.