Снижение содержания ионов Са2+ и Mg 2+ (умягчение) может достигаться применением ряда методов (реагентных, ионообменных, термических).
Реагентные методы основаны на переводе ионов Са2+ и Mg 2+ в труднорастворимые соединения (карбонаты, фосфаты). Полного извлечения Са2+ и Mg 2+ не происходит, так как остается какое – то количество их в воде. Концентрация их зависит от П.Р. образующихся соединений.
1. Известкование воды – это перевод заметно растворимых гидрокарбонатов кальция и магния в труднорастворимые соединения.
Са(НСО3)2 +Са(ОН)2 →2СаСО3 ↓ +Н2О
2Mg(НСО3)2 + 3Са(ОН)2→ (MgОН)2 СО3 ↓ +3СаСО3 +4Н2О
Mg(НСО3)2 + 2Са(ОН)2→Mg(ОН)2↓ +2СаСО3↓+2Н2О
MgSO4 + Са(ОН)2 →Mg(ОН)2↓ +Са SO4
СО2 + Са(ОН)2 = СаСО3↓+ Н2О
Таким образом, при известковании воды снижаются: карбонатная жесткость (щелочность); концентрация свободной углекислоты; общее солесодержание.
Известкование воды ведется при двух режимах:
- если не предусматривается снижение магниевой жесткости, то обработка ведется при рН = 9,5;
- для выделения ионов магния и соединений кремниевой кислоты известкование ведут при рН = 10,9.
Первый режим чаще применяют при обработке природных вод, так как в них Са2+ > Mg 2+ .
При соотношении Са2+ > НСО3- из воды выделяется СаСО3.
Если Са2+ < НСО3- , то из воды удаляется Mg в форме Mg (ОН)2. Для более полного умягчения воды используют следующие приемы:
а) повышение температуры;
б) создание небольшого избытка извести;
В) перемешивание.
На формирование осадка отрицательно влияют органические вещества, особенно ПАВ, так как они препятствуют росту кристаллов СаСО3.
При окисляемости исходной воды 75 – 100мг 02/л кристаллизация почти отсутствует.
Эффективность известкования воды определяется выбором оптимальной дозы извести.
Ди = 28[Жк 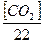 +0,5]
+0,5] 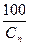 ,
,
где Ди – доза извести товарного продукта в расчете на СаО (мг/л);
28 – эквивалент СаО;
Жк – карб. жесткость мг – экв./л;
[CO2] - содержание свободной углекислоты (мг/л);
22 – эквивалент угольной кислоты;
0,5 – избыток извести мг-экв/л;
Сп – содержание оксида кальция в товарном продукте, %.
По этой формуле рассчитывают дозу извести, если не требуется снижения магниевой жесткости.
Контроль известкования проводится по величине рН.
Наиболее полное осаждение СаСО3 проходит при величине рН, соответствующей соотношению насыщения воды карбонатом кальция (рНS).
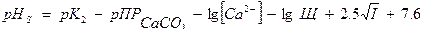 ,
,
где рК2, 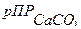 - отрицательные логарифмы константы диссоциации Н2СО3 по второй ступени и
- отрицательные логарифмы константы диссоциации Н2СО3 по второй ступени и 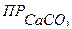 .
.
[Ca2+] - содержание кальция мг/л;
Щ – щелочность воды мг –экв/л;
I – ионная сила раствора.
Умягчение ведут при рН на 0,3 -0,5 больше, чем рНS.
2. Известково – содовый метод умягчения воды.
Сущность метода: обработка воды двумя реагентами: известью и содой (Na2CO3). При этом снижается как карбонатная, так и некарбонатная жесткость.
Наряду с реакциями, протекающими при известковании воды идут процессы.
СaSO2 + Na2CO3 = CaCO3↓+Na2SO4
CaCl2 + Na2CO3 = CaCO3↓+2NaCl
MgCl2 + Na2CO3 = MgCO3+2NaCl
MgCO3+Ca(OH)2 = Mg(OH)2↓+ CaCO3↓
MgSO4 + Ca(OH)2= MgOH2↓+ CaSO4↓
MgCl2 +Ca(OH)2= Mg(OH)2↓+ CaCl
Свободная щелочность после этого метода должна быть 0,3– 0,5 мг–экв/л.
Доза извести рассчитывается:
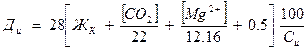 ,
,
[Mg2+] – концентрация Mg, мг/л.
12,16 – эквивалент Mg.
Доза соды рассчитывается:
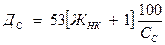 ,
,
ЖНК – жесткость некарбонатная, мг-экв/л;
1- избыток соды, мг-экв/л;
Сс – содержание безводного Na2CO3 в товарном продукте %;
53 - эквивалент безводного карбоната натрия.
3. Термохимический метод.
Для повышения эффективности умягчения воды обработка реагентами сочетается с подогревом ее до 95 -99 0С.
Нагревание вызывает термический распад гидрокарбонатов.
Са(НСО3)2=СаСО3↓+СО2 +Н2О
Mg(НСО3)2=MgCO3+СО2 + Н2О
MgCO3+Ca(OH)2=Mg(OH)2↓ + СаСО3↓.
Преимущества: образование крупных, быстроосаждающихся хлопьев. Доза извести может быть уменьшена. Степень умягчения воды составляет 0,2 -0,3 мг-экв/л.
Иногда, вместо извести для умягчения воды применяется гидроксид натрия.
4. Фосфатный метод умягчения воды.
В качестве реагентов используют: фосфат натрия Na3PO4·12H2O или гидрофосфат натрия Na2HPO4.
CaCl2 +Na3PO4 →Ca3(PO4)2+NaCl
MgSO4+Na3PO4→Mg3(PO4)2+Na2SO4
Обычно степень фосфатного умягчения составляет 0,02 -0,04 мг-экв/л. Фосфатное умягчение дает хорошие результаты при высокой температуре и применяется для подготовки воды для паровых котлов.
Для умягчения воды при температуре используется гексаметафосфат натрия
Na2[Na4(PO3)6]
2CaSO4 + Na2[Na4(PO3)6] → Na2 [Ca2(PO3)6]+2 Na2SO4
2MgCl2 + Na2[Na4(PO3)6] → Na2 [Mg2(PO3)6]+ 4 NaCl
Фосфатные реагенты составляют основу антинакипинов.
В последние годы все большее значение принимают методы ионного обмена.
Дата: 2019-02-02, просмотров: 386.