Растворимость зависит от природы растворяемого вещества и температуры. Давление влияет незначительно. Лучше растворяются вещества, которые взаимодействуют с водой, образуя гидраты. Температура влияет на растворимость различно:
1) при изменении температуры от 0 до 100 0С растворимость KNO3 увеличивается в 19 раз, а NaCl на 10 %.
2) Растворимость CаSO4 ∙2H2O и Ca(OH)2 с повышением температуры падает.
Взаимная растворимость жидкостей
А) Полярные жидкости хорошо растворяются в полярных, а неполярные в неполярных растворителях. Взаимная растворимость изменяется в широких пределах: в любых соотношениях смешиваются полярные жидкости ацетон и вода. Но жидкие углеводороды (октан, декан и др.) неполярны и практически не растворяются в воде.
Б) При повышении температуры растворимость ограниченно растворимых друг в друге жидкостей увеличивается и при определенной температуре (критической t0 растворения) они становятся неограниченно растворенными друг в друге.
В) Взаимная растворимость жидкостей не зависит от давления.
Г) Температура кипения смесей с ограниченной растворимостью ниже, чем температура кипения каждого компонента. Такие смеси называются азеотропными (нераздельно кипящими). Например, фенол – вода, t0 кипения фенола -181,4 0С, а смеси 98,6 0С при полном испарении одного из соединений температура кипения резко возрастает. Это свойство азеотропных смесей используется для очистки промышленных стоков от органических примесей (фенола, органических кислот) методом перегонки с водяным паром.
Свойства растворов
1. Закон Рауля (1887г.).
Относительное понижение давления насыщенного пара над раствором равно отношению числа молей растворенного вещества к сумме молей растворителя и растворенного вещества
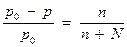
р0 – давление насыщенного пара чистого растворителя;
р- давление пара над раствором;
n – число молей растворенного вещества;
N - число молей растворителя.
Понижение давления насыщенного пара над раствором вызывает изменения температуры кипения и замерзания раствора по сравнению с чистым растворителем. Растворы кипят при более высокой температуре.
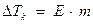 ,
,
∆Тк - повышение температуры кипения, 0С;
Е – эбуллиоскопическая константа растворителя (для воды равна 0,52 0С);
M – моляльная концентрация раствора.
Замерзают растворы при более низкой температуре, чем у чистого растворителя.
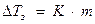 ,
,
К – криоскопическая константа (для Н2О К = 1,86 0С).
Поэтому морская вода замерзает при 19 0С.
Самопроизвольный переход молекул растворителя через полупроницаемую мембрану против градиента концентрации называется осмосом.
Гидростатическое давление, оказываемое молекулами растворителя на мембрану, называется осмотическим.
Величина осмотического давления для разбавленных растворов не зависит от химической природы растворителя и растворенного вещества, а определяется разностью концентраций растворов, разделенных мембраной. Чем больше эта разность, тем больше осмотическое давление.
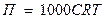 , где
, где
П – осмотическое давление, Па;
С- молярная концентрация моль/м3;
R - газовая постоянная = 8,31 Дж/моль∙К;
Т- термодинамическая температура раствора, К.
Вышеуказанные зависимости справедливы для растворов неэлектролитов, так как в электролитах (вследствие их диссоциации) присутствуют большее число частиц. Поэтому в вышеуказанные уравнения для электролитов вводится поправочный множитель (i) - изотонический коэффициент. Он рассчитывается по формуле
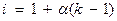 (для слабых электролитов)
(для слабых электролитов)
α – степень диссоциации;
κ – количество ионов образующихся при диссоциации молекул.
Теория сильных электролитов
При растворении электролитов происходит диссоциация их молекул. Способность вещества к образованию ионов выражается степенью диссоциации (α).
α = (число молекул распавшихся на ионы)/ (общее число молекул вещества).
Электролиты делятся на:
- слабые электролиты,
- сильные электролиты.
Процесс диссоциации слабых электролитов обратимый
Н2СО3 ↔ Н+ + НСО 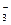
К1 =  .
.
Сильные электролиты не подчиняются закону действия масс. Константа диссоциации сильных электролитов зависит от концентрации, при повышенной концентрации она уменьшается.
П. Дебай и Э Хюккель (1923г.) - теория сильных электролитов: растворы сильных электролитов состоят только из ионов.
Ионы в растворе распределяются также как в кристаллах, но на большем расстоянии друг от друга. Их взаимное влияние ослабляется присутствием молекул растворителя. В сильно разбавленных растворах взаимное влияние их ионов слабо и кажущаяся степень диссоциации приближается к 100%. Увеличение концентрации вызывает увеличение взаимного влияния и кажущаяся степень диссоциации уменьшается. При увеличении концентрации раствора подвижность ионов снижается, поэтому растворы сильных электролитов характеризуются величиной активной концентрацией (а), которая меньше истинной.
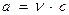
а - активная концентрация, моль/л;
с – истинная концентрация, моль/л;
ν – коэффициент активности.
Если в растворе находится смесь электролитов, то электростатическое действие ионов друг на друга характеризуется ионной силой раствора (I)
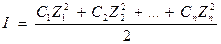 , где
, где
С1, С2, …, Сn - истинные концентрации отдельных ионов.
Z1, Z2, …, Zn - заряды ионов.
2.6 Коэффициент активности (ν)
Коэффициент активности (ν) не зависит от химической природы иона и одинаков для всех равнозарядных ионов при определенной ионной силе раствора. В водах с малым солесодержанием (до 200 мг/л) ν- не принимают во внимание. При большой концентрации электролита необходимо учитывать ν. Для растворов с ионной силой до 0,01 ν рассчитывается по формуле:
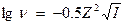 . При I - от 0,5 до 0,01, коэффициент активности рассчитывается по формуле:
. При I - от 0,5 до 0,01, коэффициент активности рассчитывается по формуле:
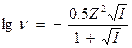
Эта формула применима для точного расчета коэффициента активности растворов с концентрацией до 50 ммоль/дм3.
Произведение растворимости
1. Для выражения растворимости практически нерастворимых веществ используется условная величина – произведение растворимости ПР.
При контакте воды с поверхностью практически нерастворимого вещества, например СаCO3 начинается выход в раствор незначительного количества ионов Ca2+ и CO  . Так как скорость растворения υ1 зависит от количества ионов на поверхности, то можно допустить, что с течением времени она не меняется, то есть:
. Так как скорость растворения υ1 зависит от количества ионов на поверхности, то можно допустить, что с течением времени она не меняется, то есть:
υ1 = κ1
При повышении концентрации ионов в растворе увеличивается υ2 - скорость перехода ионов из раствора на поверхность твердой фазы. υ2 зависит от активности ионов, а для сильно разбавленных растворов от концентрации ионов в растворе и выражается уравнением:
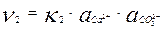
При определенной концентрации ионов в растворе скорости растворения и осаждения становятся равны, то есть υ1 = υ2. Следовательно
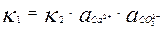 , отсюда
, отсюда 
Отношение  - величина постоянная, характеризует растворимость труднорастворимого электролита и называется произведением растворимости. В насыщенном растворе CaCO3 существует равновесие
- величина постоянная, характеризует растворимость труднорастворимого электролита и называется произведением растворимости. В насыщенном растворе CaCO3 существует равновесие
СаCO3 ↔ Ca2+ + CO 
твердая фаза раствор
ПР  = a
= a 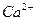 ∙ a
∙ a 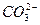 =4,8 ∙10-9 моль/л.
=4,8 ∙10-9 моль/л.
Если при диссоциации электролита, образуется несколько одинаковых ионов, то ПР равно произведению активностей ионов в степени, соответствующей количеству ионов.
Mg3 (PO4)2 ↔ 3Mg2+ + 2PO 
ПР 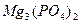 = a 3
= a 3 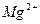 ∙ a 2
∙ a 2 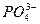 . Если произведение активностей ионов <ПР – раствор является ненасыщенным.
. Если произведение активностей ионов <ПР – раствор является ненасыщенным.
Если оно равно ПР, то раствор будет насыщенным .
Если произведение активностей ионов > ПР, то раствор является пересыщенным.
Представив вместо активностей ионов значения их концентраций, получим:
a 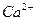 = γ
= γ 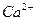 ∙ [Са2+]; a
∙ [Са2+]; a 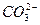 = γ
= γ 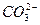 ∙[СО
∙[СО 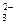 ], где
], где
γ – коэффициент активности, то есть отношение активности к истинной концентрации. Тогда
ПР  = γ
= γ 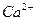 [Са2+]∙γ
[Са2+]∙γ 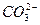 [СО
[СО 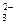 ]
]
Коэффициенты активности ионов с одинаковой величиной зарядов равны. Следовательно ПР  =γ2 [Са2+]∙γ[СО
=γ2 [Са2+]∙γ[СО 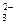 ], то есть [Са2+][СО
], то есть [Са2+][СО 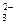 ]=ПР
]=ПР 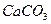 /γ2.
/γ2.
Так как концентрации ионов [Са2+] = [СО 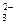 ], то концентрация каждого из них будет соответствовать молярной концентрации насыщенного раствора.
], то концентрация каждого из них будет соответствовать молярной концентрации насыщенного раствора.
[Са2+] = [СО 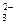 ]=
]=  .
.
В сильноразбавленных растворах, когда γ = 1
С(моль/л) = 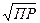 , где
, где
С – молярная концентрация насыщенного раствора бинарного электролита. При введении в насыщенный раствор труднорастворимого электролита другого электролита, не содержащего с ним одноименных ионов, наблюдается повышение растворимости. Это явление называется солевым эффектом.
ГИДРОЛИЗ СОЛЕЙ
Гидролизом называется взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды.
Гидролизу подвержены соединения разных классов, мы будем рассматривать гидролиз солей.
В реакции гидролиза вступают соли образованные: слабой кислотой и слабым основанием; слабой кислотой и сильным основанием; сильной кислотой и слабым основанием.
3.1 Механизм протекания реакций гидролиза
1. Соль образована одноосновной кислотой и одновалентным металлом.
СН3СООNa + Н2О → СН3СООН + NaОН
СН3СОО- + Н2О → СН3СООН + ОН-
Из уравнения видно, что гидролизу подвергается анион соли и освобождается ОН-. Но поскольку ионное произведение воды [H+] [OH-] – величина постоянная, то при накоплении ионов ОН- концентрация ионов Н+ уменьшается. Следовательно: растворы солей, образованные слабой кислотой и сильным основанием имеют щелочную реакцию.
2. Аналогично в случае соли, образованной сильной кислотой и слабым основанием, гидролизу подвергается катион соли и освобождаются ионы водорода.
NH4Cl + H2O ↔ NH4OH + HCl
NH4+ + H2O ↔ NH4OH + H+
В этом случае реакция среды кислая.
3. Соль образована слабой многоосновной кислотой или слабым основанием многовалентного металла. Гидролиз таких солей протекает ступенчато.
1) Na2CO3 + H2O ↔ NaHCO3 + NaOH
CO3 2- + H2O ↔ HCO3- + OH –
2) NaHCO3 + H2O → NaOH + H2CO3
HCO3- + H2O →H2CO3 + OH –
Аналогично для солей образованных слабым основанием и сильной кислотой
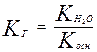
Для соли слабой кислоты и слабого основания
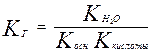
Запишем уравнение гидролиза в общем виде:
МА + Н2О ↔ НА + МОН
НА – кислота
МОН – основание
МА – соль.
Этому равновесию отвечает константа:
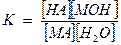
[Н2О] – величина постоянная. Тогда

К· [Н2О] - Кг (константа гидролиза), таким образом
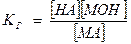
Для случая соли слабой кислоты и сильного основания
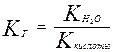
Отсюда следует, что Кг обратно пропорциональна Ккислоты, чем слабее кислота, тем сильнее гидролизуются ее соли.
При гидролизе по первой ступени образуется ион НСО3- . Его диссоциация характеризуется второй константой диссоциации угольной кислоты. Во второй ступени образуется Н2СО3, его характеризует первая константа диссоциации.
Поэтому,
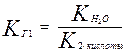 ;
;
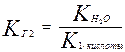 ;
;
так как К1 > К2, то КГ1 > КГ2.
Следовательно, гидролиз по первой степени всегда протекает в большей степени, чем по второй.
Аналогично проходит гидролиз соли образованный слабым основанием многовалентного металла.
CuCl2 + H2O ↔ CuOHCl +HCl
Cu2+ + H2O ↔ CuOH+ + H+
В ничтожно малой степени:
CuOHCl + H2O → Сu(OH)2 + HCl
Cu2+ + H2O → Сu(OH)2 + H+
Особенно глубоко протекает гидролиз солей образованных слабой кислотой и слабым основанием.
Al(CH3COO)3 + H2O ↔ Al(OH)(CH3COO)2 + CH3COOH
Al(OH)(CH3COO)2 + H2O ↔ Al(OH)2(CH3COO) + CH3COOH
Гидролиз катиона:
Аl3+ + H2O ↔ AlOH 2+ + H+
Гидролиз аниона:
СН3СОО- + Н2О ↔ СН3СООН + ОН-
При гидролизе катиона образуется Н+, при гидролизе аниона образуется ОН-. Реакция среды в этом случае зависит от отношения констант диссоциации. Если кислота и основание, образующие соль, не только слабые электролиты, но и малорастворимы или неустойчивы, то гидролиз часто протекает необратимо.
Гидролиз хлора
При растворении хлора в воде происходит его гидролиз по следующему уравнению.
Сl2 + H2О ↔ НОСl + HCl
Равновесие сильно смещено влево. При соединении хлора с водой образуются незначительные количества соляной и хлорноватистой кислоты.
Но равновесие хлора с водой можно сместить вправо добавлением щелочи.
Cl2 + 2KOH ↔KCl + KOCl + H2O
В растворе хлорной воды в виде ионов находится только соляная кислота, так как хлорноватистая – слабая, поэтому присутствие сильной кислоты подавляет ее действие почти нацело.
Сl2 + HOH ↔ H+ + Cl- + HOCl
Константа гидролиза будет равна
 = Кгидр = 4,5·10-4
= Кгидр = 4,5·10-4
Гидролиз хлорамина
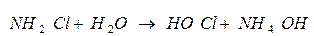

Буферные растворы
Буферными растворами называются растворы, рН которых не изменяется при прибавлении небольшого количества сильной кислоты или щелочи.
Основные виды буферов:
1. Слабая кислота и ее соль (ацетатная СН3СООН и СН3 СООNa), (карбонатная Н2СО3 и NaHCO3).
Пример.
Н2СО3 ↔ Н+ + НСО3-
NaHCO3 ↔ Na+ + HCO3-
NaHCO3 – сильный электролит.
Диссоциация Н2СО3 – подавлена вследствие наличия в воде НСО3- из соли. При введении в такой раствор кислоты ионы Н+ будут взаимодействовать с ионами НСО3- , образуя компонент буфера – Н2СО3
Н+ + НСО3- → Н2СО3
Если добавить щелочь, то введенные ионы ОН- взаимодействуют с малым количеством ионов Н+ из Н2СО3
Н++ ОН- → Н2О
Запишем выражение константы диссоциации Н2СО3
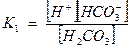 , так как диссоциация невелика, можно считать [Н2СО3] равной общей концентрации кислоты Скисл.
, так как диссоциация невелика, можно считать [Н2СО3] равной общей концентрации кислоты Скисл.
[HCO3-] =С соли.
Получаем 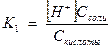 , откуда [H+] =
, откуда [H+] =  .
.
Так как [H+], а следовательно и рН зависит не от величин концентраций, а от их соотношения, то при разбавлении она остается постоянной.
Характеристикой буферных растворов служит величина буферной емкости. Она определяется числом г –экв. сильной кислоты или щелочи, которую необходимо прибавить к 1л буферного раствора для изменения рН на 1 единицу.
2. Слабое основание и его соль:
аммонийная (NH4OH и NH4Cl).
3. Две кислые соли:
фосфатная (Na2HPO4, NaH2PO4).
4. Кислая и средняя соль:
карбонатная (NaHCO3, NaCO3).
Таким образом постоянство рН буферных систем при добавлении кислоты или щелочи объясняется связыванием вводимых ионов Н+ и ОН-.
Кислые или щелочные стоки, попадающие в водоем могут быть нейтрализованы карбонатной буферной системой природных вод. (Н2СО3, NaHCO3).
В щелочных водах (при рН >8,5) буферность природных вод определяется другой карбонатной системой (NaHCO3, Na2CO3). Поддержание оптимальной величины рН при биологической очистке стоков необходимо для протекания биохимических процессов.
Буферные свойства иловой воды обуславливаются наличием карбонатной, аммонийной и фосфатной систем. Буферные растворы используются при проведении анализа - аммонийный при комплексометрическом определении жесткости воды и т.д.
Дата: 2019-02-02, просмотров: 353.