Пример 9. В 200 см3 0,1 н. раствора аммиака добавлено 2,14 г хлорида аммония. Определить рН полученного раствора. Степень диссоциации NH4Cl считать равной 1. 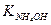 =1,8∙10-5.
=1,8∙10-5.
Решение. Определяем концентрацию хлорида аммония
(г-экв/л)
[ NH4Cl ] = 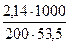 = 0,2 Н (моль/л),
= 0,2 Н (моль/л),
где 53,5 ‑ молекулярная масса хлорида аммония, г/моль;
[ OH-] = 1,8  10–5
10–5 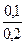 = 9
= 9  10–6 (моль/л);
10–6 (моль/л);
[ OH–]  [ H+] = 1
[ H+] = 1  10–14 ,тогда
10–14 ,тогда
[H+] = 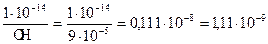 моль/л,
моль/л,
поэтому рН = –lg (1,11  10–9 ) = 8,95
10–9 ) = 8,95
Определение буферной емкости раствора.
Пример 10. Чтобы изменить рН на 1, к 1 л ацетатной буферной смеси потребовалось добавить 1 мл 1 н. р аствора щелочи. Найти буферную емкость этой соли.
Решение. Буферная емкость это число г-элементов сильной кислоты или щелочи, которое нужно добавить к 1 л буферной смеси, чтобы величина рН изменилась на 1. 1 н. раствор щелочи содержит 1 г-эквивалент щелочи в 1 мл раствора.
В 1 мл содержится 1 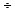 1000 = 0,001 г-эквивалента. Это и есть величина буферной емкости.
1000 = 0,001 г-эквивалента. Это и есть величина буферной емкости.
ГИДРОЛИЗ СОЛЕЙ
Химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодиссоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основных солей) и сопровождающееся изменением рН среды, называется гидролизом.
Пример 1 . Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение. а) цианид калия KCN — соль слабой одноосновной кислоты (см. табл. I приложения) HCN и сильного основания КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы К+ и анионы CN-. Катионы К+ не могут связывать ионы ОН- воды, так как КОН — сильный электролит. Анионы же CN- связывают ионы Н+ воды, образуя молекулы слабого элекролита HCN. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CN- + Н2О 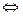 HCN + ОН-
HCN + ОН-
или в молекулярной форме
KCN + Н2О 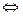 HCN + КОН
HCN + КОН
В результате гидролиза в растворе появляется некоторый избыток ионов ОН-, поэтому раствор KCN имеет щелочную реакцию (рН > 7);
б) карбонат натрия Na2CO3 — соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли СО32-, связывая водородные ионы воды, образуют анионы кислой соли НСО-3 , а не молекулы Н2СО3, так как ионы НСО-3 диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CO2-3 +H2O 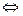 HCO-3 +ОН-
HCO-3 +ОН-
или в молекулярной форме
Na2CO3 + Н2О 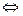 NaHCO3 + NaOH
NaHCO3 + NaOH
В растворе появляется избыток ионов ОН-, поэтому раствор Na2CO3 имеет щелочную реакцию (рН > 7);
в) сульфат цинка ZnSO4 — соль слабого многокислотного основания Zn(OH)2 и сильной кислоты H2SO4. В этом случае катионы Zn+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH+ .Образование молекул Zn(OH)2 не происходит, так как ионы ZnOН+ диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Zn2+ + Н2О 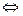 ZnOН+ + Н+
ZnOН+ + Н+
или в молекулярной форме
2ZnSO4 + 2Н2О 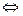 (ZnOH)2SO4 + H2SO4
(ZnOH)2SO4 + H2SO4
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (рН < 7).
Пример 2. Какие продукты образуются при смешивании растворов A1(NO3)3 и К2СО3? Составьте ионно-молекулярное и молекулярное уравнение реакции.
Решение. Соль A1(NO3)3 гидролизуется по катиону, а К2СО3 — по аниону:
А13+ + Н2О 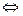 А1ОН2+ + Н+
А1ОН2+ + Н+
СО2-3 + Н2О 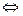 НСО-3 + ОН-
НСО-3 + ОН-
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН-образуют молекулу слабого электролита Н2О. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и СО2 (Н2СО3). Ионно-молекулярное уравнение:
2А13+ + 3СО2-3 + ЗН2О = 2А1(ОН)3 + 3СО2
молекулярное уравнение:
3СО2 + 6KNO3
2A1(NO3)3 + ЗК2СО3 + ЗН2О = 2А1(ОН)3
Дата: 2019-02-02, просмотров: 313.