Основной закон фазового равновесия часто называют правилом фаз. Правило фаз выражает количественную связь между числом фаз, существующих в равновесной системе при данных условиях, составом системы и числом независимых переменных, минимально необходимых для определения ее состояния.
Формулировка правила фаз (Гиббс): в равновесной системе сумма чисел фаз и степеней свободы равна числу компонентов, увеличенному на два:
Ф + С = К + 2, где
Ф – число фаз,
С - число степеней свободы,
К – число компонентов.
Фаза – однородная внутри себя часть неоднородной системы и отделимая от нее механическим путем. Следовательно, различные фазы гетерогенной системы отделены друг от друга поверхностями раздела. Фаза хотя и однородна, но она не обязательно должна состоять из молекул одного и того же вида. Например, раствор сахара в воде, спирта в воде, смесь газов, твердый однородный сплав представляет собой одну фазу. Если же две жидкости ограниченно растворимы друг в друге или вообще нерастворимы, то они образуют две фазы, например вода и эфир или эмульсия бензола в воде.
Химически индивидуальные вещества, образующие данную систему и способные существовать самостоятельно, называются составными частями системы. Например, раствор хлорида натрия в воде состоит из двух составных частей: молекул воды и молекул хлорида натрия. Ионы электролита (Na+, Cl-) не считаются составными частями системы, так как не способны существовать изолированно от системы.
Вещества, концентрацию (давление) которых в равновесной системы можно задавать, называются независимыми составными частями или ее компонентами. Вещества, концентрации (давления) которых в равновесной системе устанавливаются в результате химических реакций без вмешательства экспериментатора, называются независимыми составными частями системы. Например, при температуре 2000 0С существует равновесная химическая система:
2Н2О ↔ 2Н2 + О2
Если мы заранее зададим парциальные давления водорода и кислорода, то при данных условиях само собой установится парциальное давление паров воды в соответствии с законом действующих масс. Если же заранее установить парциальное давление паров воды и водорода, то само собой установится парциальное давление кислорода. Таким образом, составных частей в этой системе три, а компонентов – два.
Число степеней свободы определяет собой вариантность (изменчивость) системы. Если С = с, то система моновариантна, если С = 2, то система бивариантна. Если гетерогенная система не имеет никакой степени свободы (С = 0), то ее называют безвариантной (инвариантной, нонвариантной).
По количеству компонентов системы делят на одинарные (однокомпонентные), двойные (двухкомпонентные), тройные (трехкомпонентные) и т.д.
Пример 1. Определение числа степеней свободы в гетерогенной равновесной системе. Найдите число степеней свободы в точке М на диаграмме состояния воды.
Решение. Число степеней свободы (С) в равновесной гетерогенной системе подсчитывают с помощью уравнения Гиббса (уравнение правила фаз) :
С=К- Ф+2 , где
К- число независимых компонентов системы; Ф-число фаз в системе.

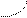

 Данная система однокомпонентная:
Данная система однокомпонентная:
 В Е фаза системы ‑ это вода в различных
В Е фаза системы ‑ это вода в различных
 агрегатных состояниях (пар, жидкость, лед)
агрегатных состояниях (пар, жидкость, лед)
 вода С К=I. Точка М находится на кривой ОС,
вода С К=I. Точка М находится на кривой ОС,

 . М отвечающей равновесию между двумя
. М отвечающей равновесию между двумя
лед фазами: жидкость и пар, т.е в точке М
. О число фаз Ф=2. Число степеней свободы
в точке М равно С=I-2+2=I. В точке
Д М система имеет одну степень свободы:
А пар это означает, что до известного предела
можно изменять или температуру, или
давление и это не вызывает изменения числа и вида фаз системы.
Пример 2. Определить число степеней свободы в системе частично замерзшей воды.
Решение. В системе существует равновесие: лед↔ вода↔ пар, поэтому система имеет 3 фазы и одну составную часть. Так как эта система физическая, то число составных частей равно числу компонентов, то есть система однокомпонентна. Отсюда по уравнению Ф+С = К+2 находим С:
С = 1+2-3 =0
Система безвариантна. Это значит, что такая система может существовать только при строго определенных условиях (t = 0,010С и р = 6,1 гПа).
Дата: 2019-02-02, просмотров: 333.