Пример 1. Установить соотношение между концентрациями гидрокарбонатного иона HCO-3 и угольной кислоты Н2CO3 при рН=4; t=250С.
Решение. Выразив рН через концентрацию водородных ионов (рН= -lg[H+]) и подставив значения известных величин в уравнение константы диссоциации угольной кислоты по первой ступени:
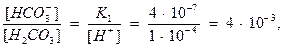
получим значение соотношения концентраций гидрокарбонатного иона и угольной кислоты при рН 4.
Из решения видно, что при рН 4 почти вся углекислота находится в свободном состоянии (числитель почти в 1000 раз меньше знаменателя).
Пример 2. Определить соотношение между концентрациями ионов 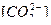 и
и 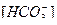 при t = 25 0С.
при t = 25 0С.
Решение. Подставим значения известных величин в уравнение константы диссоциации угольной кислоты по второй ступени:
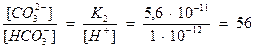 .
.
Здесь числитель значительно больше знаменателя, следовательно, при рН 12 почти вся углекислота находится в виде иона 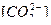 .
.
Пример 3. Определить концентрацию 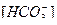 в воде при рН 10 и концентрации
в воде при рН 10 и концентрации 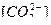 = 4 г-ион/л.
= 4 г-ион/л.
Решение. Ион 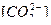 входит в уравнение второй константы диссоциации угольной кислоты, поэтому для решения воспользуемся ею. Выразим активную кислотность через концентрацию водородных ионов (рН = -lg[H+]):
входит в уравнение второй константы диссоциации угольной кислоты, поэтому для решения воспользуемся ею. Выразим активную кислотность через концентрацию водородных ионов (рН = -lg[H+]):
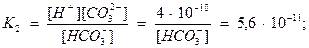
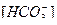 = 0,071 г-ион/л.
= 0,071 г-ион/л.
Установить, какие формы угольной кислоты могут присутствовать в растворе, можно с помощью титрования раствора в присутствии различных индикаторов.
Свободная углекислота определяется титрованием едким натром в присутствии фенолфталеина (точка перехода при рН 8), а гидрокарбонат и карбонат – ионы – титрованием соляной кислотой в присутствии фенолфталеина и метилового оранжевого (точка перехода при рН 4).
Ионы гидрокарбоната наиболее распространены в природных водах. В некоторых случаях содержание их достигает 1200 мг/л. В реках и пресных озерах содержание 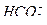 не превышает 300 мг/л. Содержание иона
не превышает 300 мг/л. Содержание иона 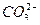 в воде, за исключением содовых вод, невелико и определяется растворимостью карбоната кальция.
в воде, за исключением содовых вод, невелико и определяется растворимостью карбоната кальция.
Содержащиеся в воде ионы 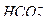 ,
, 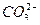 и двуокись углерода связаны между собой углекислотным равновесием. Углекислотное равновесие - это равновесное состояние системы из гидрокарбонатных, карбонатных ионов и свободной углекислоты:
и двуокись углерода связаны между собой углекислотным равновесием. Углекислотное равновесие - это равновесное состояние системы из гидрокарбонатных, карбонатных ионов и свободной углекислоты:
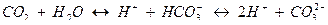
В природных водах ионы 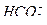 и
и 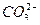 связаны с ионами кальция. Карбонат кальция всегда присутствует в растворах гидрокарбоната кальция в количествах, не превышающих его растворимости в воде (произведение растворимости CaCO3 для 15 0С составляет 9,9∙10-9 г-ион/л, или растворимость СaCO3 9,95 мг/л). При наличии ионов углекислотное равновесие выражается уравнением
связаны с ионами кальция. Карбонат кальция всегда присутствует в растворах гидрокарбоната кальция в количествах, не превышающих его растворимости в воде (произведение растворимости CaCO3 для 15 0С составляет 9,9∙10-9 г-ион/л, или растворимость СaCO3 9,95 мг/л). При наличии ионов углекислотное равновесие выражается уравнением
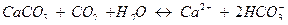
Применив к этой равновесной системе закон действия масс, получим следующее уравнение:
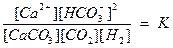 .
.
Концентрация [CaCO3] и [Н2О] есть величины постоянные: [CaCO3] выражает концентрацию насыщенного раствора карбоната кальция, а [Н2О] – концентрация молекул воды в растворе, поэтому объединим их с постоянной. Перепишем уравнение
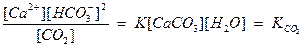 ,
,
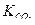 - константа углекислотного равновесия.
- константа углекислотного равновесия.
Если выразить концентрацию ионов кальция через концентрацию гидрокарбонатного иона: 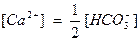 , то уравнение примет следующий вид:
, то уравнение примет следующий вид:
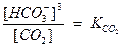 .
.
Последнее уравнение показывает, что гидрокарбонатные ионы могут находится в растворе только в том случае, когда в нем находится свободная углекислота. Итак, концентрация гидрокарбонатных ионов находится в функциональной зависимости от концентрации свободной углекислоты.
Если концентрация [CO2] будет меньше, чем это необходимо для поддержания равновесия, то гидрокарбонатные ионы будут разлагаться по уравнению, до тех пор, пока не установится новое равновесие.
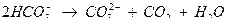
Если концентрация [CO2] больше, чем это требуется для установления равновесия, то будет происходить растворение СаСО3 по уравнению
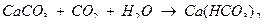
Следовательно, та концентрация свободной углекислоты, в которой последняя должна присутствовать в растворе, чтобы обусловить устойчивость гидрокарбонат – иона (в данной концентрации), называется равновесной или инактивной углекислотой.
Если концентрация свободной углекислоты превышает равновесную, то будет растворяться СаСО3. Так как на поверхности известковых и бетонных сооружений образуется карбонатная пленка, то эти сооружения подвергаются коррозии под действием агрессивной углекислоты. Наличие ее в воде служит причиной коррозионной активности (агрессивности) таких вод. На агрессивную углекислоту нельзя смотреть как на излишек свободной углекислоты над равновесной (инактивной). Избыточное количество свободной углекислоты, действуя на углекислый кальций, превращает его в гидрокарбонат. Вследствие этой реакции увеличивается количество первоначально находящегося в растворе гидрокарбонатного иона, поэтому концентрация равновесной углекислоты также должна быть повышена, чтобы удержать в растворе новое количество гидрокарбонатного иона.
Значит, растворять СаСО3 будет не весь избыток свободной СО2, а только часть его; другая же часть будет переходить в равновесную углекислоту, чтобы воспрепятствовать распаду вновь образовавшегося гидрокарбоната.
Следовательно, содержание агрессивной углекислоты измеряется величиной, на которую снижается концентрация свободной углекислоты в воде, соприкасающейся с твердой фазой карбоната кальция, при достижении углекислого равновесия.
Определение агрессивности воды производится на основании константы равновесия.
Для разбавленных растворов при 25 0С 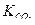 =3,43∙10-5.
=3,43∙10-5.
Если в уравнении 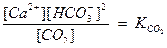 , концентрации ионов
, концентрации ионов 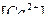 и
и 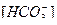 выражены в граммах – ионах на литр, а [CO2] - в молях на литр. Но при концентрации
выражены в граммах – ионах на литр, а [CO2] - в молях на литр. Но при концентрации 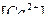 и
и 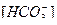 , выраженных в миллиграмм – ионах на литр, а [CO2] - в миллимолях на литр, то константа углекислотного равновесия будет равна 34,3.
, выраженных в миллиграмм – ионах на литр, а [CO2] - в миллимолях на литр, то константа углекислотного равновесия будет равна 34,3.
Дата: 2019-02-02, просмотров: 344.