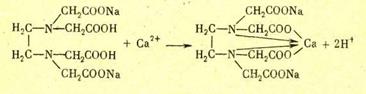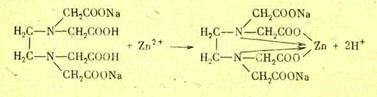Г.А. Тихановская, Л.М. Воропай
ХИМИЯ ВОДЫ
Задачи и упражнения
|
|
Учебное пособие
Вологда
20 10
Федеральное агентство по образованию
Вологодский государственный технический университет
Г.А. Тихановская, Л.М. Воропай
ХИМИЯ ВОДЫ
Задачи и упражнения
Учебное пособие
Утверждено редакционно – издательским советом ВоГТУ
в качестве учебного пособия
Вологда
2010
УДК 543.39 (075)
ББК 38.761я73+26.22
Рецензенты:
кандидат химических наук, доцент ВГМХА Т.Л. Бланк;
главный специалист ООО «Александра Плюс» М.А. Тихонов.
.
Тихановская, Г.А., Воропай Л.М.
Химия воды. Задачи и упражнения: учеб. пособие / Г.А. Тихановская, Л.М. Воропай. – Вологда: ВоГТУ, 2010. - с.
Учебное пособие (задачи и упражнения) по курсу «Химия воды и микробиология» для студентов специальности 270112 «Водоснабжение и водоотведение» является третьей частью курса, составлено на основании требований Государственного образовательного стандарта высшего и профессионального образования с учетом требований к минимуму содержания и уровню подготовки инженеров по специальности 270112.
В пособие включены задания, предусмотренные программой курса «Химия воды и микробиология», приведены способы решения типовых задач и краткие теоретические предпосылки.
В пособие входит глоссарий и таблицы по основным параметрам, используемым при характеристике природных и сточных вод, а также расчеты, применяемые в химических технологиях обработки воды.
Пособие может быть использовано для студентов дневного и заочного отделения специальности 270112, при выполнении контрольных и расчетно – графических работ.
УДК 543.39 (075)
ББК 38.76я73+26.22
Вологодский государственный
технический университет, 2010
Тихановская Г.А., Воропай Л.М., 2010
ПРЕДИСЛОВИЕ
Задачи и упражнения по химии воды можно рассматривать как третью часть спецкурса «Химия воды и микробиология». Основное содержание составляет материал, предусмотренный программой курса. Подробно рассматриваются общетеоретические основы курса, без знания которых невозможно осуществление каких – либо химических расчетов. Разделы – «Показатели качества воды» и «Физико – химические основы очистки природных вод» включают способы и методы расчета качества реагентов и оценки качества воды для отдельных видов водопользования.
В задачнике приведены решения типовых задач и даны задания для самопроверки усвоения знаний. Этот материал может быть использован при выполнении контрольных работ, студентами заочного обучения. Приведенный в пособии глоссарий помогает работать с материалом при изучении отдельных разделов курса.
В пособие включены формулы и зависимости, используемые при приготовлении растворов, формулы для пересчета концентраций растворов, расчет концентраций ионов Н+, ОН- и рН растворов различных соединений.
Отдельным разделом идут примеры решения задач на расчеты закономерностей процессов, происходящие в природных водах различного происхождения.
ОБЩЕТЕОРЕТИЧЕСКИЕ ОСНОВЫ КУРСА
РАСТВОРИМОСТЬ ВЕЩЕСТВ В ВОДЕ
Произведение растворимости
Пример 1. Произведение растворимости (ПР) оксалата бария BaC2O4 равно 1,62  10-7 . Вычислите растворимость оксалата бария в воде.
10-7 . Вычислите растворимость оксалата бария в воде.
Решение. В растворе труднорастворимого сильного электролита BaC2O4 существует равновесие:
BaC2O4 = Ва2+ + (С2О4)2–
в осадке в растворе
ПР BaC2O4=[Ва2+] [C2O4 2–],
т. к. оксалат бария диссоциирует на два иона, то концентрация его в растворе равна концентрации каждого из ионов т.е.
С 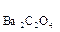 = С
= С  = С
= С 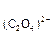 =
= 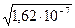 =0,4
=0,4 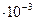 (моль/л), т.е. растворимость оксалата бария в воде при температуре 20 0С равна 0,4
(моль/л), т.е. растворимость оксалата бария в воде при температуре 20 0С равна 0,4 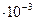 моль/л
моль/л
Пример 2. Растворимость фосфата серебра Ag3PO4 в воде при температуре 20 0С равна 6,15 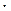 10 –3 г/л. Определить ПР.
10 –3 г/л. Определить ПР.
Решение. Молярная масса Ag3PO4=418,58 г/моль следовательно раствор содержит 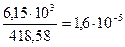 моль/л Эту величину называют молярной растворимостью. При диссоциации Ag3PO4 образуется три иона Ag+ и один ион (PO4)3-, поэтому концентрации ионов в растворе соответственно равны: С
моль/л Эту величину называют молярной растворимостью. При диссоциации Ag3PO4 образуется три иона Ag+ и один ион (PO4)3-, поэтому концентрации ионов в растворе соответственно равны: С  = 1,6
= 1,6 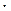 10 –5 моль/л
10 –5 моль/л
С 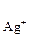 = 3
= 3 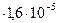 моль/л произведение растворимости Ag3PO4 равно
моль/л произведение растворимости Ag3PO4 равно
ПР 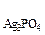 =С
=С 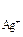
 С
С 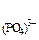 =(4,8
=(4,8  10 –5)3
10 –5)3 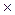 (1,6
(1,6 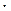 10 –5)=1,77
10 –5)=1,77 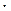 10 –18
10 –18
Пример 3. Произведение растворимости MgS при температуре 25 0С равно 2,0 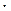 10-15. Образуется ли осадок сульфида магния при смешивании равных объемов 0,004 н. раствора нитрата магния и 0,0006 н. сульфида натрия. Степень диссоциации этих электролитов принята за 1.
10-15. Образуется ли осадок сульфида магния при смешивании равных объемов 0,004 н. раствора нитрата магния и 0,0006 н. сульфида натрия. Степень диссоциации этих электролитов принята за 1.
Решение. При смешивании равных объемов растворов объем смеси стал в два раза больше объема каждого из взятых растворов. Следовательно концентрация взятых веществ уменьшилась вдвое, т.е.
С(Mg(NO3)2= 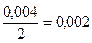 н. С(Na2S)=
н. С(Na2S)= 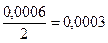 н. Для определения концентрации ионов Mg2+ и S2 – необходимо выразить концентрации растворов в моль/л т.е. С(Mg(NO3)2=0,002 н=0,001 М
н. Для определения концентрации ионов Mg2+ и S2 – необходимо выразить концентрации растворов в моль/л т.е. С(Mg(NO3)2=0,002 н=0,001 М
С(Mg2+)=1 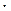 10 –3 моль/л
10 –3 моль/л
С(Na2S)=0,0003 н. 0,00015 М
С(S2 –)=1,5 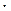 10 –4 моль/л
10 –4 моль/л
Отсюда произведение концентраций ионов в растворе
С(Mg2+) 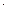 С(S2 –)=1
С(S2 –)=1 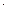 10 –3
10 –3 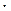 1,5
1,5 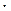 10 –4 = 1,5
10 –4 = 1,5 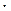 10 –7
10 –7
Эта величина больше ПР, следовательно, осадок образуется.
2.3. Определение коэффициента растворимости соли
Пример 1. При 60 0С насыщенный раствор KNO3 содержит 52,4% (масс) соли. Найти коэффициент растворимости соли при этой температуре.
Решение. Коэффициент растворимости ‑ это масса вещества, растворившегося при одинаковых условиях в 100 г растворителя с образованием насыщенного раствора. Находим коэффициент растворимости из пропорции:
на 47,6 г Н2О приходится 52,4 г KNO3
на 100 г Н2О приходится х г KNO3
х = 100 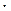 52,4 / 47,6 = 110 (г)
52,4 / 47,6 = 110 (г)
Таким образом коэффициент растворимости KNO3 при 60 0С равен 110 г.
Пример 2. При охлаждении 300 г 15% ‑ ного раствора часть растворенного вещества выпала в осадок и концентрация раствора стала 8%. Чему равна масса выпавшего в осадок вещества ?
Решение. В 300 г 15% ‑ ного раствора содержится 45 г растворенного вещества и 255 г растворителя. При охлаждении количество растворителя не изменилось. Содержание растворенного вещества в 255 г растворителя находим из пропорции:
92 г растворителя содержат 8 г вещества
255 г растворителя содержат х г вещества
х = 8  255/92 = 22,2 г
255/92 = 22,2 г
Таким образом при охлаждении раствора в осадок выпало 45‑22,2 = 22,8 г растворенного вещества.
Пример 3. Коэффициент абсорбции кислорода и азота при 0 0С равны соответственно 0,049 и 0,23. Газовую смесь, содержащую 20% (об) О2 и 80% (об) N2 взболтали с водой при 0 0С до получения насыщенного раствора. Найти процентное соотношение (по объему) растворенных в воде газов.
Решение. Коэффициент абсорбции это объем газа, растворяющегося в одном объеме растворителя с образованием насыщенного раствора. Из закона Генри следует, что объем растворяющегося газа (значит и коэффициент абсорбции) при данной температуре не зависит от парциального давления газа. По условию задачи в 1 л воды растворяется 49 мл О2 и 23 мл N2 . Однако непосредственно сравнить эти объемы нельзя, так как парциальное давление растворенных газов различны и составляют соответственно 0,2 и 0,6 от общего давления газовой смеси. Если принять последнее за 1 , то объемы растворенных кислорода и азота, приведенные к этому давлению, будут равны 49  0,2=9,8 мл и 23
0,2=9,8 мл и 23  0,8=18,4 мл общий объем растворенных газов составит, следовательно, 9,81+18,4=28,2 мл. Находим процентное содержание каждого газа: 9,8
0,8=18,4 мл общий объем растворенных газов составит, следовательно, 9,81+18,4=28,2 мл. Находим процентное содержание каждого газа: 9,8  100/28,2=35% (об)
100/28,2=35% (об)
18,4  100/28,2 = 65% (об)
100/28,2 = 65% (об)
Свойства растворов
Пример 1. Вычислите температуры кристаллизации и кипения 2%-ного водного раствора глюкозы.
Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (∆Т) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением
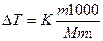 , (1)
, (1)
где К — криоскопическая или эбулиоскопическая константа. Для воды они соответственно равны 1,86 и 0,52°; т и М — соответственно масса растворенного вещества и его молярная масса; т1 — масса растворителя.
Понижение температуры кристаллизации 2%-ного раствора С6Н12О6 находим по формуле (1):
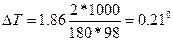
Вода кристаллизуется при 0 С, следовательно, температура кристаллизации раствора 0 - 0,21 = - 0,21 С.
По формуле (1) находим и повышение температуры кипения-2%-ного раствора:
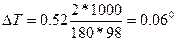
Вода кипит при 100°С, следовательно, температура кипения этого раствора 100 + 0,06 = 100,06°С.
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,529°С. Температура кипения сероуглерода 46,3°С. Вычислите эбулиоскопическую константу сероуглерода.
Решение. Повышение температуры кипения ΔТ = 46,529 - 46,3 = = 0,229°. Молярная масса бензойной кислоты 122 г/моль. По формуле (1) находим эбулиоскопическую константу:
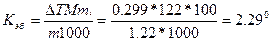
Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при -0,279°С. Вычислите молярную массу глицерина.
Решение. Температура кристаллизации чистой воды 0 0С, следовательно, понижение температуры кристаллизации ∆Т=0-(-0,279)=0,2790С. Масса глицерина т (г), приходящаяся на 1000 г воды, равна:
 г.
г.
Подставляя в уравнение
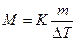 (2)
(2)
числовые значения, вычисляем молярную массу глицерина:
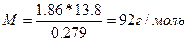
Пример 4. Вычислите массовую долю (%) водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна -0,4650С.
Решение: Температура кристаллизации чистой воды 00С, следовательно ∆Т=0–(-0,465)= +0,4650. Молярная масса мочевины 60 г/моль. Находим массу m (г) растворенного вещества, приходящуюся на 1000г воды, по формуле(2):
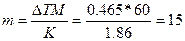 г.
г.
Общая масса раствора, содержащего 15г мочевины, составляет 1000+15=1015г. Процентное содержание мочевины в данном растворе находим из соотношения
В 1015г раствора – 15г вещества
100 г раствора - х г вещества
х =  г.
г.
Ответ: 1,48%.
ГИДРОЛИЗ СОЛЕЙ
Химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодиссоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основных солей) и сопровождающееся изменением рН среды, называется гидролизом.
Пример 1 . Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение. а) цианид калия KCN — соль слабой одноосновной кислоты (см. табл. I приложения) HCN и сильного основания КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы К+ и анионы CN-. Катионы К+ не могут связывать ионы ОН- воды, так как КОН — сильный электролит. Анионы же CN- связывают ионы Н+ воды, образуя молекулы слабого элекролита HCN. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CN- + Н2О 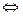 HCN + ОН-
HCN + ОН-
или в молекулярной форме
KCN + Н2О 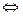 HCN + КОН
HCN + КОН
В результате гидролиза в растворе появляется некоторый избыток ионов ОН-, поэтому раствор KCN имеет щелочную реакцию (рН > 7);
б) карбонат натрия Na2CO3 — соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли СО32-, связывая водородные ионы воды, образуют анионы кислой соли НСО-3 , а не молекулы Н2СО3, так как ионы НСО-3 диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CO2-3 +H2O 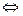 HCO-3 +ОН-
HCO-3 +ОН-
или в молекулярной форме
Na2CO3 + Н2О 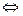 NaHCO3 + NaOH
NaHCO3 + NaOH
В растворе появляется избыток ионов ОН-, поэтому раствор Na2CO3 имеет щелочную реакцию (рН > 7);
в) сульфат цинка ZnSO4 — соль слабого многокислотного основания Zn(OH)2 и сильной кислоты H2SO4. В этом случае катионы Zn+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH+ .Образование молекул Zn(OH)2 не происходит, так как ионы ZnOН+ диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Zn2+ + Н2О 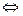 ZnOН+ + Н+
ZnOН+ + Н+
или в молекулярной форме
2ZnSO4 + 2Н2О 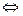 (ZnOH)2SO4 + H2SO4
(ZnOH)2SO4 + H2SO4
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (рН < 7).
Пример 2. Какие продукты образуются при смешивании растворов A1(NO3)3 и К2СО3? Составьте ионно-молекулярное и молекулярное уравнение реакции.
Решение. Соль A1(NO3)3 гидролизуется по катиону, а К2СО3 — по аниону:
А13+ + Н2О 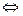 А1ОН2+ + Н+
А1ОН2+ + Н+
СО2-3 + Н2О 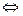 НСО-3 + ОН-
НСО-3 + ОН-
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН-образуют молекулу слабого электролита Н2О. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и СО2 (Н2СО3). Ионно-молекулярное уравнение:
2А13+ + 3СО2-3 + ЗН2О = 2А1(ОН)3 + 3СО2
молекулярное уравнение:
3СО2 + 6KNO3
2A1(NO3)3 + ЗК2СО3 + ЗН2О = 2А1(ОН)3
ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ
Обеззараживание воды
Обеззараживание- это обработка воды в целях санитарно – гигиенической безопасности воды.
Пример 1. Расчет активного хлора в хлорсодержащем агенте. Рассчитать количество активного хлора в хлорной извести следующего состава
3CaOCl2 ∙Ca(OH)2 ∙5H2O.
Решение: содержание активного хлора в хлорсодержащих веществах в процентах можно рассчитать по следующей формуле::
Cl2(%) = (nM:Mo)100, где
n- число гипохлоритных ионов в молекуле хлорсодержащего вещества;
Mo – молекулярная масса хлорсодержащего вещества;
М – молекулярная масса хлора (71 г/моль).
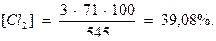
Пример 2. Дехлорирование воды. Определить количество Na2SO3∙7 H2O для дехлорирования 100 м3 воды, содержащей остаточный хлор в количестве 2,5 мг/л.
Решение: 1) согласно ГОСТ концентрация свободного остаточного хлора должна быть не больше 0,5 мг/л. Следовательно необходимо удалить хлор:
[Сl2]=2,5-0,5=2 мг/л; в расчете на 100 м3,

2) Химическое уравнение взаимодействия сульфита натрия (Na2SO3) c хлором
Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl.
Используя метод расчета вещества по химическому уравнению находим:
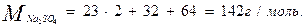
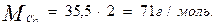
142г Na2SO4 ----- 71г Cl2
х г Na2SO4 ------ 200г Cl2

3) По условию задачи необходимо рассчитать массу кристаллогидрата Na2SO3∙7 H2O. Пересчет на кристаллогидрат:
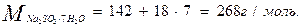
В 268 весовых частях Na2SO3∙7 H2O содержится 142 весовые части Na2SO3.
Составляем пропорцию:
268 г Na2SO3 ∙7H2O -----142г Na2SO3
х г Na2SO3 ∙7H2O ------ 400г Na2SO3
Вопросы аналитической химии
Пример 1 . Для определения содержания ионов Са2+ и Mg2+ в растворе нужно приготовить 500мл 0,01 н. раствора трилона Б. Сколько граммов трилона Б нужно взять?
|
|
Решение. 1)Определяют грамм – эквивалент трилона Б:
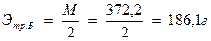
2) Рассчитывают навеску трилона Б для приготовления 500 мл 0,01н. раствора:

Пример 2. Для установки титра раствора трилона Б взята навеска 0,3324 г стандартного образца сплава, содержащего 98,24 % цинка, и после растворения переведена в мерную колбу емкостью 200 мл. На титрование 20,00 мл полученного раствора расходуется 18,50 мл раствора трилона Б. Вычислить: а) нормальность раствора трилона Б; б) молярность раствора трилона Б; в) поправочный коэффициент к ближайшей округленной нормальности: г) Ттр. Б; д) Ттр. Б/Zn.
|
|

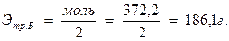
2. Рассчитывают нормальность полученного раствора соли цинка: а) количество граммов цинка в навеске будет
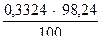 ;
;
б) количество грамм – эквивалентов цинка составит:
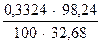 ;
;
в) нормальность полученного раствора будет:
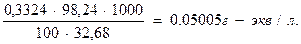
3. Вычисляют нормальность раствора трилона Б:

4. Определяют молярность трилона Б: а) количество граммов трилона Б в 1л раствора будет
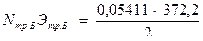 ;
;
б) количество молей трилона Б в 1 л раствора составит
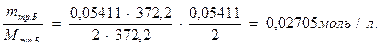
5. Рассчитывают поправочный коэффициент к 0,05 н. раствору трилона Б:
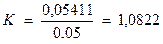 .
.
6. Определяют титр раствора трилона Б:
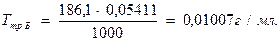
7. Определяют титр раствора трилона Б по цинку:
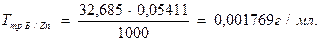
Пример 3. При определении общей жесткости на титрование 100 мл воды было израсходовано 18,10 мл раствора трилона Б (К0,05н.=1,240). Вычислить общую жесткость воды в мг-экв/л и немецких градусах.
Решение. 1) Вычисляют количество миллиграмм – эквивалентов трилона Б в 18,10мл раствора ( столько же миллиграмм – эквивалентов ионов Са2+ и Mg2+ содержится в 100 мл воды):
0,05∙1,240∙18,10.
2) Определяют количество миллиграмм – эквивалентов ионов Са2+ и Mg2+ , содержащееся в 1000мл воды, то есть жесткость воды
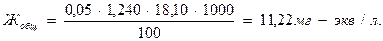
3) Выражают общую жесткость воды в немецких градусах:
а) рассчитывают титр трилона Б по окиси кальция:
Ттр.Б/СаО=0,05∙1,240∙28,04 мг/мл;
б) рассчитывают количество миллиграммов СаО, эквивалентное 18,10 мл раствора трилона Б (или солям, содержащимся в 100мл воды):
Жобщ=0,05∙1,240∙28,04∙18,10=31,47о.
Пример 4. для определения кислорода , растворенного в воде, взяты две пробы в склянки емкостью 500мл. В первую склянку (рабочий опыт) ввели 1,00 мл MnCl2 (пл.1,19 г/см3) и 3,00 мл щелочного раствора иодид – иодата, во вторую(контрольный опыт) – 1,00мл MnCl2, 5,00 мл НСl (пл. 1,19 г/см3) и 3,00 иодид – иодата. В рабочей пробе осадок растворили в НСl. На титрование 200мл раствора контрольной пробы израсходовано 2,80 мл 0,01н. Na2S2O3 ( 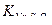 =0,9880); а на титрование иода в рабочем опыте (V=200 vk) – 12,40 мл того же раствора Na2S2O3. Вычислить содержание кислорода, растворенного в воде в мг/л и мл/л при н.у.
=0,9880); а на титрование иода в рабочем опыте (V=200 vk) – 12,40 мл того же раствора Na2S2O3. Вычислить содержание кислорода, растворенного в воде в мг/л и мл/л при н.у.
Решение. 1) определяют количество миллиграмм – эквивалентов иода, которое выделилось в рабочем опыте (в пересчете на 1л анализируемой воды):
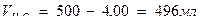 ,
,
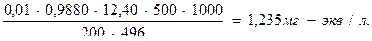
2) Определяют количество миллиграмм – эквивалентов иода, которое выделилось в контрольном опыте (в пересчете на 1 л анализируемой воды):
 ,
,
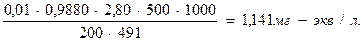
3) Вычисляют, на сколько миллиграмм – эквивалентов иода выделилось больше в рабочем опыте (столько же миллиграмм – эквивалентов кислорода содержалось в 1 л воды):
[I2]=[O2] + [окислители] + [IO-3] –[восстановители], а в контрольном опыте
[I2 [окислители] + [IO-3] –[восстановители],
1,235-0,141=1,094мг-экв/л.
4) Рассчитывают количество миллиграммов кислорода в 1 л воды:
2Mn(OH)2 + O2 =2MnO(OH)2
2 | Mn2+ -2ē = Mn4+
1 | O2 +4ē = 2O2-
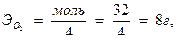 1,094∙8,00=8,75 мг/л.
1,094∙8,00=8,75 мг/л.
5) Рассчитывают количество миллилитров кислорода, содержащееся в 1 л воды:
32 мг кислорода занимают объем 22,4 мл при н.у.
8,75 мг …………………………… х мл
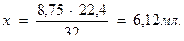
ЗАДАЧИ
1. Начертите диаграмму состояния воды. Какие фазы представлены на диаграмме? Что такое “тройная точка” на диаграмме?
2. По диаграмме состояния воды рассчитайте число степеней свободы в “тройной точке”.
3. Найдите число степеней свободы по диаграмме состояния воды в точке, находящейся на кривой, отвечающей равновесию между льдом и водяным паром.
4. Определить число степеней свободы для точки Х, лежащей внутри жидкой фазы.
5. Определить число фаз в ненасыщенном растворе. Какие?
6. Определить число фаз в насыщенном растворе. Какие?
7. От каких факторов зависит растворимость газов в жидкостях? Как она изменяется с повышением температуры? Каким уравнением устанавливается зависимость растворимости газа от температуры.
8. Растворимость хлора в воде при 20 0С равна 0,729 г в 100 л воды. Вычислите массу хлора, растворенного в 5 л воды при давлении 1520 мм рт.ст. Плотность воды считать равной 1 . (Ответ: 72,7 г).
9. Коэффициент растворимости оксида азота II в воде при 0 0С равен 0,74. Сколько граммов оксида азота II растворится при 0 0С и давлении 1520 мм рт.ст. в 5 л воды. (Ответ: 9,913 г).
10. Коэффициент растворимости хлора в воде при 10 0С Равен 3,26. Вычислите, сколько граммов хлора растворится в 15 л воды при 10 0С и давлении 3040 мм рт.ст. (Ответ: 598 г).
11. Коэффициент растворимости углекислого газа в воде при 30 0С равен 0,738. Вычислить молярную концентрацию углекислого газа в воде, насыщенной углекислым газом при 30 0С и давлении 1520 мм рт.ст. (Ответ: 0,0594 моль/л).
12. В каком объеме воды при 20 0С растворится 0,5 г кислорода парциальное давление которого равно 200 мм рт.ст.? Коэффициент растворимости кислорода при 20 0С равен 0,0338. (Ответ: 42,24 л).
13. Сколько литров воды потребуется, чтобы в ней при 0 0С растворился 1 л углекислого газа, парциальное давление которого равно 150 мм рт. ст. ? Коэффициент растворимости углекислого газа при 0 0С равен 1,71. (Ответ: 1,51 л).
14. Вычислить молярную концентрацию азота в воде, насыщенной азотом воздуха при 0 0С в открытом сосуде. Атмосферное давление равно 760 мм рт.ст., азота в воздухе находится 78%. Коэффициент растворимости азота при 0 0С равен 0,0239. (Ответ: 0,000832 моль/л).
15. Как зависит растворимость газов от концентрации электролитов в воде. Где больше растворенного кислорода в морской воде или в пресных водоемах. Почему?
16. От чего зависит растворимость твердых веществ?
17. От чего и как зависит взаимная растворимость жидкостей? Что такое азеотропные смеси?
18. Произведение растворимости сульфата кальция CaSO4 равно 6,26  10–5. Выпадает ли осадок, если смешать равные объемы 0,01 н. раствора CaCl2 и 0,02 н. раствора Na2SO4?
10–5. Выпадает ли осадок, если смешать равные объемы 0,01 н. раствора CaCl2 и 0,02 н. раствора Na2SO4?
19. Растворимость BaCO3 равна 8,9  10 –5 моль/л. Вычислите произведение растворимости карбоната бария. (Ответ: 7,9∙10-9).
10 –5 моль/л. Вычислите произведение растворимости карбоната бария. (Ответ: 7,9∙10-9).
20. Произведение растворимости PbI2 равно 8,7  10–6. Вычислите концентрацию ионов Pb2+ и ионов I– в насыщенном растворе иодида свинца. (Ответ: 1,3
10–6. Вычислите концентрацию ионов Pb2+ и ионов I– в насыщенном растворе иодида свинца. (Ответ: 1,3  10 –2 моль/л; 2,6
10 –2 моль/л; 2,6  10 –2 моль/л).
10 –2 моль/л).
21. При t=20 0С в 1 л насыщенного раствора иодида серебра AgIO3 содержится 0,044 г соли. Вычислите произведение растворимости этой соли. (Ответ: 3,03  10 –7).
10 –7).
22. В 6,0 л насыщенного раствора PbSO4 содержится 0,186 иона свинца (II). Вычислите произведение растворимости. (Ответ: 2,25∙10-8).
23. Произведение растворимости AgPO4 равно 1,8  10–18. Вычислите концентрацию ионов Ag+ и (РО4)3– в насыщенном растворе этой соли. (Ответ: 1,627
10–18. Вычислите концентрацию ионов Ag+ и (РО4)3– в насыщенном растворе этой соли. (Ответ: 1,627  10–5 моль/л; 4,89
10–5 моль/л; 4,89  10–5 моль/л).
10–5 моль/л).
24. Произведение растворимости дихромата серебра Ag2Cr2O7 равно 2,0  10–7. Выпадает ли осадок при смешивании равных объемов 0,01 н. растворов AgNO3 и K2Cr2O7?
10–7. Выпадает ли осадок при смешивании равных объемов 0,01 н. растворов AgNO3 и K2Cr2O7?
25. Произведение растворимости сульфата свинца ПР=2,3  10–8 . Образуется ли осадок, если к 0,1 М раствору Na2SO4 прибавить равный объем 0,1 н. раствора ацетата свинца Pb(CH3COO)2?
10–8 . Образуется ли осадок, если к 0,1 М раствору Na2SO4 прибавить равный объем 0,1 н. раствора ацетата свинца Pb(CH3COO)2?
26. В пробирке при комнатной температуре смешаны 1,0 мл 0,2 н. нитрата свинца и 2,0 мл 0,01 н. раствора хлорида натрия. Выпадает ли осадок, если ПР(PbC2)=1,70  10–5?
10–5?
27. Произведение растворимости иодида серебра 8,5  10–7. Образуется ли осадок, если смешать равные объемы
10–7. Образуется ли осадок, если смешать равные объемы
0,02 н. раствора KI и 0,04 н. раствора AgNO3?
28. В 500 г воды растворено при нагревании 300 г NH4Cl. Какая масса NH4Cl выделится из раствора при охлаждении его до 50 0С, если растворимость NH4Cl при этой температуре равна 50 г в 100 г воды? (Ответ: 50 г).
29. Растворимость хлората калия при 70 0С равна 30,2 г, а при 30 0С ‑ 10,1 г в 100 г воды. Сколько граммов хлората калия выделится из 70 г насыщенного при 70 0С раствора, если его охладить до 30 0С? Ответ: 10,8 г.
30. Коэффициент растворимости сульфата меди при 30 0С равен 25 г на 100 г Н2О. Будет ли при этой температуре 18% раствор насыщенным? (Ответ: не будет).
31. Сколько граммов нитрата калия выкристаллизируется из 105 г насыщенного при 60 0С раствора, если охладить его до 0 0С? Коэффициенты растворимости соли при указанных температурах соответственно равны 110 и 13 г в 100 г Н2О. (Ответ: 48,5 г).
32. 1 л воды насыщен СО2 при 0 0С под давлением 500,0 кПа(3800 мм рт. ст.). Какой объем займет растворенный газ, если выделить его из воды и привести к нормальным условиям? Растворимость СО2 при 00С равна 171 мл в 100 мл воды. (Ответ: 8,55л).
33. Растворимость аммиака при 20 0С равна 702 мл в 1 мл воды. Найти массовую долю аммиака в насыщенном растворе. Парциальное давление NH4 считать равным нормальному атмосферному давлению. (Ответ: 33,2%).
34. В 1 л воды при 0 0С растворяется 4,62 л H2S . Под каким давлением надо растворять H2S, чтобы получить 5%‑ный (по массе) раствор? (Ответ: 760кПа).
35. Принимая, что атмосферный воздух содержит 21 %(об) О2 и 79 %(об) N2 , рассчитать процентный состав (по объему) воздуха, выделенного из воды, имевший температуру 20 0С. Коэффициент абсорбции кислорода при этой температуре равен 0,031, а азота 0,0154. (Ответ: 35% О2).
36. Газовую смесь, содержащую 40 %(об) N2О и 60%(об) NО, растворяли при 17 0С и постоянном давлении в воде до полного насыщения последней. Рассчитать процентный состав (по объему) газовой смеси после выделения ее из воды, если при 17 0С коэффициенты абсорбции N2О и NО составляют соответственно, 0,690 и 0,050. (Ответ: 90%(об) N2O: 10%(об) NO).
37. Коэффициент абсорбции СО2 при 0 0С равен 1,71. При каком давлении растворимость СО2 в воде при той же температуре составит 16 г/л ? (Ответ: 483кПа).
38. Вычислить концентрации ионов NH 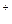 и ОН– в 0,1 М растворе NH4ОН при 25 0С, а также степень диссоциации электролита. (Ответ:
и ОН– в 0,1 М растворе NH4ОН при 25 0С, а также степень диссоциации электролита. (Ответ:  [NH
[NH 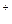 ] = [ OH–] = 1,34
] = [ OH–] = 1,34  10–32 г-ион/л
10–32 г-ион/л 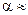 1,34%).
1,34%).
39. Во сколько раз концентрация водородных ионов в 0,1 н. растворе HCl ( 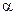 = 0,92) больше, чем в растворе 0,01 н. HСl (
= 0,92) больше, чем в растворе 0,01 н. HСl ( 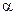 =0,98). (Ответ: в 9,4 раза).
=0,98). (Ответ: в 9,4 раза).
40. Степень диссоциации Н3РО4 по первой ступени в 0,1 М растворе равна 0,17. Не учитывая диссоциацию по следующей ступеням, вычислите концентрацию водородных ионов в растворе. (Ответ: 0,017 моль/л).
41. Степень диссоциации 0,1 н. раствора NН4ОН равна 1,3%. Сколько растворенных частиц (молекул и ионов) содержится в 1 л такого раствора ? (Ответ: 6,18  1022).
1022).
42. При какой молярной концентрации муравьиной кислоты НСООН 95% ее молекулы будут находится в недиссоциированном состоянии, если КД = 2,1  10–4 ? (Ответ: 0,88 моль/л).
10–4 ? (Ответ: 0,88 моль/л).
43. Константа диссоциации сероводородной кислоты по первой ступени КД = =9  10–8. Определите концентрацию водородных ионов в 0,1 М растворе Н2S. (Ответ: 0,95
10–8. Определите концентрацию водородных ионов в 0,1 М растворе Н2S. (Ответ: 0,95  10–5моль/л).
10–5моль/л).
44. Вычислите степень диссоциации азотной кислоты в ее 0,1 М растворе и концентрацию ионов водорода в растворе, если КД=4,6  10–4. (Ответ: 0,21
10–4. (Ответ: 0,21  10–2 моль/л).
10–2 моль/л).
45. Какова концентрация водородных ионов [H+] в 0,1 н. растворе синильной кислоты НСN, если ее константа диссоциации КД=7  10–10? (Ответ: 8,4
10–10? (Ответ: 8,4  106моль/л).
106моль/л).
46. Определить степень диссоциации и концентрацию ионов [OH–] в 0,01 н. растворе NH4OH , если КД = 2  10–5 . (Ответ: 4,4
10–5 . (Ответ: 4,4  10–4 моль/л).
10–4 моль/л).
47. Концентрация насыщенного при t=20 0С раствора сероводородной кислоты Н2S составляет 0,13 моль/л. Константа диссоциации по первой ступени КД= = 1  10–7. Определите концентрацию ионов [H+] и [HS–] .
10–7. Определите концентрацию ионов [H+] и [HS–] .
(Ответ: 1,1  10–4 моль/л).
10–4 моль/л).
48. Вычислите степень диссоциации 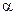 и [H+] d 0,1 М растворе хлорноватистой кислоты, если КД = 5
и [H+] d 0,1 М растворе хлорноватистой кислоты, если КД = 5  10–8. (Ответ: 7,0
10–8. (Ответ: 7,0  10–5).
10–5).
49. Определить рН буферной смеси, приготовленной сливанием 15 мл 0,5 н. раствора СН3СООН с 25 мл 0,2 н. раствора СН3СООNa . Диссоциацию соли считать полной. (Ответ: 4,57).
50. В каком соотношении нужно смешать 0,4 н. раствор СН3СООН с 0,1 н. раствором СН3СООNa , чтобы рН полученного раствора был равен 4,44? Соль диссоциирует полностью. (Ответ: 1 : 2).
51. Сколько миллилитров 0,2 н. раствора уксусной кислоты нужно прибавить к 50 мл 0,25 н. раствора СН3СООNa , чтобы рН полученного раствора был равен 6? Диссоциацию считать полной. (Ответ: 3,47 см3).
52. Сколько миллилитров 0,5 н. раствора хлорида аммония нужно прибавить к 20 мл 0,2 н. раствора аммиака, чтобы рН полученного раствора был равен 9,2. Диссоциацию соли считать полной. (Ответ: 9,08 см3).
53. Сколько безводного ацетата натрия нужно добавить к 0,5 л 1 н. раствора уксусной кислоты, чтобы рН раствора стал равным 4? Степень диссоциации соли ( 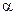 ) = 1. (Ответ: 7,38 г).
) = 1. (Ответ: 7,38 г).
54. Определить рН смеси аммиака и хлорида аммония, если она приготовлена из 0,1 М растворов этих веществ в отношении 1 : 9. Диссоциацию соли считать полной.  . (Ответ: 8,3).
. (Ответ: 8,3).
55. Найти рН фосфатной буферной смеси, приготовленной из 50мл 0,2н. раствора NaH2PO4 и 20мл 0,4н. раствора NaHPO4. Степень диссоциации Na2НРО4 на ионы Na+ и НРО 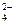 считать равной 1.
считать равной 1. 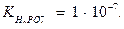 (Ответ: 6,9) .
(Ответ: 6,9) .
56. К 25 мл 0,5 н. раствора аммиака добавлено 25 мл 0,1 н. раствора соляной кислоты. Определить рН полученного раствора, если К 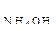 = 1,8
= 1,8  10–5. (Ответ: 9,86).
10–5. (Ответ: 9,86).
57. К 100 мл 0,3 н. раствора уксусной кислоты добавлено 30 мл 0,1 н. раствора едкого натра. Найти рН полученного раствора. (Ответ: 3,79).
58. Чтобы изменить рН на 1 к 10 мл ацетатной буферной смеси потребовалось добавить 0,52 мл 1 н. раствора щелочи. Найти буферную емкость этой соли. (Ответ: 0,052 г-ион/л).
59. Какую величину называют степенью гидролиза соли? Какая из солей имеет большую степень гидролиза FeCl2 или FeCl3? Ответ мотивируйте, составьте уравнения гидролиза солей в молекулярном и ионном виде.
60. Почему изменение температуры раствора влияет на степень гидролиза соли? Составьте уравнения гидролиза по первой ступени для следующих солей: CuSO4 и Na3PO4 , укажите рН.
61. При смещении растворов Al2(SO4)3 и K2S в осадок выпадает гидроксид и выделяется газ. Укажите причину этого процесса и составьте соответствующие молекулярные и ионные уравнения.
62. Какую реакцию имеют растворы следующих солей: Zn (NO3)2, К2СО3, KNO3, NaCN? Ответы подтвердите, составив уравнения гидролиза в молекулярном и ионном виде.
63. В какую сторону сместится равновесие гидролиза КСN, если к раствору прибавить: а) щелочь, б) кислоту? Напишите уравнение гидролиза в молекулярном и ионном виде.
64. Почему растворы К2СО3 и NaCN имеют щелочную реакцию, а растворы NH4Cl и ZnCl2 ‑ кислую? Ответ подтвердите, составив уравнения гидролиза в молекулярном и ионном виде.
65. Подберите по два уравнения в молекулярном виде к каждому из кратких ионных уравнений:
а) Fe2+ +2H2O 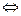 (Fe(OH)
(Fe(OH)  + 2H+
+ 2H+
б) (CO3)2– + H2O 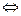 (HCO3)– + OH–
(HCO3)– + OH–
в) (NH4)+ +H2O 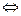 NH4OH + H+
NH4OH + H+
66. При сливании растворов CrCl3 и NaCO3 образуется осадок гидроксида хрома (III). Объясните причину этого явления и напишите соответствующие уравнения в молекулярном и ионном виде.
67. Водородный показатель 0,03 н. раствора гипохлорита калия КСlО равен 9,5. вычислите степень гидролиза это соли и напишите уравнения реакции гидролиза в молекулярном и ионном виде.
68. Определите степень гидролиза (для первой ступени) и рН в 0,001 М растворе K2S (КД = 1,1  10–7) и Na2CO3 (КД = =4,45
10–7) и Na2CO3 (КД = =4,45  10–7). Напишите уравнения реакций в молекулярном и ионном виде.
10–7). Напишите уравнения реакций в молекулярном и ионном виде.
69. Вычислить константу гидролиза фторида калия, определить степень гидролиза этой соли в 0,01М растворе и рН раствора.
70. Вычислить константу гидролиза фторида хлорида аммония, определить степень гидролиза этой соли в 0,01М растворе и рН раствора.
71. Определить рН 0,02н. раствора соды Na2CO3, учитывая только первую ступень гидролиза.
72. Сравнить ступень гидролиза соли и рН среды в 0,1М и 0,001М растворах цианида калия.
73. При 600С ионное произведение воды 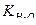 =10-13. Считая, что константа диссоциации хлорноватистой кислоты не изменяется с температурой, определить рН 0,001н. раствора КClО при 25 и при 600С.
=10-13. Считая, что константа диссоциации хлорноватистой кислоты не изменяется с температурой, определить рН 0,001н. раствора КClО при 25 и при 600С.
74. рН 0,1М раствора натриевой соли некоторой одноосновной органической кислоты равен 10. Вычислить константу диссоциации этой кислоты.
75. Исходя из значений констант диссоциации соответствующих кислот и оснований, указать реакцию водных растворов следующих солей: NH4CN, NH4F, (NH4)2S.
76. При рН<3,1 индикатор метиловый красный окрашен в красный цвет, при рН>6,3 – в желтый, при промежуточных значениях рН - в оранжевый цвет. Какова будет окраска индикатора в 0,1 М растворе NH4Br?
77. Одинакова или различна свободная и общая кислотность в 0,1 М растворах НСl ( 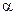
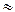 1) и СН3СООН (
1) и СН3СООН ( 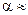 0,3) . Дать объяснение.
0,3) . Дать объяснение.
78. Напишите окислительно-восстановительную реакцию, составьте ионно-электронный баланс: определите молярную массу эквивалента восстановителя: H2S + K2Cr2O7 + H2SO4 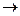 S0 + K2SO4 + Cr2(SO4)3 + H2O
S0 + K2SO4 + Cr2(SO4)3 + H2O
79. Определите молярную массу эквивалента окислителя, написав окислительно-восстановительную реакцию
NaCrO2 + Br2 + NaOH 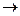 Na2CrO4 + NaBr + H2O
Na2CrO4 + NaBr + H2O
80. Cколько литров хлора (н.у.) можно получить из 200,0 г поваренной соли, если реакция идет по уравнению
NaCl + MnO2 + H2SO4 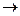 NaHSO4 + MnSO4 + Cl2 +H2O Ответ: 38,3 л.
NaHSO4 + MnSO4 + Cl2 +H2O Ответ: 38,3 л.
81. Какой объем 0,2 н. раствора KNO2 необходим для восстановления 0,05 л 0,1 н. раствора KMnO4 в кислой среде ? Реакция идет по уравнению KMnO4 + KNO2 + +H2SO4 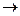 MnSO4 + KNO2 + K2SO4 + H2O Ответ: 0,025 л.
MnSO4 + KNO2 + K2SO4 + H2O Ответ: 0,025 л.
82. Какая масса сульфата натрия Na2SO3 требуется для восстановления 0,05 л 0,1 н. раствора перманганата калия в присутствии серной кислоты? Реакция взаимодействия веществ протекает по уравнению KMnO4 + Na2SO3 + +H2SO4  MnSO4 + K2SO4 + Na2SO4 + H2O (Ответ: 0,315 г).
MnSO4 + K2SO4 + Na2SO4 + H2O (Ответ: 0,315 г).
83. К подкисленному раствору иодида калия КI добавили 0,04 л 0,3 н. раствора нитрата клия КNO2 . Вычислите массу выделившегося иода и объем NO (н.у.), если реакция протекает по уравнению KI + 2 NO3 + H2SO4  I2 + +K2SO4 +No +H2O (Ответ: 0,27 л).
I2 + +K2SO4 +No +H2O (Ответ: 0,27 л).
84. Напишите уравнение реакции, составив ионно-электронный баланс. Рассчитайте ЭДС, используя величины Red‑Ох‑потенциалов:
KMnO4 + HCl 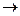 Cl2 + +MnCl2 + KСl + H2O
Cl2 + +MnCl2 + KСl + H2O 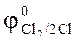 = 1,36 В,
= 1,36 В, 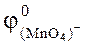 +8H+/Mn2+ +4H2O =1,52 В.
+8H+/Mn2+ +4H2O =1,52 В.
85. Составьте уравнение окислительно-восстановительной реакции, на основании ионно-электронного баланса подберите коэффициенты, рассчитайте ЭДС и определите возможность протекания реакции, пользуясь величинами Red‑Oх‑потенциалов:
KI + FeCl3 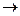 FeCl2 + KСl + I2 ,
FeCl2 + KСl + I2 , 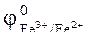 = 0,77 ,
= 0,77 , 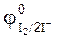 =0,54 B.
=0,54 B.
86. В каком направлении будет протекать реакция CrCl3+Br2+KOH 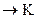 2CrO4+KBr+H2O+KСl, если
2CrO4+KBr+H2O+KСl, если 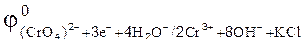 = –0,13 B,
= –0,13 B, 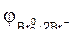 = 1,06 В.
= 1,06 В.
87. Возможна ли реакция между KClO3 и MnO2 в кислой среде, если 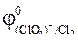 = 1,47 В,
= 1,47 В, 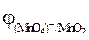 = 1,69 B.
= 1,69 B.
88. В каком направлении будет протекать реакция
СuS + H2O2 + HCl = CuCl2 + S0 + H2O,
если 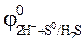 = 0,141 В,
= 0,141 В,  = 1,77 В?
= 1,77 В?
89. Можно ли использовать перманганат калия KMnO4 в качестве окислителя в следующих процессах при стандартных условиях, если 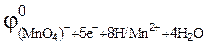 =1,51 В,
=1,51 В,
а) H2S ‑ 2e– 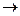 2H+ +S;
2H+ +S;  = 0,141B;
= 0,141B;
б) HNO3 + H2O ‑ 2e-  NO
NO  + 3 H+;
+ 3 H+;  = 0,94 В;
= 0,94 В;
в) 2 Н2О ‑ 2е– =  Н2О2 + 2 Н+ ;
Н2О2 + 2 Н+ ;  = 1,77 В.
= 1,77 В.
90. Можно ли при стандартных условиях окислить в щелочной среде Fe2+ в Fe3+ с помощью хромата калия K2CrO4, если 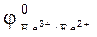 =0,771 В;
=0,771 В;
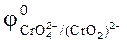 = -0,21 В?
= -0,21 В?
91. Будет ли при стандартных условиях протекать следующая реакция H2S + H2SO3 = S0 + H2O , Если величины энергии Гиббса реагирующих веществ cледующие: 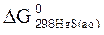 = – 27,36 кДж/моль;
= – 27,36 кДж/моль;
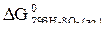 = – 538,41 кДж/моль;
= – 538,41 кДж/моль;
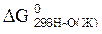 = – 237,5 кДж/моль.
= – 237,5 кДж/моль.
92. Можно ли при стандартных условиях окислить хлористый водород до хлора Cl2 c помощью серной кислоты, если 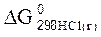 = – 95,27 кДж/моль;
= – 95,27 кДж/моль;
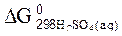 = – 742,00 кДж/моль;
= – 742,00 кДж/моль;
 = – 33,02, кДж/моль;
= – 33,02, кДж/моль;
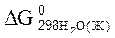 = – 237,50 кДж/моль.
= – 237,50 кДж/моль.
93. Какой из окислителей 2MnO4, PbO2 или K2Cr2O7 лучше всего использовать для получения хлора из HCl? Стандартные Red‑Oх-потенциалы равны: 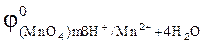 =1,51B;
=1,51B;
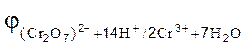 = 1,33 B;
= 1,33 B;
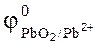 = 1,456 B;
= 1,456 B; 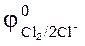 = 1,36 B.
= 1,36 B.
94. Рассчитать Еh и Н2 воды реки, если рН воды 6,6, коэффициент насыщения кислородом равен 90%, Ео=0,840 В.
95. Определить Еh и Н2 для воды реки «В» если рН воды на участке отбора проб равен 8,2, а коэффициент насыщения ее растворенным кислородом ‑121%, Ео=0,750 В.
96. Какие процессы (окисление или восстановление) будут преобладать в водоеме если рН=8,1 коэффициент насыщения воды 80%, Ео=0,72 В.
97. Какие вещества (окислители или восстановители ) попали в водоем если рН воды равно 8,5, а коэффициент насыщения кислородом равен 80%,
Ео=0, 711 В.
98. Напишите формулу мицеллы золя иодида серебра, полученного при взаимодействии разбавленного раствора иодида калия и избытка нитрата серебра. Какой заряд будет иметь гранула?
99. Золь иодида серебра получен добавлением к 20 мл 0,01 н. раствора иодида калия, 28 мл 0,005 н. раствора нитрата серебра. Напишите формулу мицеллы полученного золя и определите направление движения гранулы золя иодида серебра при электрофорезе.
100. Золь бромида серебра получен реакцией двойного обмена 20 мл 0,005 н. раствора нитрата серебра и 30 мл 0,0025 н. раствора бромида калия. Напишите формулу мицеллы полученного золя и определите направление движения гранулы бромида серебра при электрофорезе.
101. Свежеполученный отмытый от электролита осадок гидроксида железа (III) разделили на две порции. К одной добавили небольшое количество хлорида железа (III), а к другой ‑ соляной кислоты. В том и другом случае образовался золь гидроксида железа (III). Напишите формулы мицелл золя. Какой заряд будут иметь их гранулы?
102. Напишите формулу мицеллы сульфата бария, полученного сливанием одинакового объема сильно разбавленного раствора хлорида бария и менее разбавленного раствора серной кислоты.
103. Получены два золя иодида серебра: один из них приливанием 16 мл 0,05 н. раствора нитрата серебра к 20 мл 0,05 н. раствора иодида калия, а другой приливанием 16 мл 0,05 н. раствора иодида калия к 20 мл 0,05 н. раствора нитрата серебра. Будут ли наблюдаться какие-либо явления при сливании их в общий сосуд?
104. Пороги коагуляции электролитов для некоторого гидрозоля равны: С 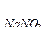 =300 ммоль/л, С
=300 ммоль/л, С 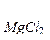 =12,5 ммоль/л, С
=12,5 ммоль/л, С 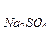 =147,5 ммоль/л, С
=147,5 ммоль/л, С 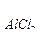 =0,17 ммоль/л. Какой заряд несут частицы золя?
=0,17 ммоль/л. Какой заряд несут частицы золя?
105. Чтобы вызвать коагуляцию 10 мл золя гидроксида железа (III), в каждом случае потребовалось разлить: 7,6 мл 2 н. раствора NaCl, 11 мл 0,01 н. раствора Na2SO4 и 13,5 мл 0,001 н. раствора K3[Fe(CN)6]. Определите знак заряда частиц золя и вычислите порог коагуляции каждого электролита.
106. Чтобы вызвать коагуляцию 10 мл гидрозоля сульфида мышьяка (III) потребовалось в каждом случае прилить 0,25 мл 2 н. раствора NaCl, 1,3 мл 0,01 н. раствора СаСl2 и 2,76 мл 0,001 н. раствора AlCl3. Какой заряд имеют частицы золя? Чему равен порог коагуляции каждого электролита?
107. Для коагуляции 10 мл золя гидроксида железа(III) в каждом случае было добавлено 1,05 мл 1 н. раствора KСl, 6,25 мл 0,01 н. раствора Na2SO4 и 3,7 мл 0,001 н. раствора Na3PO4 . Определите: а) пороги коагуляции;
б) заряд частиц золя; в) отношение коагулирующей способности ионов.
108. Порог коагуляции 0,02 н. раствора K2Cr2O7 по отношению к золю оксида алюминия равен 1,26 моль/м3. Определите количество электролита, необходимое для коагуляции 10 мл этого золя.
109. Пороги коагуляции электролитов для золя сульфида мышьяка (III) равны: С 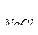 = 60 моль/м3, С
= 60 моль/м3, С 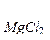 =2,88моль/м3, С
=2,88моль/м3, С 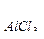 =0,3 моль/м3, С
=0,3 моль/м3, С 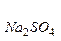 =58,6 моль/м3. Определите заряд гранул золя сульфида мышьяка (III) и отношение коагулирующей способности ионов.
=58,6 моль/м3. Определите заряд гранул золя сульфида мышьяка (III) и отношение коагулирующей способности ионов.
110. Золь бромида серебра получен реакцией двойного обмена 16 мл раствора нитрата серебра молярной концентрации 0,005 моль/л и 40 мл раствора бромида калия молярной концентрации 0,0025 моль/л. Какой из двух электролитов – MgSO4 или K3[Fe(CN)6]- будет иметь больший порог коагуляции для полученного золя?
111. Дан золь гидроксида железа (III) и золь сульфида сурьмы (III). Для коагуляции этих золей применили растворы одинаковой молярной концентрации эквивалента следующих солей: Ca(NO3)2, AlCl3, Na2SO4 и K3[Fe(CN)6]. Какого раствора потребовалось для коагуляции каждого из золей наименьшее и наибольшее количество?
112. Как расположатся пороги коагуляции (в моль/м3) в ряду растворов солей NaCl, AlCl3, Na2SO4 и NaH2PO4 для золя гидроксида железа (III), полученного методом гидролиза? Дайте пояснения.
113. Как расположатся пороги коагуляции (в моль/м3) в ряду растворов солей AlCl3, MgSO4, NaH2PO4 для отрицательно заряженного диоксида кремния? Дайте пояснения.
114. Пороги коагуляции электролитов для некоторого гидрозоля равны: 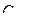 = =300 моль/л,
= =300 моль/л, 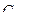 =25 моль/м3,
=25 моль/м3, 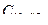 =295 моль/м3,
=295 моль/м3, 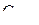 =0,5 моль/м3. Какой заряд несут частицы золя?
=0,5 моль/м3. Какой заряд несут частицы золя?
115. Пороги коагуляции электролитов для золя сульфида мышьяка (III) равны: 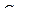 =60 моль/м3,
=60 моль/м3, 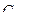 =2,88 моль/м3,
=2,88 моль/м3, 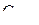 =0,3 моль/м3,
=0,3 моль/м3, 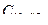 =58,6 моль/м3. Определите заряд гранул золя сульфида мышьяка и отношение коагулирующей способности ионов.
=58,6 моль/м3. Определите заряд гранул золя сульфида мышьяка и отношение коагулирующей способности ионов.
116. Каковы источники поступления в природные воды? От чего зависит концентрация кислорода в воде? Какие компоненты природных вод снижают концентрацию кислорода в воде. Растворимость кислорода в воде при 16 0С и давлении 760 мм рт.ст.равна 9,85 мг/л. При анализе воды содержание кислорода равно 8,1 мг/л. Определить дефицит кислорода. Что можно сказать о качестве воды данного водоема?
117. В водоем был произведен сброс стока содержащего сероводород. При определении содержания кислорода был выявлен дефицит равный 40 %. Как можно объяснить подобные результаты анализа? О чем свидетельствует резкое снижение кислорода в воде по сравнению с его нормальным содержанием?
118. Сколько г-экв Са заключается в следующих количествах этого элемента: а) в 800 мг; б) в 10 г Са.
119. В пробе воды найдено в 50 мл 0,05 г As3+ и 0,01 г As5+. Выразить результаты в мг-экв/л.
120. В растворе имеется: 30 мг/л Са2+, 55 мг/л Сl- и 105 мг/л SO 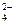 . Выразить данные в мг-экв/л.
. Выразить данные в мг-экв/л.
121. Выразить в мг-экв общую жесткость, если известно что в 10 л ее содержится 3,40 г сернокислого кальция и 1,045 г хлористого магния.
122. В пробе найдено 0,25 мг-экв/л Са2+, 0,35 мг-экв/л Mg2+, 0,15 мг-экв/л НСО 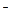 , 0,3 мг-экв/л SO
, 0,3 мг-экв/л SO 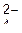 и 0,15 мг-экв/л Сl-. Какие соли содержит эта вода ? Выразить в мг/л.
и 0,15 мг-экв/л Сl-. Какие соли содержит эта вода ? Выразить в мг/л.
123. В 100 мл воды содержится 0,1 мг-экв Na+, 0,3 мг-экв Mg2+, 0,5 мг-экв НСО  , 0,3 Сl–. Какие соли растворены в воде? Определите их содержание мг-экв/л.
, 0,3 Сl–. Какие соли растворены в воде? Определите их содержание мг-экв/л.
124. В 500 мл Н2О содержится 0,2 мг-экв Na+, 0,3 мг-экв Mg2+, 0,2 мг-экв Сl–, 0,5 мг-экв НСО  . Какие соли растворены в воде? Выразите их содержание в мг/л.
. Какие соли растворены в воде? Выразите их содержание в мг/л.
125. В 300 мл воды содержится 0,2 мг-экв К+, 0,2 мг-экв Mg2+, 0,1 мг-экв SO 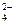 , 0,3 мг-экв NO
, 0,3 мг-экв NO 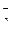 . Какие соли растворены в воде? Выразите их содержание в мг/л.
. Какие соли растворены в воде? Выразите их содержание в мг/л.
126. В 300 мл воды растворено 0,5 г Na2CO3, 0,2 г NaCl, 0,8 г NaHCO3. Сколько мг-экв Na+ в 1 л содержит вода?
127. В 400 мл воды растворено 0,5 г КНСО3, 0,3 г КСl, 0,3 К2SO4. сколько мг-экв К в одном литре содержит эта вода?
128. В 700 мл воды растворено 2,5 г Са(NO3)2, 0,3 г СаСl2, 0,5 г Са(НСО3)2. Сколько мг-экв Са в 1 л содержит эта вода ?
129. Определить, сколько мг-экв Fe2+ содержится в 1 л воды, если в 200 мл ее содержится 2 г FeCl2 , 1 г FeSO4 , 2,5 г Fe(NO3)2.
130. В 350 мл воды содержится 0,7 мг-экв Fe3+ , 0,3 мг-экв Mg2+ , 0,2 мг-экв NO  , 0,5 мг-экв Сl
, 0,5 мг-экв Сl  . Какие соли растворены в воде? Определить их содержание в мг/л.
. Какие соли растворены в воде? Определить их содержание в мг/л.
131. Дать определение общей жесткости; временной, постоянной; карбонатной и некарбонатной жесткости воды. В воде содержатся соли: а)СаНСО3, MgCO3; б)CaCl2 , MgSO4; в)СаНСО3, MgHCO5. Какие виды жесткости обуславливаются солями в каждом из трех случаев?
132. При удалении карбонатной жесткости Na‑катионированием сильно возрастает щелочность воды. Почему? Каковы нежелательные последствия увеличения щелочности воды в паросиловом хозяйстве? Что необходимо предпринять для снижения щелочности? Написать уравнения реакций, отражающих сущность происходящих процессов.
133. Для котлов низкого давления и испарителей применяют метод умягчения воды путем фильтрования через смешанный фильтр, например, КУ‑1 и АН‑17. Каковы преимущества этого метода? Написать уравнения химических реакций, отражающих сущность происходящих процессов.
134. Что такое импфирование воды? Написать уравнения реакций, отражающих сущность метода, процесса. Преимущества и недостатки метода.
135. Для умягчения 100 м3 воды рассчитайте количество извести, если известно, что карбонатная жесткость равна 3 мг-экв/л, содержание ионов магния равно 18 мг/л, содержание двуокиси углерода равно 44 мг/л.
136. Рассчитайте количество соды, необходимое для умягчения 10 м3 воды, если известно, что в 100 мл воды содержится 100 мг СаСl2 и 150 мг MgSO4.
137. Рассчитайте количество соды, необходимое для умягчения 100 м3 воды, если известно, что некарбонатная жесткость воды равна 3 мг-экв/л.
138. В пробе воды объемом 100 мл обнаружено 0,2 СаСl2, 0,1 г MgSO4. Рассчитать количество воды необходимое для умягчения 100 м3 этой воды.
139. В пробе воды объемом 100 мл обнаружено 0,5 г СаНСО3, 0,2 г MgCO3, 0,1 г Mg(HCO3)2, 4,4 г СО2. Определите количество оксида кальция, необходимое для умягчения 100 м3 такой воды.
140. Рассчитать обменную емкость ионита, если известно, что жесткость воды, пропускаемой через катионитовый фильтр, равна 5 мг-экв/л, количество профильтрованной воды до появления ионов кальция в фильтрате равно 10 л. Объем катионита 50 мл.
141. Рассчитать обменную емкость катионита на основании следующих данных. Объем катионита равен 25 мл. В воде, которую пропускают через фильтр, содержится 2 мг/л ионов кальция и 1,5 мг/л ионов Mg2+. Количество воды, пропущенное через катионит до появления ионов Са2+ в фильтрате, равно 5л.
142. Рассчитать обменную емкость катионита если известно, что объем катионита 10 мл, в 100 мл фильтруемой воды содержится 2 мг Са2+ и 1,2 мг Mg2+. Объем профильтрованной воды до появления ионов Са2+ в фильтрате равен 2 л.
143. Обменная емкость катионита КУ-1 равна 1000 г-экв/л. Какое количество воды можно умягчить, пропуская через фильтр объемом 50 мл, если жесткость воды равна 5 мг-экв/л.
144. Обменная емкость катионита КУ-2 равна 1500 г-экв/л. Какое количество потребуется для умягчения 100 м3 с жесткостью 7 мг-экв/л.
145. Даны результаты анализа воды: количество Са2+ ‑ 50 мг/л, Mg2+ ‑ 80 мг/л. Какое количество катионита КУ-1 потребуется для умягчения 10 м3 воды. О  КУ-1 равна 100 г-экв/л.
КУ-1 равна 100 г-экв/л.
146. Жесткость данного образца воды обуславливается? содержанием сульфата магния. При обработке 0,15 л воды карбонатом натрия в осадок выпало 37,8 MgCO3. Чему равна постоянная жесткость воды?
147. Написать уравнения реакций, соответствующих превращениям: CaCl2O  HOCl; NaOCl
HOCl; NaOCl  HOCl; Ca(OCl)2
HOCl; Ca(OCl)2  HOCl; Cl2
HOCl; Cl2  HOCl.
HOCl.
Какой компонент обуславливает обеззараживание воды? Почему?
148. Что такое “активный” хлор? Определить содержание активного хлора в NaCl; в хлорной извести следующего состава: 3 СаОCl2  Ca(OH)3
Ca(OH)3  5 H2O
5 H2O
149. В каких случаях применяется хлорирование с аммонизацией? Написать уравнение реакций, протекающих при превращении NH3  HOCl.
HOCl.
Как выглядит кривая хлороемкости при хлорировании с аммонизацией.
150. Дать определение терминам: постхлорирование, прехлорирование, перехлорирование. Указать величину остаточного хлора для питьевой воды, дозу остаточного хлора для перехлорирования.
151. Определить содержание активного хлора в гидрохлориде натрия следующего состава :
3 NaOCl  Ca(OH)2
Ca(OH)2  3 H2O
3 H2O
152. На дехлорирование 50 л воды пошло 50 г сульфита натрия (Na2SO3  7 H2O). Рассчитать концентрацию избыточного остаточного хлора в воде.
7 H2O). Рассчитать концентрацию избыточного остаточного хлора в воде.
153. Концентрация остаточного хлора равна 2,5 мг/л. Рассчитать количество SO2, пошедшего на дехлорирование 200 м3 воды.
154. Концентрация остаточного хлора в пробе воды равна 1,5 мг/л. Какое количество кристаллического тиосульфата натрия (Na2S2O3  5 H2O) необходимо взять для дехлорирования 200 л воды.
5 H2O) необходимо взять для дехлорирования 200 л воды.
155. ПДК по марганцу на питьевую воду 0,1 мг/л? Какое количество марганца необходимо удалить из 10 м3 воды, содержащей 0,5 мг/л Mn 7+?
156. Рассчитать количество извести Са(ОН)2, необходимое для деманганирования 100 м3 воды, содержащей 0,7 мг/л марганца ( сульфатная форма MnSO4).
157. Рассчитать количество хлора, идущего на окисление Mn ( сульфатная форма MnSO4) при деманганировании 20 м3 воды. Содержание Mn2+ равно 0,5 мг/л.
158. Рассчитать количество диоксида хлора, идущего на деманганирование 10 м3 воды. Содержание Mn2+ (MnSO4) равно 0,04 мг-экв/л.
159. Рассчитать количество озона, идущего на деманганирование 100 м3 воды. Содержание Mn2+ (MnSO4) равно 0,55 мг-экв/л.
160. Рассчитать количество хлорида магния и извести, необходимых для обесфторивания 100 м3 воды. Концентрация фтора в воде равна 6 мг/л. Расход хлорида магния рассчитать по химическим уравнениям и по формулам. Сравнить результаты.
161. Рассчитать количество фосфата кальция, необходимое для обесфторивания 10 м3 воды. Концентрации фтора в воде равна 10 мг/л. По данным расход фосфата кальция составляет 30 мг на 1 мг удаляемого фтора. Сравните с результатами расчетов.
162. Какое количество реагента необходимо взять для фторирования 100 м3 воды, не содержащей ионов фтора. Реагенты: а) фторит натрия, б) гексафторисиликат натрия, в) гексафторкремниевая кислота, г) плавиковая кислота, д) флюраль, е) гексафторсиликат аммония.
163. Какое количество г NaF и воды (мл) необходимо для приготовления 2% раствора NaF, используемый для фторирования 10 м3 воды, не содержащей ионов фтора?
164. Дать определение общей окисляемости. Написать уравнение реакции окисления иодатом калия метанола (СН3 ‑ ОН) в кислой среде.
165. Дать определение частичной (преманганатной) окисляемости. Написать уравнение реакции окисления перманганатом калия сульфида калия в кислой среде.
166. Где окисляемость должна быть наименьшей: а) артезианская вода, грунтовая вода, речная вода; б) грунтовая вода глубина 10 м, 5м, 15 м.
167. При определении концентрации кислорода в пробу воды добавляют щелочную смесь и хлорид марганца. При этом образуется белый, а затем коричневый осадок. Объяснить образование осадка и написать уравнение реакций.
168. Рассчитать концентрацию кислорода если на титрование 200 мл раствора было израсходовано 20 мл 0,01 н. раствора тиосульфата натрия.
169. В пробе воды определено содержание кислорода, равное 7,09 мг/л. Температура воды 20 0С, давление 1 атм. Чему равен дефицит кислорода ?
170. Присутствие каких из указанных веществ в воде может вызвать дефицит кислорода? H2S, Na2SO4, Na2SO3, KMnO4, SO2.
171. Концентрация растворенного кислорода при 20 0С равна 8,99 мг/л. Какое количество Na2SO3  10 H2O необходимо взять для дегазации 10 м3 воды, идущей на питание котлов высокого давления?
10 H2O необходимо взять для дегазации 10 м3 воды, идущей на питание котлов высокого давления?
172. Для удаления кислорода из воды в отдельных видах водопользования применяют диоксид серы, сульфат натрия, гидразин. Какое из перечисленных веществ является предпочтительней? Почему? Напишите уравнения соответствующих реакций.
173. Рассчитать количество гидразина (NH2 ‑ NH2), идущее на дегазацию 10 м3 воды при концентрации растворенного кислорода 7,5 мг/л.
174. Какой электролит предпочтительней для коагуляции золя AgI (электроотрицательного): FeSO4, Al2(SO4)3, NaCl.
175. Какой электролит предпочтительней для коагуляции золя Sb2S3 (электроотрицательного): ZiCl2, MgCl2, Na2SO4, Al2(SO4)3.
176. Указать ион коагулятор для золя AgI (электроположительного): SO  , Fe3+, Al3+, [Fe(CN)6]3 –, SO
, Fe3+, Al3+, [Fe(CN)6]3 –, SO 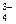 .
.
177. Какой из электролитов лучше применять для коагуляции сульфида мышьяка (электроположительного): NaCl, Na3PO4, AlCl3.
178. Подобрать лучший коагулянт для коллоида Fe(OH)3 (электроположительного): NaCl, Al2(SO4)3, K3[Fe(CN)6] .
179. Какой из электролитов предпочтительней для коагуляции коллоида Bi2S3 (электроотрицательного): FeSO4, Fe2(SO4)3, Na2CO3.
180. Для золя Fe(OH)3 (электроположительного) подобрать коагулянт с меньшим порогом коагуляции: K4[Fe(CN)6], AlCl, CaCl2, Na3PO4.
181. Для золя сульфида цинка ZnS (электроотрицательного) подобрать коагулянт : FeSO4 , Fe2(SO4)3 , NaCl.
182. Для электроотрицательного золя подобрать коагулянт: NaCl , FeCl2, Al2(SO4)3 .
183. Подобрать коагулянт для коллоида Na2SnO3 (электроотрицательного): FeSO4, Al2(SO4)3, NaCl.
184. При электрофорезе обнаружено, что частицы коллоида передвигаются к положительному полюсу. Подобрать электролит: NaCl, FeSO4, K3[Fe(CN)6], K4[Fe(CN)6].
185. Пробы воды взяты в четырех пунктах по течению реки (1,2,3,4). Содержание NH 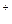 соответственно равно (мг/л) 0,2; 4,5;1,2; 0,2. Что можно сказать о качестве воде на основании проведенных анализов?
соответственно равно (мг/л) 0,2; 4,5;1,2; 0,2. Что можно сказать о качестве воде на основании проведенных анализов?
186. Рассчитать количество извести Са(ОН)2 необходимой для удаления сернокислого железа, при содержании Fe2+ 0,7 мг/л. Объем воды 10 м3. Ответ: 9,25 г.
187. Рассчитать какое количество карбоната кальция (мела) необходимо для обеззараживания 10 м3 воды. Содержание Fe2+ (сульфатная форма) равно 0,5 мг/л.
188. В воде присутствует сероводород. Написать схему процесса, соответствующего окислению сероводорода при определении ХПК бихроматным методом.
189. Определить ХПК сточной жидкости, содержащей в 1л : 1г этилового спирта С2Н5ОН и 5 г глюкозы С6Н12О6.
190. Определить ХПК сточной воды, содержащей в 100 мл 1 г бутанола С4Н9ОН, 0,5 г уксусной кислоты СН3СООН.
191. Для определения жесткости воды нужно приготовить 5 л 0,05 н. раствора трилона Б. Какую навеску трилона Б нужно взять и какие вещества можно использовать для установки титра этого раствора?
192. Какую навеску трилона Б нужно взять для приготовления 2 л 0,025 М раствора?
193. Какую навеску MgSO4∙7H2O нужно взять для установки титра примерно 0,02 М раствора трилона Б способом отдельных навесок и способом пипептирования (Уколбы=250 МЛ)?
194. Приготовлен приблизительно 0,12 н. раствор трилона Б (грамм-эквивалент трилона Б вычислен по реакции с FeCl3). Какова нормальность трилона Б в реакции с двухвалентными катионами и сколько граммов СаСО3 нужно взять для определения точной концентрации раствора, если объем мерной колбы 200 мл?
195. Какую навеску стандартного образца сплава, содержащего 86,00% цинка, нужно взять для установки титра 0,2 н. раствора трилона Б, чтобы на титрование расходовалось примерно 25 мл раствора?
196. Навеску 0,7590 г MgSO4 ∙ 7H2O растворили в мерной колбе емкостью 200мл. На титрование 20,00 мл полученного раствора израсходовано 22,60 мл раствора трилона Б. Вычислить нормальность раствора трилона Б, поправку к нормальности и титр раствора по СаО.
197. Навеску 0,7590 г MgSO4 ∙7Н2О растворили в мерной колбе емкостью 250 мл. На титрование 20,00 мл полученного раствора расходуется 19,85 мл раствора трилона Б. Вычислить титр раствора трилона Б, его молярность и нормальность.
198. Для определения концентрации раствора трилона Б взяли навеску стандартного образца цинка 0,1040 г, содержащего 99,25% цинка, и растворили ее. На титрование раствора израсходовано 18,20 мл трилона Б. Вычислить нормальность раствора трилона Б и титр его по цинку.
199. Навеску 0,1002 г СаСО3 перевели в раствор. На титрование раствора израсходовано 19,90 мл трилона Б. Вычислить нормальность раствора трилона Б и титр его по кальцию.
200. Общая жесткость воды равна 15° (нем.). Вычислить жесткость воды в мг-экв/л.
201. Общая жесткость воды 4,80 мг-экв/л. Вычислить
жесткость в немецких, английских и французских градусах.
202. Для определения общей жесткости взято 100 мл воды и на ее титрование израсходовано 15,40 мл раствора трилона Б (Nтр.Б = 0,04870). Вычислить общую жесткость воды в мг-экв/л.
203. При определении общей жесткости на титрование 200 мл воды было израсходовано 12,60 мл раствора трилона Б (К0,02н.тр.Б = 1,1260). Вычислить общую жесткость воды в мг-экв/л.
204. На титрование 200 мл жесткой воды было израсходовано 18,75 мл раствора трилона Б (Ттр.Б = 0,009304 г/мл). Вычислить общую жесткость воды в мг-экв/л.
205. На титрование 200 мл жесткой воды было израсходовано 14,80 мл раствора трилона Б (Ттр.Б/СаО = 0,001402 г/мл). Вычислить общую жесткость воды в мг-экв/л.
206. На титрование 50,0 мл жесткой воды было израсходовано 8,20 мл раствора трилона Б (Ттр.Б/Са = 0,002004 г/мл). Вычислить общую жесткость воды в мг-экв/л.
207. На титрование 100 мл жесткой воды в присутствии индикатора хромогена черного (рН 9—10) израсходовано 19,20 мл 0,05 н. раствора трилона Б (К =1,025). На титрование 50,00 мл той же воды в присутствии индикатора мурексида (рН 12) израсходовано 8,00 мл трилона Б. Определить содержание магния в воде в мг/л и мг-экв/л.
208. На титрование ионов Са2+ в 100 мл жесткой воды в присутствии индикатора мурексида израсходовано 12,60 мл раствора трилона Б (Ттр.Б = =0,009305 г/мл). Для определения общей жесткости на титрование 50,00 мл воды в присутствии хрома синего кислотного израсходовано 7,50 мл раствора трилона Б. Вычислить общую жесткость воды в мг-экв/л и содержание магния в мг-экв/л.
209. Для определения магния в пробе воды 100 мл осадили ионы кальция в виде оксалата. После отделения осадка СаС2О4 на титрование фильтрата израсходовали 2,58 мл 0,05 н. раствора трилона Б (К=0,9875). Вычислить содержание магния в анализируемой воде в мг/л и мг-экв/л. Написать уравнения реакций, протекающих при определении.
210. В 200 мл воды осадили ионы Са2+, осадок отфильтровали. На титрование фильтрата с промывными водами израсходовано 5,65 мл 0,05 н. раствора трилона (К= 1,046). Определить содержание магния в воде в мг-экв/л и в мг/л.
211. В 100 мл воды осадили ионы Са2+, на титрование ионов Mg2+ в фильтрате израсходовали 3,25 мл раствора трилона Б (Ттр.Б= 0,008800 г/мл. Вычислить содержание магния в мг-экв/л и мг/л анализируемой воды.
212. В 150 мл воды осадили ионы Са2+, и на титрование фильтрата израсходовали 4,18 мл раствора трилона Б (Ттр.Б/СаО =0,001402 г/мл). Вычислить содержание магния в воде в мг-экв/л.
213. В 200 мл воды осадили ионы Са2+. Раствор с осадком перевели в мерную колбу емкостью 500 мл. Осадок отфильтровали и на титрование 200мл фильтрата израсходовали 3,18 мл 0,025 М (раствора трилона Б (К=8790). Определить содержание магния в воде в мг-экв/л.
214. В 100 мл воды осадили ионы Са2+, раствор с осадком перевели в мерную колбу емкостью 250 мл. Осадок отфильтровали. На титрование 100мл фильтрата израсходовали 2,25 мл 0,01 М раствора трилона Б (К=0,7820). Определить содержание магния в воде в мг-экв/л и мг/л.
215. В 100 мл воды осадили ионы Са2+ и раствор вместе с осадком перевели в мерную колбу емкостью 200 мл. Осадок отфильтровали, а на титрование 100мл фильтрата израсходовали 2,48 мл раствора трилона Б (Tтр.Б/ MgО = =0,0008150 г/мл). Вычислить содержание магния в анализируемой воде в мг-экв/л и мг/л.
216. На титрование карбонатной жесткости в 200 мл воды было израсходовано 5,44 мл 0,01 н. НС1 (К= 0,9275). На титрование солей общей жесткости в 100 мл воды было израсходовано 12,50 мл 0,05 н. раствора трилона Б (К=0,8738). Вычислить карбонатную,
общую и некарбонатную жесткости воды в мг-экв/л.
217. При определении карбонатной жесткости на титрование 100 мл воды израсходовано 4,88 мл раствора НС1 (ТНС1= 0,002010 г/мл). При определении общей жесткости на титрование 100 мл воды израсходовано 11,20 мл раствора трилона Б (Ттр.Б = 0,009300 г/мл). Вычислить карбонатную и общую жесткость воды в мг-экв/л.
218. При определении общей жесткости на титрование 50,00 мл воды израсходовано 14,02 мл раствора трилона Б (Ттр.Б /СаО = 0,001360 г/мл). При определении карбонатной жесткости на титрование 100 мл воды израсходовано 16,20 мл 0,05 н. НС1 (ТНС1= 1,1544). Вычислить
общую и некарбонатную жесткость воды в мг-эмв/л.
219. При определении общей карбонатной жесткости на титрование 200 мл воды израсходовано 5,25 мл 0,1010 н. НС1. При определении остаточной карбонатной жесткости 200 мл воды прокипятили, перевели в мерную колбу емкостью 250 мл и выпавший осадок отфильтровали. На титрование 200 мл фильтра затрачено 1,15 мл 0,1010 н. НС1. Вычислить общую карбонатную и устранимую жесткость в мг-экв/л.
220. При определении общей жесткости на титрование 100 мл воды израсходовано 18,20 мл 0,02 н. раствора трилона Б (Ттр.Б = 1,1840). Для определения постоянной жесткости 200 мл воды прокипятили, перевели в мерную колбу емкостью 250 мл и выпавший осадок отфильтровали. На титрование 100 мл полученного фильтрата израсходовано 13,10 мл раствора трилона Б. Вычислить общую, постоянную и устранимую жесткость воды в мг-акв/л.
221. На титрование 50,00 мл воды израсходовано 19,40 мл трилона Б (Ттр.Б/Са = 0,0004008 г/мл). Для определения постоянной жесткости 100 мл воды прокипятили, перевели в мерную колбу емкостью 200 мл и осадок отфильтровали. На титрование 100 мл фильтрата израсходовано 17,30 мл трилона Б. Вычислить устранимую и постоянную жесткость воды в мг-экв/л.
222. Для определения общей жесткости (воды 100 мл ее оттитровали соляной кислотой по индикатору метиловому оранжевому и после переведения карбонатной жесткости в некарбонатную обработали 25,00мл 0,09865 н. раствора щелочной смеси (Na2CO3+NaOH).
Раствор вместе с осадком перевели в мерную колбу емкостью 250 мл. На титрование избытка щелочной смеси в 100 мл фильтрата после отделения осадка израсходовано 4,95 мл раствора НС1 (ТHCl / NaOH= 0,004210 г/мл).
Определить общую жесткость воды, выразив ее
в мг-экв/л.
223. В 250 мл воды содержится 4,60 мг ионов Са2+ и 2,40 мг ионов Mg2+. Определить общую жесткость воды, выразив ее в мт-экв/л.
224. При определении карбонатной жесткости на титрование 200 мл воды израсходовано 2,16 мл 0,1095 н.НС1, затем к воде прибавили 50,00 мл 0,1 н. раствора щелочной смеси (NaOH+Na2CO3; Кщ.с = 0,8074) и раствор
вместе с осадком разбавили в мерной колбе до 500 мл.
Для определения избытка щелочной смеси осадок отфильтровали, а на титрование 250 мл фильтрата израсходовано 15,50 мл 0,1095 н. НС1. Определить общую, карбонатную и некарбонатную жесткость в мг-экв/л.
225. Вода насыщена сульфатом кальция при средней температуре 10° С. Определить жесткость воды в мг-экв/л и немецких градусах.
226. Для определения кислорода, растворенного в воде, взяли две пробы в склянки емкостью 500 мл. В первую склянку (рабочий опыт) ввели 1,00 мл МnС12 и 3,00 мл щелочного раствора иодид-иодатной смеси; во
вторую (контрольный опыт)- 3,00 мл КI+КIO3+КОН, 5,00 мл НС1 и 1,00 мл МnС12. После соответствующей обработки из каждой склянки отобрали по 100 мл раствора. На титрование иода в 100 мл раствора в рабочем
опыте израсходовано 10,25 м-л, а в контрольном -2,20мл 0,01н. Na2S2O3 ( 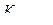 =1,1440). Вычислить содержание кислорода, растворенного в воде, в мг/л и см3/л при н. у.
=1,1440). Вычислить содержание кислорода, растворенного в воде, в мг/л и см3/л при н. у.
227. Для определения кислорода, растворенного в воде, взяли две пробы. В первую склянку емкостью 200мл (рабочий опыт) ввели 1,00 мл раствора МnС12 и 3,00мл щелочного раствора иодид-иодатной смеси, во вторую
склянку емкостью 180 мл (контрольный опыт) - 3,00мл
(KI+КIO3+КОН), 5,00мл раствора НС1 и 1,00мл раствора МnС12. После соответствующих операций на титрование иода в рабочем опыте израсходовано 8,76мл Na2S2O3 (T 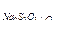 =0,0002600 г/мл), а на титрование
=0,0002600 г/мл), а на титрование
иода в контрольном опыте - 1,40 мл того же раствора Na2S2O3. Вычислить содержание кислорода, растворенного в воде, в мг/л и см3/л при н. у.
228. Для определения кислорода, растворенного в воде, взяли две пробы в склянки емкостью 330,0 мл (рабочий опыт) и 340,0 мл (контрольный опыт). В первую склянку ввели 1,00 мл раствора МnС12 и 3,00 мл щелочного раствора иодид-иодатной смеси, во вторую- 3,00мл КI + КIO3 + КОН, 5,00мл раствора НС1 и 1,00 мл раствора МnС12. После соответствующих операций на титрование иода в рабочем опыте израсходовано 8,40 мл 0,1 н. Na2S2O3 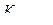 =0,7810), а на титрование иода в контрольном опыте -4,25 мл того же раствора Na2S2O3. Вычислить содержание кислорода, растворенного в воде, в мг/л и см3/л при н. у.
=0,7810), а на титрование иода в контрольном опыте -4,25 мл того же раствора Na2S2O3. Вычислить содержание кислорода, растворенного в воде, в мг/л и см3/л при н. у.
229. Для определения кислорода, растворенного в воде, взяли две пробы в склянки емкостью 295,2 мл (рабочий опыт) и 250,0 мл (контрольный опыт). В первую склянку ввели 1,00 мл раствора МnС12 и 3,00 мл щелочного раствора иодид-иодатной смеси, во вторую — 3,00 мл КI + КIO3 + КОН, 5,00 мл раствора НС1 и 1,00 мл раствора МnС12. На титрование иода в рабочем опыте израсходовано 6,20 мл раствора Na2S2O3 (T  = 0,01581 г/мл), а на титрование иода в контрольном опыте — 2,80мл того же раствора Na2S2O3. Вычислить содержание кислорода, растворенного в воде, в мг/л и см3/л при и. у.
= 0,01581 г/мл), а на титрование иода в контрольном опыте — 2,80мл того же раствора Na2S2O3. Вычислить содержание кислорода, растворенного в воде, в мг/л и см3/л при и. у.
230. Для определения кислорода, растворенного в воде, взяли две пробы в склянки емкостью 315,0 мл (рабочий опыт) и 290,0 мл (контрольный опыт). В первую склянку ввели 1,00 мл раствора МnС12 и 3,00 мл щелочного раствора иодид-иодатной смеси, во вторую — 3,00 мл
KI+КIO3+КОН, 5мл раствора НС1 (пл. 1,19 г/см3) и 1,00 мл раствора МnС12. На титрование иода в рабочем опыте израсходовано 15,40 мл раствора Na2S2O3 (T 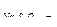 = 0,002234 г/мл), а на титрование иода в контрольном опыте- 3,60мл того же раствора Na2S2O3. Вычислить содержание кислорода, растворенного в воде, в мг/л и см3/л при н. у.
= 0,002234 г/мл), а на титрование иода в контрольном опыте- 3,60мл того же раствора Na2S2O3. Вычислить содержание кислорода, растворенного в воде, в мг/л и см3/л при н. у.
231. Для определения ионов SO 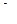 пробу воды обработали катионитом в
пробу воды обработали катионитом в
Н-форме. На титрование 100 мл полученной воды было израсходовано 12,20 мл 0,1 н. Pb(NO3)2 (К  =0,8875). Вычислить содержание ионов SO
=0,8875). Вычислить содержание ионов SO 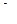 (мг/л) в воде.
(мг/л) в воде.
232. Для определения ионов SO 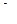 пробу воды обработали Н-катионитом и на титрование 200 мл воды после обработки было израсходовано 15,40 мл 0,05 н. Pb(NO3)2 (К
пробу воды обработали Н-катионитом и на титрование 200 мл воды после обработки было израсходовано 15,40 мл 0,05 н. Pb(NO3)2 (К  =1,246). Вычислить содержание ионов SO
=1,246). Вычислить содержание ионов SO 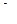 в воде в мг/л.
в воде в мг/л.
233. При определении свободной двуокиси углерода на титрование 200 мл воды было израсходовано 1,80 мл 0,01 н. КОН (КKOH= 0,9930) в присутствии фенолфталеина. Вычислить содержание СО2 в анализируемой пробе
в мг/л.
234. На титрование 200 мл воды в присутствии фенолфталеина израсходовано 2,20 мл раствора NaOH (TNaOH=0,0003628 г/мл). Сколько миллиграммов свободной двуокиси углерода содержалось в 1 л анализируемой воды?
235. Для определения ионов SO 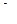 и воде нужно приготовить 3 л 0,02 н. Pb(NO3)2. Сколько граммов соли нужно взять для приготовления раствора?
и воде нужно приготовить 3 л 0,02 н. Pb(NO3)2. Сколько граммов соли нужно взять для приготовления раствора?
236. Сколько граммов K2SO4 нужно растворить в мерной колбе емкостью 250 мл, чтобы определить точную концентрацию 0,02н. Рb(NO3)2.
237. Для определения концентрации раствора Pb(NO3)2 навеска K2SO4 0,3510г растворена в мерной колбе емкостью 200 мл. На титрование 20,00 мл полученного раствора расходуется 21,08 мл раствора Pb(NO3)2. Определить: а) нормальность Pb(NO3)2; б) 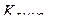 , в) T
, в) T  .
.
238. Сколько миллилитров 0,1 н. раствора нужно разбавить в мерной колбе емкостью 500 мл, чтобы получить 0,02 н. Pb(NO3)2?
239. Сколько миллилитров 60%-ного раствора уксусной кислоты нужно взять для приготовления 5 л 0,02 н. СН3СООН?
240. Сколько миллилитров раствора NaOH (пл.1,43 г/ом3) нужно взять для приготовления 3 л 0,05 н. NaOH?
241. Сколько миллилитров 30%-ного раствора едкого натра нужно взять для приготовления 500 мл 0,05 н. NaOH?
242. Сколько миллилитров 2 н. NaOH нужно взять для приготовления 3л 0,01 н. раствора?
243. Для определения железа в воде колориметрическим методом в две мерные колбы емкостью 25,00 мл ввели в первую 6,00 мл и во вторую 9,00мл стандартного раствора соли железа (Тре=0,0100 мг/мл), в третью колбу — 20,00 мл испытуемого раствора. После добавления соответствующих реактивов были определены оптические плотности растворов на фотоколориметре: А1 = 0,33; А2 = 0,63; Ах = 0,51. Вычислить содержание железа в анализируемой воде в мг/л.
244. Для определения железа в воде в мерных колбах емкостью 50,00 мл были приготовлены стандартный и испытуемый растворы. Для приготовления стандартного раствора взяли 8,00 мл раствора соли железа (III) (ТFe = =0,0100 мг/мл), а для приготовления испытуемого— 25,00 мл воды. После добавления соответствующих реактивов оптические плотности растворов определили на фотоколориметре Аст=0,65; А.х = 0,62. Вычислить концентрацию железа в испытуемом растворе в мг/л.
245. Для определения двуокиси углерода в воде приготовлен примерно 0,01н. раствора NaOH. Навеску 0,3152 г щавелевой кислоты растворили в мерной колбе емкостью 500 мл. На титрование 25,00 мл полученного раствора расходуется 19,80 мл раствора NaOH. Вычислить: а) нормальность NaOH; б)КNaOH; в) 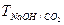 . Какой индикатор можно применить при титровании?
. Какой индикатор можно применить при титровании?
246. Для колориметрического определения железа в воде нужно приготовить стандартный раствор, содержащий 0,1 мг железа в 1,00 мл. Сколько граммов железоаммонийных квасцов нужно взять для приготовления 500 мл такого раствора?
247. При анализе воды для приготовления стандартного раствора соли железа растворили 0,9497г железоаммонийных квасцов NH4Fe(SO4)2∙12Н2О в мерной колбе емкостью 1 л. Вычислить титр полученного раствора в миллиграммах железа.
248. Для определения общего содержания железа в воде нужно приготовить 2 л 3%-иого раствора Н2О2. Сколько миллилитров 30%-ного раствора перекиси водорода (пл. 1 г/см3) и 'воды следует для этого взять?
249. При анализе воды используют 0,1 н. и 0,01 н. растворы HCl. Какие вещества можно использовать для определения точной концентрации кислоты и в присутствии 'Каких индикаторов надо проводить титрование?
250. Для определения карбонатной жесткости воды используют 0,1 н. НСl. Какую навеску Na2B4O7∙ 10Н2О нужно взять для установки титра 0,1 н. НСl способом отдельных навесок, чтобы на титрование расходовалось
не более 25 мл раствора НСl?
251. При определении карбонатной жесткости воды для установки титра раствора НСl навеска 0,5235г Na2B4O7∙10H2O растворена в произвольном объеме воды и на титрование ее израсходовано 24,55 мл раствора НСl. Определить: а) нормальность НСl; б)KHCl в) ТHCl; г) ТHС1/СаО.
252. При определении карбонатной жесткости воды для установки титра раствора НСl навеску 0,2650 г безводного Na2CO3 растворили в мерной колбе емкостью 500 мл. На титрование 20,00 мл полученного раствора
в присутствии метилового оранжевого расходуется 22,80 мл раствора НСl. Определить: а) нормальность НС1; б) КHCl ; в) 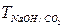 .
.
253. При определении карбонатной жесткости для установки титра раствора НС1 навеска 1,5580 г Na2C2O4 прокалена и переведена в мерную колбу емкостью 250 мл. На титрование 25,00 мл полученного раствора
расходуется 20,65 мл раствора кислоты. Определить: а) нормальность НС1; б)ТНCl/CaO; в)Т 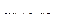 .
.
254. При определении карбонатной жесткости для установки титра раствора НСl взято 25,00 мл раствора Na2CO3 (  =0,05320 г/мл). Раствор разбавлен в мерной колбе емкостью 250 мл. На титрование 25,00 мл полученного раствора расходуется 24,20мл раствора НСl. Определить: а) нормальность НС1; б) KHCl ; в) ТHС1/СаО.
=0,05320 г/мл). Раствор разбавлен в мерной колбе емкостью 250 мл. На титрование 25,00 мл полученного раствора расходуется 24,20мл раствора НСl. Определить: а) нормальность НС1; б) KHCl ; в) ТHС1/СаО.
255. При определении карбонатной жесткости для установки титра раствора НС1 взяты 50,00 мл раствора NaOH (  =0,02205) и переведены в мерную колбу емкостью 500 мл. На титрование 20,00 мл полученного раствора расходуется 19,20 мл раствора НС1. Определить: а) нормальность НСl; б) ТHCl; в) Т
=0,02205) и переведены в мерную колбу емкостью 500 мл. На титрование 20,00 мл полученного раствора расходуется 19,20 мл раствора НС1. Определить: а) нормальность НСl; б) ТHCl; в) Т  .
.
256. При определении карбонатной жесткости воды ампулу «фиксанал» 0,1 г-экв Na2B4O7 ∙ 10H2O перевели в мерную колбу емкостью 500 мл. На титрование 20,00 мл полученного раствора расходуется 22,20 мл раствора НС1. Определить: а) нормальность НС1; б) титр НС1.
257. Для колориметрического определения железа в воде нужно приготовить 500 г 10%-ного раствора сульфосаляциловой кислоты. Сколько граммов сульфосалициловой кислоты и сколько миллилитров воды необходимо для этого взять?
258. Сколько граммов CH3COONa следует взять для приготовления 1,5 л 0,2 М CH3COONa?
259. На титрование 200 мл воды из Невы было затрачено 2,25 мл 0,1 н. КМnО4 (K  =0,8466). Вычислить окисляемость воды и сделать вывод о загрязнении ее, если норма окисляемости по кислороду 7,6 мг/л.
=0,8466). Вычислить окисляемость воды и сделать вывод о загрязнении ее, если норма окисляемости по кислороду 7,6 мг/л.
260. На титрование 100 мл воды из Амура было израсходовано 2,80 мл 0,1н. КМпО4 (K  =0,9450). Вычислить окисляемость воды и сделать вывод о загрязнении ее, если норма окисляемости по кислороду 21,2мг/л.
=0,9450). Вычислить окисляемость воды и сделать вывод о загрязнении ее, если норма окисляемости по кислороду 21,2мг/л.
261. На титрование 200 мл воды из Волги было израсходовано 2,40 мл раствора КМnО4 (Т  = 0,0008240 г/мл). Вычислить окисляемость воды и сделать вывод о загрязнении ее, если норма окисляемости по кислороду 5,5 мг/л.
= 0,0008240 г/мл). Вычислить окисляемость воды и сделать вывод о загрязнении ее, если норма окисляемости по кислороду 5,5 мг/л.
262. Для приготовления аммиачного буферного раствора 20 г хлорида аммония раствор или в воде, добавили 100 мл 25%-того раствора аммиака и довели объем водой до 1 л. Вычислить рН полученного раствора.
263. Для приготовления аммиачного буферного раствора 10 г NH4C1 растворили в; воде, добавили 125 мл 10%-ного раствора аммиака и объем раствора разбавили до 500 мл. Вычислить рН полученного раствора.
264. Навеску 25 г хлорида аммония растворили в воде, добавили 200 мл 14%-наго раствора аммиака; и разбавили водой до 1 л. Можно ли приготовленную буферную смесь использовать при определении жесткости воды? Вычислить рН в полученном растворе.
265. Вода Волги содержит 3,32 мг-экв/л карбонатной жесткости, 6,52 мг-экв/л общей жесткости, 1,56 мг-экв/л магния и 11,0 мг/л свободной двуокиси углерода. Сколько миллиграммов СаО и Na2СО3 нужно взять для пробного умягчения 1 л воды содово-известковым методом?
266. Воду, содержащую 2,35 мг-экв/л общей жесткости, 1,25 мг-экв/л карбонатной жесткости; 7,3 мг/л ионов магния и 3,3 мг/л свободной угольной кислоты, умягчают содово-известковым способом. Сколько граммов СаО и Na2СО3 нужно взять для пробного умягчения 10 л воды?
267. Содово-известковым методом умягчают воду реки Урал. Вода содержит примерно 8,18 мг-экв/л общей жесткости, 5 мг-экв/л карбонатной жесткости, 25,8 мг/л ионов магния и 22 мг/л свободной угольной кислоты. Сколько граммов СаО и Na2СО3 потребуется для пробного умягчения 5 л воды?
268. Содово-известковым методом умягчают воду, содержащую 8,2мг-экв/л общей жесткости, 4,7 мг-экв/л карбонатной жесткости, 29мг/л ионов магния и 18 мг/л свободной угольной кислоты. Сколько граммов соды, содержащей 5% индиферентных примесей, и извести, содержащей 85% СаО, нужно взять для пробного умягчения 10 л воды?
269. Остаточная жесткость воды 0,7 мг-экв/л. Сколько граммов Na3PO4 потребуется для умягчения 20 л воды?
270. Остаточная жесткость воды 0,35 мг-экв/л. Сколько граммов Na3РО4 потребуется для умягчения 100 л воды?
271. Для определения обменной емкости смолу марки КУ-2 поместили в колонку объемам 100 мл и пропустили 11 л воды с общей жесткостью 13,6мг-экв/л до появления ионов Са2+ в фильтрате. Какова обменная емкость смолы?
272. Для определения обменной емкости сульфоугля заполнили им колонку объемом 200 мл. Количество воды, пропущенной через колонку, с жесткостью 7,05 мг-экв/л до появления в фильтрате ионов Са2+ составило 11,35 л. Какова обменная емкость катионита?
273. Рассчитайте жесткость (ммоль/л) насыщенного раствора сульфата кальция при 250С.
274. Рассчитайте жесткость (ммоль Са2+/л) известковой воды с плотностью 1 г/мг при 200С.
275. Минеральная вода «Нарзан» содержит 0,3894 г/л катионов кальция и 0,0884 г/л катионов магния. Рассчитайте суммарную молярную концентрацию (моль/л) катионов.
276. Рассчитайте минимально необходимую массу (г) гидроксида кальция для устранения временной кальциевой жесткости в 1000 л природной воды с содержанием катиона кальция 5,72 ммоль/л.
277. Рассчитайте молярную концентрацию (моль/л) ионов Са2+ в жесткой воде объемом 1,75 л, если после добавления избытка соды выпало 0,0525 г осадка, содержащего кальций.
278. Рассчитайте молярную концентрацию (моль/л) катиона магния в жесткой воде (ионы кальция отсутствуют), если при обработке 2,25 л такой воды избытком соды выпало 1,278 г осадка гидрокарбоната магния.
279. Жесткая вода содержит 50 мг/л гидрокарбоната кальция и 15 мг/л хлорида магния. Какая масса (г) карбоната натрия потребуется для умягчения 1 м3 такой воды? Катионы магния переходят в осадок гидрокарбоната.
280. Определите временную жесткость воды ( в мг/л для гидрокарбонат-ионов), содержащей катионы магния и кальция, если после кипячения 100 л этой воды собрано 2,912 л (н.у.) газа.
281. Рассчитайте молярную концентрацию (моль/л) катионов кальция и магния в жесткой воде если после кипячения 100 л этой воды собрано 2,912 л (н.у.) газа, если общая масса этих катионов равна 4,56 г.
282. Временная жесткость природной воды равна 10 ммоль/л. При кипячении 60 л воды выпало 57,12 г осадка. Определите атомное отношение катионов магния и кальция в природной воде.
283. Определите, сколько мл 0,1 н. раствора трилона Б и 0,1 н. раствора HCl израсходовано при определении жесткости воды методом комплексонометрии, если объем пробы воды равен 100 мл. Результаты анализа: общая жесткость Жо=3 ммоль экв/л, карбонатная жесткость Жк=2,5 ммоль экв/л.
284. Определите, сколько мл 0,1 н. раствора трилона Б и 0,05 н. раствора HCl израсходовано при определении жесткости воды методом комплексонометрии, если объем пробы воды равен 100 мл. Результаты анализа: общая жесткость Жо=2,5 ммоль экв/л, карбонатная жесткость Жк=2 ммоль экв/л.
285. Какую массу и каких реагентов нужно затратить на умягчение 7 л воды, имеющей следующие величины жесткости Жк=4 ммоль экв/л, Жо=5 ммоль экв/л. Составьте уравнения процессов умягчения.
286. Какую массу и каких реагентов нужно затратить на умягчение 7 л воды, имеющей следующие величины жесткости Жк=1,6 ммоль экв/л, Жо=2,75 ммоль экв/л. Составьте уравнения процессов умягчения.
287. На умягчение 10 л воды израсходовано Са(ОН)2 массой 3,7 г и Na2CO3 массой 1,06 г. Рассчитайте общую жесткость Жо исходной воды. Составьте уравнения процессов умягчения.
288. На умягчение 150 л воды израсходовано Са(ОН)2 массой 5,57 г и Na2CO3 массой 26,6 г. Рассчитайте общую жесткость Жо исходной воды. Составьте уравнения процессов умягчения.
289. При термическом умягчении 10 л воды образовался осадок массой 2 г. Определите остаточную Жнк, если исходная общая жесткость воды Жо составляла 6,5 ммоль экв/л. Составьте уравнение процесса умягчения.
290. При термическом умягчении 20 л воды образовался осадок массой 2 г. Определите остаточную Жнк, если исходная общая жесткость воды Жо составляла 5 ммоль экв/л. Составьте уравнение процесса умягчения.
291. В 4 м3 воды содержаться Са(НСО3)2 массой 648 г и CaCl2 массой 1335 г. Определите жесткость, солесодержание и рН воды.
292. В 10 м3 воды содержаться Са(НСО3)2 массой 2430 г и CaCl2 массой 1110 г. Определите жесткость, солесодержание и рН воды.
293. Сколько литров 2 М раствора сульфита натрия Na2SO3 необходимо израсходовать для восстановления кислорода, растворенного в 50 м3 питательной воды, содержащей 3,2 мг/л О2?
294. Сколько литров 1 М раствора сульфита натрия Na2SO3 необходимо израсходовать для восстановления кислорода, растворенного в 500 м3 питательной воды, содержащей 0,4 мг/л О2?
295. Сколько литров 1,5 М раствора гидразина N2H4 необходимо израсходовать для восстановления кислорода, растворенного в 50 м3 питательной воды, содержащей 3,2 мг/л О2?
296. Сколько литров 1 М раствора гидразина N2H4 необходимо израсходовать для восстановления кислорода, растворенного в 325 м3 питательной воды, содержащей 0,64 мг/л О2?
297. В 3 л воды растворен 1 л CO2. Рассчитайте рН раствора.
298. В 7 л воды растворено 4 л CO2. Рассчитайте рН раствора.
299. Рассчитайте, как изменилась в воде концентрация ионов Са+, если в воду после фильтрования через Na – катионит перешло 23 мг/л Na+.
300. Рассчитайте изменение жесткости воды в результате Na-катионирования, если концентрация ионов Na+ в воде увеличилась на 46 мг/л. Составьте уравнение процесса. Изменилось ли солесодержание воды?
301. Рассчитайте изменение жесткости воды в результате Na-катионирования, если концентрация ионов Na+ в воде увеличилась на 23 мг/л. Составьте уравнение процесса. Изменилось ли солесодержание воды?
302. Общая жесткость воды равна 4,1 ммоль экв/л. Через ионообменный фильтр пропущено 100 л Н2О. Сколько молей эквивалентов Ca+, Mg2+ задержано фильтром, если жесткость воды при этом снизилась до 0,1 ммоль экв/л? Составьте уравнения процессов.
303. Общая жесткость воды равна 6 ммоль экв/л. Через ионообменный фильтр пропущено 10 л Н2О. Сколько молей эквивалентов Ca+, Mg2+ задержано фильтром, если жесткость воды при этом снизилась до 0,5 ммоль экв/л? Составьте уравнения процессов.
304. Рассчитайте изменение жесткости воды в результате Н-катионирования, если в воду перешло 10 мг/л ионов Н+. Составьте уравнение процесса.
305. Рассчитайте массу гидразина N2H4, которую нужно ввести для обескислороживания 1 куб. м воды, содержащей 64 мг/л кислорода, если в воду предварительно было введено 126 мг/л сульфита натрия Na2SO3. Составьте уравнения процессов.
306. Рассчитайте массу гидразина N2H4, которую нужно ввести для обескислороживания 20 м3 воды, содержащей 32 мг/л кислорода, если в воду предварительно было введено 63 мг/л сульфита натрия Na2SO3. Составьте уравнения процессов.
307. В 5 л воды растворено 2 л СО2 и 3 л NH3. Рассчитайте рН раствора.
308. Рассчитайте солесодержание воды, в которой было растворено 162 мг/л Са(НСО3)2 после Н-катионирования и ОН-анионирования, если при этом образовалось 1,95 ммоль/л воды.
309. Рассчитайте солесодержание воды, в которой было растворено 222 мг/л CaCl2 после Н-катионирования и ОН-анионирования, если при этом образовалось 3,8 ммоль/л воды.
310. Согласно анализу, жесткость воды составила: Жо=2,5 ммоль экв/л, Жк=2 ммоль экв/л. Исходя из анализа жесткости, считая, что в воде содержаться только соли CaCl2 и Са(НСО3)2 , рассчитайте: а) солесодержание и рН исходной воды; б) солесодержание воды после Na-катионирования; в) рН воды после Н-катионирования; г) солесодержание и рН воды после параллельного Н – Na-катионирования.
311. Согласно анализу, жесткость воды составила: Жо=3,5 ммоль экв/л, Жк=2 ммоль экв/л. Исходя из анализа жесткости воды, считая, что в воде содержаться только соли CaCl2 и Са(НСО3)2 , рассчитайте: а) солесодержание и рН исходной воды; б) солесодержание воды после Na-катионирования; в) рН воды после Н-катионирования; г) солесодержание и рН воды после параллельного Н – Na-катионирования.
312. Согласно анализу, жесткость воды составила: Жо=5 ммоль экв/л, Жк=4 ммоль экв/л. Исходя из анализа жесткости воды, считая, что в воде содержаться только соли CaCl2 и Са(НСО  )2 , рассчитайте: а) солесодержание и рН исходной воды; б) солесодержание воды после Na-катионирования; в) рН воды после Н-катионирования; г) солесодержание и рН воды после параллельного Н – Na-катионирования.
)2 , рассчитайте: а) солесодержание и рН исходной воды; б) солесодержание воды после Na-катионирования; в) рН воды после Н-катионирования; г) солесодержание и рН воды после параллельного Н – Na-катионирования.
313. При упаривании 100 л воды на дне сосуда осталось 50 г СаСО3. Общее умягчение воды при этом составило 83%. Определите массу реагента, который нужно ввести в воду для полного ее умягчения. Напишите уравнения термического и реагентного умягчения.
314. В 10 л воды содержатся Са(НСО3)2 массой 3240 мг, MgCl2 массой 950 мг и NaCl массой 29 мг. После реагентного умягчения воды ее жесткость снизилась: Жк – на 70%, Жнк – на 75%. Рассчитайте остаточные жесткость Жо и солесодержание обработанной воды.
315. В 1м3 воды содержатся Са(НСО3)2 массой 162 г, MgCl2 массой 95 мг и NaCl массой 29мг. После реагентного умягчения воды ее жесткость снизилась: Жк – на 85%, Жнк – на 80%. Рассчитайте остаточные жесткость Жо и солесодержание обработанной воды.
ГЛОССАРИЙ
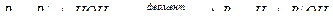

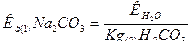
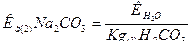 , где Кг(1) и Кг(2) – константы гидролиза по первой и второй ступени соответственно.
, где Кг(1) и Кг(2) – константы гидролиза по первой и второй ступени соответственно.
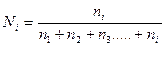 ,
где Ni – мольная доля компонента i.
,
где Ni – мольная доля компонента i.
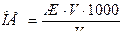 где
ОЕ – обменная емкость ионита, г-экв/м3;
Ж – жесткость воды, мг-экв/л;
V – количество профильтрованной воды до появления ионов кальция в фильтрате (до 0,05 мг-экв/л), л;
V1 – объем катионита, мл;
1000 – коэффициент перехода от миллиграммов к гаммам и от миллилитров к кубометрам (или от мг-экв/мл к г-экв/м3).
где
ОЕ – обменная емкость ионита, г-экв/м3;
Ж – жесткость воды, мг-экв/л;
V – количество профильтрованной воды до появления ионов кальция в фильтрате (до 0,05 мг-экв/л), л;
V1 – объем катионита, мл;
1000 – коэффициент перехода от миллиграммов к гаммам и от миллилитров к кубометрам (или от мг-экв/мл к г-экв/м3).
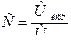 ;
Где Щисх – щелочность воды в естественном состоянии, мг-экв/л;
Щнас – щелочность воды после встряхивания её с карбонатом кальция, мг-экв/л.
;
Где Щисх – щелочность воды в естественном состоянии, мг-экв/л;
Щнас – щелочность воды после встряхивания её с карбонатом кальция, мг-экв/л.
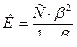 ,
где К – константа гидролиза соли,
С – молярная концентрация соли, моль/л.
,
где К – константа гидролиза соли,
С – молярная концентрация соли, моль/л.
Литература
1. Глинка, Н.Л. Общая химия / Н.Л. Глинка; под ред. А.И. Ермакова.- Изд. 30-е, испр.. – М.: Интеграл – Пресс, 2006. -727с.: ил.
2. Ивчатов, А.Л. Химия воды и микробиология: учебник для сред. спец. учеб. заведений по специальности «Водоснабжение и водоотведение» / А.Л. Ивчатов, В.И. Малов. – М.: ИНФРА – М, 2006. – 216, [1] с.:ил.. – (Среднее профессиональное образование).
3. Тарасова, Н.П. Задачи и вопросы по химии окружающей среды / Н.П. Тарасова, В.А. Кузнецова, Ю.В. Сметанников и др.. – М.: Мир, 2002. – 386 с.: ил.
СОДЕРЖАНИЕ
| Приложение | 4 |
| ОБЩЕТЕОРЕТИЧЕСКИЕ ОСНОВЫ КУРСА 1. Фазовые равновесия. Диаграмма состояния воды. | 5 |
| 2. Растворимость веществ в воде 2.1. Растворимость газов в жидкостях | 6 6 |
| 2.2. Произведение растворимости | 8 |
| 2.3. Определение коэффициента растворимости соли | 9 |
| 2.4. Способы выражения концентраций растворов | 10 |
| 2.5. Свойства растворов | 12 |
| 3. Электролитическая диссоциация | 13 |
| 3.1. Вычисление изотонического коэффициента по величине осмотического давления | 13 |
| 3.2. Определение константы диссоциации слабого бинарного электролита | 14 |
| 3.3. Вычисление степени диссоциации слабого электролита | 14 |
| 3.4. Вычисление [Н+] в растворе одноосновной сильной кислоты | 14 |
| 3.5. Вычисление [Н+] в растворе одноосновной слабой кислоты | 14 |
| 3.6. Вычисление [Н+] в растворе слабой многоосновной кислоты | 15 |
| 3.7. Вычисление [ОН-] и рОН в растворах оснований | 15 |
| 3.8.Определение рН буферного раствора (слабая кислота и ее соль) | 15 |
| 3.9. Определение рН буферной смеси (слабое основание и ее соль) | 16 |
| 3.10. Определение буферной емкости раствора | 16 |
| 4. Гидролиз солей | 17 |
| 4.1. Вычисление константы гидролиза соли | 18 |
| 4.2. Вычисление степени гидролиза соли | 18 |
| 5. Окислительно – восстановительные процессы. Окислительно – восстановительные потенциалы | 19 |
| ФИЗИКО - ХИМИЧСЕКИЕ ОСНОВЫ ПРИРОДНЫХ И СТОЧНЫХ ВОД 6. Коллоидные растворы. Коагуляция | 23 23 |
| ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ 7. Физико – химическая характеристика природных вод | 25 25 |
| 7.1. Формы выражения результатов анализа | 25 |
| 7.2. Физико – химические процессы в гидросфере | 26 |
| 7.3. Основные процессы обработки воды | 51 |
| 7.3.1. Умягчение и обессоливание воды | 51 |
| 7.3.2. Обеззараживание воды | 52 |
| 7.3.3. Определение стабильности и агрессивности воды | 52 |
| 7.3.4. Химическая потребность в кислороде (ХПК) | 55 |
| 7.4. Вопросы аналитической химии | 55 |
| ЗАДАЧИ | 58 |
| ГЛОССАРИЙ | 83 |
| Приложения |
Г.А. Тихановская, Л.М. Воропай
ХИМИЯ ВОДЫ
Задачи и упражнения
|
|
Учебное пособие
Вологда
20 10
Федеральное агентство по образованию
Вологодский государственный технический университет
Г.А. Тихановская, Л.М. Воропай
ХИМИЯ ВОДЫ
Задачи и упражнения
Учебное пособие
Утверждено редакционно – издательским советом ВоГТУ
в качестве учебного пособия
Вологда
2010
УДК 543.39 (075)
ББК 38.761я73+26.22
Рецензенты:
кандидат химических наук, доцент ВГМХА Т.Л. Бланк;
главный специалист ООО «Александра Плюс» М.А. Тихонов.
.
Дата: 2019-02-02, просмотров: 476.