Пример 1. Выразите содержание главных катионов и главных анионов морской воды в промилле и миллимолях на литр.
Решение. Приведенные в приложении 2 значения концентраций главных компонентов морской воды, выраженные в млн-1, показывают количество мг соответствующего иона на 1 кг раствора.
Концентрация выраженная в промилле, характеризует количество граммов вещества в 1 кг раствора. Для перевода концентрации, выраженной в млн-1, в промилле необходимо лишь уменьшить исходную концентрация в тысячу раз:
С(‰) = С′(млн -1)∙10-3 .
Для выражения концентрации главных компонентов морской воды в миллимолях на литр следует значение концентрации соответствующего компонента, выраженное в промилле, разделить на его молярную массу и умножить на плотность воды, выраженную в кг на литр раствора, и на 1000 (для перевода молей миллимоли):
С′′(моль/л) = С(‰) ∙ ρ(кг/л) ∙ 1000/М (г/моль).
Полученные значения концентраций удобно представить в виде таблицы:
| Компонент | Содержание в морской воде | ||
| Млн-1 Мг/л | ‰ г/мл | Моль/л* | |
| Катионы: Na+ Mg2+ Ca+ K+ Анионы: Cl- SO42- HCO3- | 10560 1270 400 380 18980 2650 140 | 10,56 1,27 0,40 0,38 18,98 2,65 0,14 | 459,1 52,3 10,0 9,7 534,6 27,6 2,3 |
*Плотность морской воды принята равной 1 кг/л.
Ответ: представлен в таблице.
Пример 2. Представьте в виде формулы средний состав морской воды, в которой содержание растворенного диоксида углерода составляет 1000 мг/л.
Решение. Для решения задачи следует определить концентрации в %-экв. соответствующих примесей в воде и записать состав в соответствии с принятыми правилами в виде дроби.
Поскольку %-экв. определяет долю (в %) концентрации соответствующей примеси, выраженной в моль-экв./л или в моль-экв./л, от общей концентрации в моль-экв./л или ммоль-экв./л. суммы анионов или катионов, присутствующих в данном растворе, то прежде всего необходимо выразить концентрации анионов и катионов в ммоль-экв/л и найти их суммы.
Для перевода концентрации в ммоль-экв./л необходимо разделить значение концентрации компонента, выраженное в ммоль-экв./л, на соответствующий фактор эквивалентности:
Сi (ммоль-экв./л ) = Сi (моль/л)f,
где f – фактор эквивалентности, который равен 1/2для двухзарядных анионов и катионов и 1 для однозарядных ионов.
На следующем этапе определим суммарные концентрации анионов и катионов в моль-экв./л и процентное содержание концентрации каждого иона от соответствующей суммы. Полученные значения представляют собой концентрацию, выраженную в %-экв.
Результаты вычислений для анионов и катионов морской воды представлены в таблице:
| Компонент | Содержание в морской воде | |||
| моль/л | ммоль-экв./л | %-экв | г/л | |
| Катионы: Na+ Mg2+ Ca+ K+ Сумма катионов Анионы: Cl- SO42- HCO3- Сумма анионов | 459,1 52,3 10,0 9,7 - 534,6 27,6 2,3 - | 459,1 104,6 20,0 9,7 593,4 534,6 55,2 2,3 592,1 | 77,4 17,6 3,6 1,7 100 90,3 9,3 0,4 100 | 10,60 2,50 0,40 0,39 13,80 18,98 2,65 0,14 21,77 |
Значение минерализации воды можно принять равным сумме концентраций примесей, выраженных в г/л. Для определения концентрации примесей в г/л следует умножить соответствующее значение, выраженное в ммоль/л, на молярную массу иона и разделить на 1000:
Сi (г/л) = Сi (ммоль/л) ∙ Мi/1000.
Величина минерализации воды в рассматриваемом случае при округлении до целого грамма равна 35.
Состав морской воды в виде формулы можно представить как дробь, в числителе которой в порядке уменьшения концентрации записаны химические символы всех анионов, кроме HCO3- , а в знаменателе - всех катионов, представленных в таблице, поскольку их содержание превышает 1%-экв. Рядом с химическим символом иона в скобках указана его концентрация, выраженная в %-экв. Слева перед дробью в виде химической формулы и числа, характеризующего концентрацию в мг/л, записано содержание в воде диоксида углерода (см. условие задачи). Далее – округленная величина общей минерализации воды (М), выраженная в г/л, деленная на сумму ммоль-экв. анионов в растворе. Таким образом, состав данной воды можно представить в виде следующей формулы:
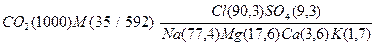 .
.
Ответ: см. формулу.
Пример 3. Оцените сколько граммов поваренной соли (NaCl) содержится в 1 кг морской воды, отобранной в одном из заливов Баренцева моря, если ее хлорность равна 15‰
Решение. Соотношение основных компонентов морской воды под действием материкового стока может незначительно меняться. Однако для проведения оценки этими изменениями можно пренебречь и для решения задачи воспользоваться законом Дитмара.
Как было показано в примере 2, содержание ионов натрия в морской воде составляет 459, 1 ммоль/л, а содержание ионов хлора - 534,6 ммоль/л, следовательно, часть ионов хлора в морской воде связана с другими катионами. Поэтому для определения содержания NaCl в воде залива необходимо определить концентрацию катионов натрия в этой воде.
В соответствии с законом Дитмара соблюдается равенство отношения концентраций ионов натрия и хлора для среднего состава морской воды и воды из залива Баренцева моря:
CNa/CCl = C′Nа/C'Cl ,
где CNа, C′Nа и CCl, C'Cl – концентрация (‰) ионов натрия и хлора для среднего состава морской воды и воды залива соответственно.
Отсюда легко определить содержание ионов натрия в воде залива(C′Nа) принимая концентрацию ионов хлора в воде залива (C'Cl) равной значению хлорности этой воды и концентрации ионов натрия и хлора в ‰ равными значениям для среднего состава морской воды (см. пример 1):
C′Nа = CNа C'Cl / CCl = 10,56 ∙ 15,00/18,98 = 8,34(‰).
Следовательно, в 1 кг воды из залива Баренцева моря содержится 8,34 г катионов натрия. Зная молярную массу NaCl, найдем массу поваренной соли, содержащейся в 1 кг воды из залива:
m NaCl = M NaCl C′Nа /M Nа = 58,5 ∙ 8,34/23,0 = 21 (г/кг).
Ответ: в 1 кг воды из Баренцева моря содержится 21 кг NaCl.
Пример 4. К какому классу вод по минерализации следует отнести природные воды, состав которых соответствует среднему составу речной воды? При оценке принять:
а) другие примеси в воде отсутствуют; б) плотность речной воды равна 1000г/л; в) при экспериментальном определении минерализации все гидрокарбонат-ионы перейдут в карбонат-ионы, а все остальные ионы образуют безводные соли, устойчивые при 105°С.
Решение. По условию задачи состав природной воды соответствует среднему составу воды в реках. Содержание примесей в этой воде, как видно из табл.2.2, составляет (млн-1); Са2+ - 20; Nа+ - 5,8; Mg2+ - 3,4; К+- 2,1; HСО 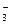 - 35; SO
- 35; SO 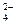 - 12; Сl- - 5,7.
- 12; Сl- - 5,7.
Значение минерализации природных вод определяется в г/л, поэтому необходимо выразить концентрации анионов и катионов в этих единицах. Поскольку плотность воды по условию задачи равна 1000 г/л, концентрации примесей, выраженные в млн -1 равны концентрациям, выраженным в мг/ л. Поэтому, чтобы получить содержание примесей в г/л , достаточно умножить значение их содержания в млн-1 на 10 -3 :
Сi (г/л) = 10 -3 Ci (млн -1).
Содержание примесей в природной воде, выраженное в г/л, составит: Са2+ - --2,0∙10 -2; Nа+-5,8∙10-3; Mg2+- 3,4∙10 -3; К+-2,1∙10 -3; HСО 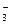 -3,5∙10 -2; SO
-3,5∙10 -2; SO 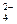 - 1,2∙10-2; Сl- - 5,7∙10 -3.
- 1,2∙10-2; Сl- - 5,7∙10 -3.
По условию задачи при определении минерализации ионы HСО 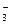 полностью перейдут в ионы СО
полностью перейдут в ионы СО 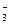 . Процесс разложения может быть представлен следующим уравнением реакции, известным из курса общей и неорганической химии:
. Процесс разложения может быть представлен следующим уравнением реакции, известным из курса общей и неорганической химии:
2 HСО 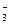 → СО
→ СО 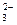 + H2О + СО2.
+ H2О + СО2.
Образующиеся в этом процессе молекулы воды и диоксида углерода не вносят вклада в минерализацию, поскольку при 105°С переходят в газовую фазу.
Концентрации образующихся ионов СО 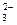 можно определить по уравнению
можно определить по уравнению
[СО 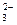 ] = [HСО
] = [HСО 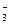 ]∙МСО32- - /(2М HСО3-),
]∙МСО32- - /(2М HСО3-),
где [СО 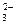 ] и [HСО
] и [HСО 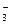 ] – концентрации карбонат- и гидрокарбонат – ион (г/л) соответственно, МСО32- и М HСО3- - молярные массы карбонат- и гидрокарбонат – ион (г/моль).
] – концентрации карбонат- и гидрокарбонат – ион (г/л) соответственно, МСО32- и М HСО3- - молярные массы карбонат- и гидрокарбонат – ион (г/моль).
Концентрация ионов СО 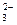 , образующихся при определении минерализации воды, может составить:
, образующихся при определении минерализации воды, может составить:
[СО 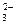 ] = 3,5∙10 -2 ∙ 60/ (2 ∙ 61) = 1,7 ∙ 10 -2 (г/л).
] = 3,5∙10 -2 ∙ 60/ (2 ∙ 61) = 1,7 ∙ 10 -2 (г/л).
Поскольку по условию задачи все ионы, кроме HСО3-, образуют безводные соли, устойчивые при 105°С, а гидрокарбонат-ионы переходят в ионы СО32- и также образуют соли, значение минерализации можно определить по сумме концентраций ионов СО32- и остальных ионов, присутствующих в исходной воде:
М = [СО 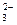 ] + [Са2+] + [Na+] + [Mg2+] + [К+] + [SО
] + [Са2+] + [Na+] + [Mg2+] + [К+] + [SО 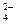 ]+ [Cl-];
]+ [Cl-];
М = 1,7·10-2 + 2,0 ·10-2 + 5,8 ·10-3 + 3,4 ∙ 10-3 + 2,1 ∙ 10-3 +- 1,2 ∙10-2 + 5,7·10-3 = 6,6 ∙ 10-2 (г/л).
Поскольку полученное значение минерализации меньше 0,2 л, природные воды, отвечающие среднему составу речной воды, следует отнести к ультрапресным водам.
Ответ: природные воды, отвечающие среднему составу речной воды, следует отнести к ультрапресным водам.
Пример 5. Охарактеризуйте морскую воду в соответствии с классификацией, разработанной О.А. Алекиным.
Решение. Преобладающим анионом в морской воде является анион хлора, поскольку его концентрация, выраженная в ммоль-экв/л, намного превосходит концентрации других анионов (см. пример 2). Поэтому морские воды следует, отнести к классу хлоридных вод.
Преобладающим катионом в морской воде является катион натрия (см. пример 2), поэтому эти воды следует отнести к группе натриевых вод.
Для определения типа воды просуммируем, концентрации катионов кальция и магния в морской воде, выраженные в моль-экв/л, и сравним сумму с концентрацией гидрокарбонат-иона:
С Са2+ + С Мg2+ = 10,0 + 45,3 + = 55,3 ммоль-экв./л >С НСО3- = 2,3ммоль-экв./л.
Следовательно, морская вода не относиться к первому типу вод.
Сравним суммарную концентрацию анионов HСО3- и SO42- с суммарной концентрацией катионов кальция и магния в морской воде:
С HСО3- + С SO42- = 2,3 + 27,6 = 29,9 ммоль-экв./л <ССа2+ + СМg2+ = 55,3 ммоль-экв./л.
Следовательно, морская вода не относиться ко второму типу.
Сравним концентрации ионов хлора и натрия, выраженные в моль-экв./л:
ССl- = 534,6 ммоль-экв./л›СNа+ = 459,1 ммоль-экв./л.
Следовательно, морскую воду следует отнести к третьему типу вод.
Ответ: по классификации О.А. Алекина морскую воду следует отнести к классу хлоридных вод натриевой группы третьего типа.
Пример 6. На сколько миллиграммов в каждом литре воды уменьшится равновесное содержание кислорода в верхнем слое воды природного водоема при увеличении температуры приземного воздуха с 5 до 25 °С, если его парциальное давление не изменилось, концентрация кислорода соответствует средним для приземного слоя значениям, давление воздуха соответствует стандартным значениям? Парциальным давлением паров воды можно пренебречь.
Решение. Равновесное содержание растворенного кислорода в верхнем слое природного водоема СО2(р-р), в соответствии с законом Генри (см. уравнение (2,1)), зависит от парциального давления кислорода РО2 и значения константы Генри, изменяющейся в зависимости от температуры:
СО2(р-р) = КГ (О2) РО2.
Поскольку по условию задачи парциальное давление кислорода не изменилось, различие равновесных значений концентраций кислорода при температуре 5 и 25°С связано лишь с изменением константы Генри. Поэтому можно записать:
ΔСО2(р-р) = С′О2(р-р) - С′′О2(р-р) = (К′Г (О2) – КГ (О2))РО2,
где С′О2(р-р) , С′′О2(р-р) и К′Г (О2), КГ(О2) – равновесные значения концентрации кислорода в воде и значения константы Генри процесса растворения кислорода в воде при 5 и 25°С соответственно.
Значение константы Генри при различных температурах приводятся в справочной литературе.
К′Г (О2) = 0,00191 моль/(л∙атм) при 5°С,
КГ (О2) = 0,00130 моль/(л∙атм) при 25°С.
Парциальное давление кислорода можно определить, зная общее давление воздуха Робщ и объемную долю кислорода, в приземном слое воздуха άО2 (поскольку по условию задачи парциальным давлением паров воды в воздухе можно пренебречь, объемную долю кислорода можно принять равной объемной доле кислорода для сухого воздуха в приземном слое атмосферы.
РО2 = Робщ аО2 = 1 атм ∙ 0,2095 = 0,2095 (атм).
Равновесное содержание кислорода в растворе равно:
ΔС′О2(р-р) - (0,00191 - 0,00130) ∙ 0,2095 = 1,28 ∙ 10-4 (моль/л).
Для перевода концентрации в мг/л необходимо умножить полученное значение на величину молярной массы кислорода (32 ∙ 10-3 мг/моль):
ΔСО2 = ΔС′О2МО2 = 1,28 ∙ 10-4 ∙ 32 ∙ 10-3 = 4,1 (мг/л).
Ответ: содержание кислорода в каждом литре воды уменьшится на 4,1 мл.
Пример 7. Какая природная вода (из двух) более агрессивна по отношению к гипсу (CaSО4 ∙ 2Н2О), если активность катионов кальция и анионов SО 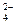 для первой и второй воды составляет:
для первой и второй воды составляет:
a1(Са2+) = 10-3 моль/л, a2(Са2+) = 10-2,8 моль/л,
a1(SО2-4) = 10-1,5 моль/л, a2(SО2-4) = 10-2 моль/л?
Активность гипса в твердой фазе принять равной единице. Температура и давление соответствуют стандартным значениям.
Решение. Активность природных вод по отношению к одному и тому же веществу тем выше, чем больше численное значение показателя агрессивности, который может быть определен по уравнению:
A=lg 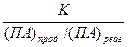
Процесс растворения гипса протекает по уравнению:
CaSO4 ∙ 2H2O ↔Ca2+ + SO 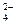 +2H2O.
+2H2O.
По условию задачи необходимо сравнить агрессивность двух различных по составу вод по отношению к одному и тому же соединению, активность которого равна единице, (ПА)реаг=1. Поэтому можно упростить выражение для доказателя агрессивности:
А = lg[К/ ПАi прод].
Поскольку значение константы равновесия процесса растворения гипса при заданных условиях – величина постоянная, показатель агрессивности будет тем больше, чем меньше произведение активностей реагентов в воде. Поэтому для решения задачи необходимо сравнить произведения активностей в различных природных водах:
для первой воды
(ПА)1 = a1(Са2+) a1(SО2-4) = 10-3 ∙10-1,5 = 10-4,5 (моль/л)2
для второй воды
(ПА)2 = a2(Са2+) a2(SО2-4) = 10-2,8 ∙10-2 = 10-4,8 (моль/л)2
Поскольку (ПА)2 < (ПА)1, т.е. (10-4,8 < 10-4,5), вторая природная вода более агрессивна по отношению к гипсу.
Ответ: вторая вода более агрессивна по отношению к гипсу.
Пример 8. Какой процесс-растворение или осаждение гипса - будет происходить при его контакте с природной водой, в которой активность катионов кальция и анионов SO 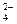 составляют 10-4 и 10-2 моль/л соответственно? Температура и давление соответствуют стандартным значением.
составляют 10-4 и 10-2 моль/л соответственно? Температура и давление соответствуют стандартным значением.
Решение. Процесс растворения гипса, как было сказано, можно описать уравнением реакции: CaSO4 ∙ 2H2O ↔ Ca2+ + SO 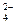 + 2H2O.
+ 2H2O.
Направление процесса (осаждение или растворение) можно определить по значению показателя степени неравномерности :
Θ =(ПА)прод / Кравн.
Произведение активностей продуктов процесса растворения гипса в данном случае следует принять равным произведению активностей соответствующих ионов в природной воде, поскольку для этой воды и необходимо определить степень неравновестности. Произведение активности составит:
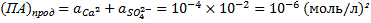
Значение константы равновесия реакции растворения гипса можно определить из термодинамических данных по уравнению:
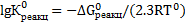
Значение Δ 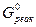 определим из выражения:
определим из выражения:
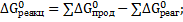
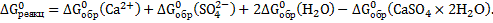
Подставив значения энергии Гиббса образования ионов и соединений в стандартных условиях в данное уравнение, получим:
Δ 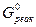 =(-552,70)+(-743,99)+2(-237,23)-(-1799,8)=28,65(кДж/моль) =28,65∙103(Дж/моль)
=(-552,70)+(-743,99)+2(-237,23)-(-1799,8)=28,65(кДж/моль) =28,65∙103(Дж/моль)
Логарифм константы равновесия равен:
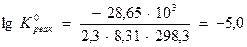
Константа равновесия процесса растворения гипса равна: 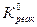 =9,4∙10-6. Значение показателя неравновестности составит: Θ =
=9,4∙10-6. Значение показателя неравновестности составит: Θ = 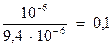
Поскольку Θ<1,раствор ненасыщен относительно гипса, и идет процесс его растворения.
Ответ: будет происходить растворение гипса.
Пример 9.Какой из минералов, не содержащихся примесей, -гипс (СаSO4∙ 2H2O) или ангидрид (СаSO4) более устойчив в водном растворе:
а) при стандартных условиях;
б) при нормальном атмосферном давлении и температуре 900С.
Решение. Относительную устойчивость минералов можно определить по величине показателя неустойчивости:
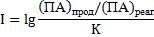
Чем большее значение имеет показатель неустойчивости, тем менее устойчиво данное соединение в растворе.
Представим процесс растворения данных минералов в виде уравнений реакций:
CaSO4 ∙ 2H2O ↔ Ca2+ + SO 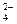 + 2H2O,
+ 2H2O,
СаSO4 ↔ Ca2+ + SO 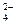
Следует обратить внимание на то, что в обоих случаях в процессе растворения образуются одни и те же ионы. Поэтому для одной и той же воды, относительно которой будет рассматриваться устойчивость минералов, величина (ПА)прод в обоих случаях будет постоянной.
Поскольку по условию задачи минералы не содержат примесей, (ПА)реаг в обоих случаях равны единице: (ПА)реаг=1.
Таким образом, показатель неустойчивости будет тем больше, чем больше константа равновесия реакции, и для ответа на вопрос задачи необходимо сравнить значения констант равновесия процессов растворения гипса и ангидрида.
Поскольку константы равновесия процессов растворения зависят от температуры и давления, рассмотрим устойчивость минералов в различных случаях:
а) процесс растворения протекает при стандартных условиях. В этом случае константы равновесия могут быть определены из уравнения:
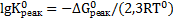
Для процесса растворения гипса значение константы равновесия при стандартных условиях составляет: 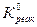 =9,4∙10-6.
=9,4∙10-6.
Для процесса растворения ангидрита имеем:
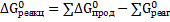 ;
;
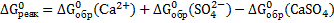 .
.
Подставив значения энергии Гиббса образования ионов и соединений в стандартных условиях в данное уравнение, получим:
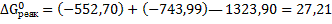 (кДж/моль)
(кДж/моль) 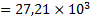 (Дж/моль)
(Дж/моль) 
Логарифм константы равновесия процесса растворения ангидрита равен:
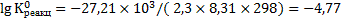
Константа равновесия процесса растворения ангидрита равна:
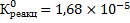
Поскольку константа равновесия процесса растворения гипса меньше, чем ангидрита, гипс более устойчив в водном растворе при стандартных условиях;
б) процесс растворения протекает при нормальном давлении и температуре 900С. Для определения констант равновесия процессов растворения гипса и ангидрита воспользуемся уравнением,связывающим константы равновесия, определенные при различных температурах процесса:
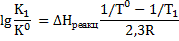
Значение энтальпии реакции можно определить по уравнению:
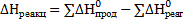
Для процесса растворения гипса имеем:
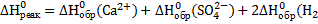 O)
O) 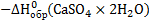 .
.
Подставив значения энтальпии образования ионов и соединений в стандартных условиях (см.табл.6 Приложения) в данное уравнение, получим:
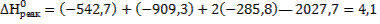 (кДж/моль)
(кДж/моль) 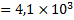 (Дж/моль)
(Дж/моль)
Логарифм отношения констант равновесия процессов растворения гипса при температуре 363К (90 0С) и температуре при стандартных условиях (298 К) составит:
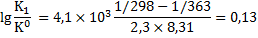
Отношение констант равновесия процессов растворения гипса при температурах 363 К и 298 К будет:
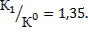
Константа равновесия процесса растворения гипса при температуре 363,3 К составит:
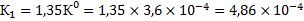 .
.
Проведем аналогичные расчеты для растворения ангидрита:
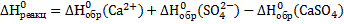
Подставив значения энтальпии образования ионов и соединений в стандартных условиях
( см. табл.6 Приложения) в данное уравнение, получим:
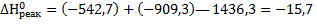 (кДж/моль)
(кДж/моль) 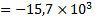 (Дж/моль)
(Дж/моль) 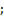
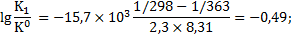
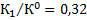 ;
;
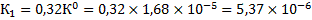 .
.
Таким образом, при 900С константа равновесия процесса растворения ангидрита меньше, чем константа равновесия гипса при данной температуре:
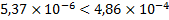 ,
,
Поэтому в этих условиях ангидрит более устойчив, чем гипс.
Ответ: при стандартных условиях гипс более устойчив, чем ангидрит, а при температуре 900С и нормальном атмосферном давлении ангидрит становится более устойчивым.
Пример 10. Сколько миллиграммов ионов фтора может содержаться при нормальных условиях в природной воде, не содержащей примесей и находящейся в равновесии с флюоритом (CaF2), если:
а) в исходной воде отсутствовали растворенные примеси;
б) в исходной воде содержались ионы натрия и хлора в концентрации 0,05 М?
Сравните полученные значения с предельно допустимой концентрацией ионов фтора в водоемах рыбохозяйственного назначения ( 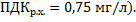
Решение. Процесс растворения фторида кальция (флюорита) в воде можно представить следующим уравнение реакции: 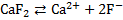 .
.
Произведение растворимости для данного процесса можно представить уравнением: ПР(СаF2) =[Ca2+][F-]2.
Поскольку, как следует из уравнения реакции, при растворении одного моля фторида кальция образуется один моль катионов кальция и два моля ионов фторида, а другие источники данных ионов отсутствуют, можно записать:
[Ca2+]=[F-]/2
В этом случае произведение растворимости для данного процесса можно представить в виде:
ПР(СаF2)= [F-]3/2.
Отсюда легко получить выражение для определения концентрации ионов фтора в равновесном растворе:
[F-](моль/л) =[2ПР(СаF2)]1/3.
Произведение растворимости может быть рассчитано из определяемой по термодинамическим данным константы равновесия:
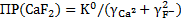
Поэтому выражение для определения растворимости фтора можно представить в виде:
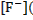 моль/л
моль/л 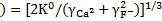
Таким образом, для ответа на вопрос задачи необходимо:
-определить константу равновесия процесса растворения в стандартных условиях, значение которой не зависит от содержания других ионов в растворе;
-рассчитать значение коэффициентов активности ионов кальция и фтора, которые зависят от ионной силы раствора и могут различаться для случаев «а» и «б», определяемых условием задачи.
Значения константы равновесия реакции растворения флюорита определим из термодинамических уравнений
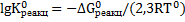
Значение 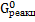 определим из выражения:
определим из выражения:
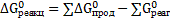 ;
;
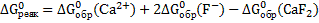 .
.
Подставив значения энергии Гиббса образования ионов и соединений в стандартных условиях в данное уравнение, получим:
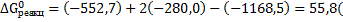 кДж/моль
кДж/моль 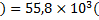 Дж/моль
Дж/моль 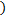 ;
;
Логарифм константы равновесия равен:
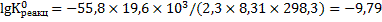
Константа равновесия процесса растворения флюорита равна:
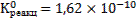 .
.
Для расчета коэффициента активности ионов в растворе воспользуемся уравнением Дебая-Хюккеля:
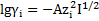 , если I<0,01;
, если I<0,01;
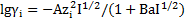 , если 0,01<I<0,1
, если 0,01<I<0,1
Определим значение коэффициента активности ионов кальция и фтора для случая «а», когда в растворе присутствуют только ионы кальция и фтора, образовавшиеся при растворении флюорита.
Поскольку неизвестно ионная сила раствора I, проведем определение коэффициентов активности, используя метод последовательных приближений. На первом шаге итерации примем значения коэффициентов активности ионов кальция и фтора равными единице:
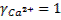 и
и 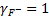 .
.
В этом случае концентрация ионов фтора в растворе составит:
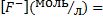 (2
(2 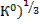 ;
;
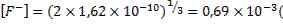 моль/л
моль/л 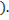
Концентрация ионов кальция будет равна:
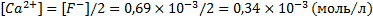
При таких концентрациях ионов кальция и фтора и отсутствий других ионов ионная сила раствора составит:
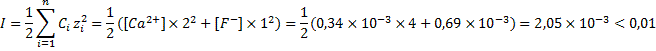
При такой ионной силе раствора коэффициенты активности ионов кальция и фтора составят:
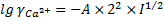 ;
;
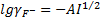 .
.
При стандартных условиях значение коэффициента А уравнение Дебая-Хюккеля равно 0,5058 ), и коэффициенты активности будут:
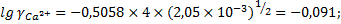
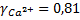 ;
;
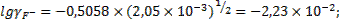
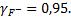
При таких значениях коэффициентов активности ионов фтора и кальция концентрации ионов фтора и кальция в растворе составят:
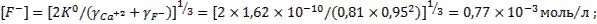
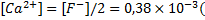 моль/л
моль/л 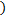
Полученные значения концентрации соответствующих ионов существенно отличаются от значений, полученных на предыдущем шаге, поэтому продолжим расчет.
Ионная сила раствора при концентрации ионов фтора и кальция, равной, соответственно, 0,77∙10-3 и 0,38∙10-3 моль/л, и отсутствии других ионов в растворе составит:
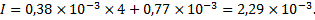
Определим коэффициенты активности ионов фтора и кальция при такой ионной силе раствора:
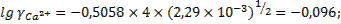
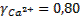 ;
;
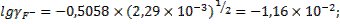
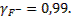
При этих значениях коэффициентов активности ионов фтора и кальция их концентрации в растворе фторида кальция составят:
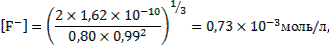
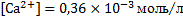 .
.
Полученные значения концентраций ионов отличаются от значений, полученных на предыдущем шаге расчетов (когда коэффициенты активности ионов были приняты равными единице), меньше чем на 10%. В нашем случае такую разницу можно считать удовлетворительной и не проводить дальнейших шагов, приближающих к истинным значениям равновесных концентраций ионов фтора и кальция в растворе.
Таким образом, можно принять, что концентрация ионов фтора при стандартных условиях и отсутствии других ионов, при равновесии с флюоритом составит: [ 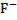 ]
] 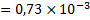 моль/л.
моль/л.
Поскольку молярная масса фтора равна 19 г/моль, концентрация ионов фтора в растворе составит:
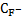 (мг/л)
(мг/л) 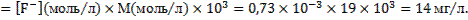
Это значение более чем в 18 раз превышает значения 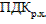 для ионов фтора:
для ионов фтора:
n=14/0,75=19
Рассмотрим случай «б», когда в исходной воде присутствует хлорид натрия. В этом случае помимо ионов кальция и фтора, образующихся при растворении флюорита, в растворе присутствуют ионы натрия и хлора, образующиеся при растворении хлорида натрия:
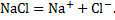
Для расчета коэффициентов активности ионов кальция и фтора методом итераций примем на первом шаге концентрации ионов фтора и кальция равными значениями, рассчитанным для случая «а», когда другие ионы в растворе отсутствовали:
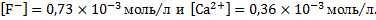
Поскольку хлорид натрия относиться к сильным электролитам, он практически полностью диссоциирует в водном растворе. Поэтому концентрации ионов хлора и натрия в растворе по условию задачи, составят:
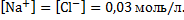
Ионная сила в таком растворе будет равна:
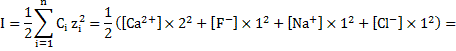
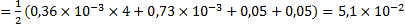 .
.
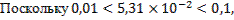 для определения коэффициентов активности ионов фтора и кальция воспользуемся уравнением:
для определения коэффициентов активности ионов фтора и кальция воспользуемся уравнением:
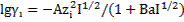 .
.
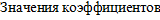 уравнения Дебая-Хюккеля, определяемые условиями проведения процесса и природой ионов (см.табл.8 Приложения), составляют: А=0,5058; В=0,3281
уравнения Дебая-Хюккеля, определяемые условиями проведения процесса и природой ионов (см.табл.8 Приложения), составляют: А=0,5058; В=0,3281 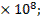
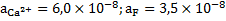 .
.
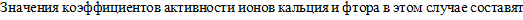 :
:
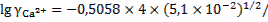
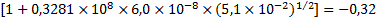 ;
;
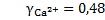 ;
;
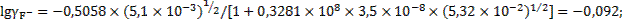
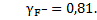
При таких значениях коэффициентов активности ионов фторида и кальция концентрации этих ионов в растворе составят:
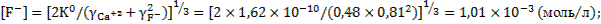
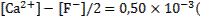 моль/л
моль/л 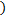
Для раствора с такими концентрациями ионов кальция и фтора, содержащего также 0,05 моль/л ионов натрия и хлора, ионная сила составит:
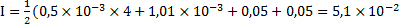 .
.
При такой ионной силе раствора коэффициенты активности ионов кальция и фтора будут равны:
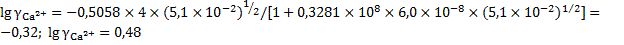
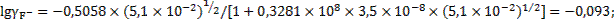
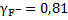 .
.
Поскольку коэффициенты активности ионов кальция и фтора практически не изменились, неизменными по сравнению с первым шагом итерации останутся и концентрации ионов фтора и кальция в растворе. Поэтому дальнейшие приближения при принятой точности оценки не имеют смысла.
Таки образом, в растворе, содержащем хлорид ионы и ионы натрия в концентрации 0.05 моль/л, равновесное значение концентрации фтор-ионов составит:
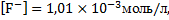
что соответствует концентрации:
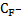 (мг/л)
(мг/л) 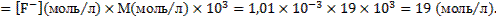
Это значение более чем в 25 раз превышает 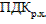 для ионов фтора:
для ионов фтора:
n=19/0,75=25.
Ответ: концентрация ионов фтора в природной воде, находящейся в равновесии с флюоритом (Ca 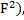 не содержащим примесей, при нормальных условиях, когда в исходной воде отсутствуют растворенные примеси, составляет 14 мг/л, что в 19 раз превышает значения
не содержащим примесей, при нормальных условиях, когда в исходной воде отсутствуют растворенные примеси, составляет 14 мг/л, что в 19 раз превышает значения 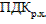
В случае, когда в исходной воде содержаться ионы натрия и хлора в концентрации 0,05 М, содержание ионов фтора составляет 19 мг/л, что в 25 раз превышает значения 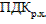
Пример 11. Какое количество мг/л органических соединений условной формулы {СН2О} могло образоваться в водоеме в процессе фотосинтеза, если был нарушен контакт с воздухом и карбонатными породами, растворения или выделения диоксида углерода и карбоната кальция не происходило? В исходном растворе рН 6 щелочность воды составляла Щ=1,1 ммоль/л. В процессе фотосинтеза рН увеличился до значения рН 10. Процесс протекал при нормальном давлении и температуре 298 К.
Решение. Процесс фотосинтеза, протекающего в водоеме при отсутствии растворения диоксида углерода, может быть представлен упрощенным брутто-уравнением:
НСО3- + Н2О " {СН2О} + О2 + ОН-
Анализ этого уравнения показывает, что в процессе фотосинтеза при отсутствии растворения и осаждения происходит изменение в соотношении компонентов карбонатной системы, но щелочность раствора не меняется, поскольку на каждый прореагировавший ион гидрокарбоната образуется один ион гидроксила.
В начальный момент (при рН 6) все атомы углерода входят в состав неорганических соединений – компонентов карбонатной системы. В растворе, образовавшемся после протекания процесса фотосинтеза, атомы углерода уже входят в состав не только компонентов карбонатной системы, но и в состав органических соединений. Следует обратить внимание и на тот факт, что общее содержание атомов углерода в системе остается неизменным, поэтому можно написать равенство:
∑[C1(карб.сист)] = ∑[C2(карб.сист)] + ∑[С(орг)],
где ∑[C1(карб.сист)] и ∑[C2(карб.сист)] – суммарная концентрация атомов углерода в составе всех компонентов карбонатных систем (моль/л), образующихся в растворе при рН 6 и рН 10 соответственно; ∑[С(орг)] – концентрация атомов углерода (моль/л), связанных в процессе фотосинтеза в органические соединения.
Отсюда количество атомов углерода, входящих в состав органических соединений, составит:
∑[С(орг)] = ∑[C1(карб.сист)] - ∑[C2(карб.сист)]
Зная общее количество атомов углерода, связанных в каждом литре воды в органическое соединение, и зная молекулярную формулу синтезируемого органического соединения, легко найти его массу:
m(орг.соед) = ∑[С(орг)] · М · 103,
где m(орг.соед) – количество органического соединения, синтезируемого в каждом литре воды, мг/л; ∑[С(орг)] – концентрация атомов углерода связанных в процессе фотосинтеза в органическое соединение, моль/л; М – молярная масса органического соединения, г/моль; 103 – коэффициент перевода массы из г в мг.
Таким образом, для решения задачи необходимо найти суммарную концентрацию компонентов карбонатной системы при рН 6 и рН 10.
При рН 6 в карбонатной системе присутствуют лишь ионы НСО3- и молекулы растворенного диоксида углерода, а их концентрации при щелочности раствора, равной
1 ммоль/л, составляют:
[НСО3-] = 1,1 · 10-3 моль/л,
[СО2(р-р)] = 2,4 · 10-3 моль/л.
При рН 10 карбонатная система представлена лишь гидрокарбонат- и карбонат-ионами, а их концентрации при щелочности раствора, равной 1,1 ммоль/л, равны:
[НСО3-] = 1,90 · 10-4 моль/л
[СО32-] = 4,05 · 10-4 моль/л
Поскольку в каждом из компонентов карбонатной системы содержится лишь один атом углерода, суммарная концентрация атомов углерода, связанных с компонентами карбонатной системы, будет равна сумме концентраций компонентов, выраженных в моль/л:
∑[C(карб.сист)] = [СО2(р-р)] + [НСО3-] + [СО32-].
Поэтому для исходного раствора, имеющего щелочность 1,1 ммоль/л, суммарные концентрации атомов углерода в составе всех компонентов карбонатных систем, образующихся в растворе при рН 6 и рН 10, составят:
∑[C1(карб.сист)] = [НСО3-] + [СО2(р-р)] = 1,1 · 10-3 + 2,4 · 10-3 = 3,5 · 10-3 (моль/л),
∑[C2(карб.сист)] = [НСО3-] + [СО32-] = 1,90 · 10-4 + 4,05 · 10-4 = 5,95 · 10-4 (моль/л).
Отсюда концентрация атомов углерода, связанных в органические соединения, составит:
∑[С(орг)] =∑[C1(карб.сист)]-∑[C2(карб.сист)] = 3,5 · 10-3 -5,95 · 10-4 =2,90· 10-3 (моль/л).
Поскольку по условию задачи в воде синтезировались лишь органические соединения общей формулой СН2О, молярная масса которых составляет
М= 12 + 1·2+ 16 = 30 (г/моль), количество органических соединений, синтезированных в каждом литре воды, составит:
m(орг.соед) = ∑[С(орг)] · М · 103/n = 2,9 · 10-3 · 30 · 103/1 = 87 ( мг/л).
Ответ: в водоеме могло образоваться 87 мг/л органических соединений общей формулы СН2О.
Пример 12. Какое значение рН будут иметь поверхностные воды, находящиеся в равновесии с атмосферным воздухом, в котором среди «активных» примесей присутствует лишь диоксид углерода, и карбонатными породами, состоящими из кальцита (CaCO3)? Концентрация диоксида углерода в воздухе составляет 0,035%(об.), температура равна 298 К; общее давление воздуха – 101,3 кПа, парциальное давление паров воды – 3100 Па. При оценке принять, что коэффициенты активности всех компонентов равны единице.
Решение. Поскольку в данном случае поверхностные воды можно представить как раствор карбоната кальция, находящийся в контакте с воздухом, содержащим диоксид углерода, равновесие описывается следующим равенством:
CaCO3 + СО2 (р-р) D Са2+ + 2НСО32
Как отмечалось выше, для этого равновесного состояния зависимость концентрации ионов водорода в растворе от парциального давления диоксида углерода в воздухе может быть уравнением, которое при условии равенства коэффициентов активности всех компонентов раствора единице может быть записано в виде:
[Н+] = (( Р2СО2К21К2Г(СО2)К2 )/ 2КCaCO3 )) 1/3,
где [Н+] – концентрация ионов водорода, моль/л; РСО2 – парциальное давление диоксида углерода в воздухе, Па; К1 и К2 – константы диссоциации угольной кислоты по первой и второй ступеням соответственно, КГ(СО2) - константа равновесия процесса растворения кальцита при отсутствии контакта раствора с диоксидом углерода.
Парциальное давление диоксида углерода легко найти по общему давлению в системе и концентрации диоксида углерода в воздухе:
РСО2 =(Робщ – Рн2о)·ССО2[%(об.)]/100 = (101,3 – 3,16)· 0,035/100 = 3,43·10-2 (атм).
Значения констант диссоциации угольной кислоты по первой и второй ступеням и константы Генри приводятся в справочной литературе; для условий задачи эти константы составляют:
К1 = 4,45 · 10-7 моль/л;
К2 = 4,69 · 10-11 моль/л;
КГ(СО2) = 3,3 · 10-2 моль/(л·атм).
Процесс растворения кальцита при отсутствии контакта раствора с диоксидом углерода можно представить следующим уравнением:
CaCO3 D Са2+ + CO32-
Константа равновесия этого процесса может быть представлена уровнением:
КCaCO3 = аСа2+ аСО32-
Численное значение этой константы можно определить из значения энергии Гиббса процесса растворения кальцита уравнение:
lg Кºреакц = - rGºреакц /(2,3RT0)
Значение rGºреакц можно определить из выражения:
rGºреакц = rGºпрод - rGºреаг ;
rGºреакц = rGºобр (Са2+) + rGºобр (СО32-) - rGºобр (СаСО3)
Численные значения энергии Гиббса для этих ионов и кальцита при стандартных условиях в Приложении. Подставив необходимые значения в выражение для энергии Гиббса процесса растворения кальцита, получим:
rGºреакц = (-552,7) + (-527,6) – (-1128,4) = 48 ( кДж/моль) = 48,1 · 103 (Дж/моль).
Значение логарифма константы равновесия составит:
Кºреакц = КСаСО3 = 3,9 · 10-9
Подставив найденные в справочной литературе и рассчитанные для условий задачи значения соответствующих констант и парциального давления диоксида углерода в уравнение зависимости концентрации ионов водорода в растворе от парциального давления СО2, получим:
[Н+] = [(3,39 · 10-4)2(4,45 · 10-7)2(3,3 · 10-2)2 · 4,69 · 10-11 / 2 · 3,9 · 10-9] 1/3 = 5,3 · 10-9 (моль/л).
Такая концентрация ионов водорода соответствует рН, равному:
рН = - lg[Н+] = 8,3.
Ответ: поверхностные воды будут иметь рН 8,3.
Пример 13. Какие жесткость и щелочность будут иметь поверхностные воды, находящиеся в равновесии с атмосферным воздухом, в котором среди «активных» примесей присутствует лишь диоксид углерода, и карбонатными породами, состоящими из кальцита (CaCO3)? Концентрация диоксида углерода в воздухе составляет 0,035%(об.), температура равна 298 К; общее давление воздуха – 101,3 кПа, парциальное давление паров воды – 3100 Па. При оценке принять, что коэффициенты активности всех компонентов равны единице.
Решение. Процесс растворения карбоната кальция в присутствии диоксида углерода протекает в основном по уравнению:
CaCO3 + СО2 (р-р) D Са2+ + 2НСО32-
Как было показано в Примере 12, рН образующегося раствора равен 8,3. При этих значениях рН основной вклад в щелочность вносят ионы НСО3-. Поэтому щелочность раствора будет равна концентрации гидрокарбонат-ионов. Основным источником этих ионов является процесс растворения карбоната кальция в присутствии диоксида углерода, при этом на один ион кальция образуется два НСО3- -иона (см. уравнение раекции). Поэтому можно принять, что щелочность в данном случае будет равна:
Щ = [НСО3-] = 2[Са2+]
Значение жесткости поверхностных вод в рассматриваемом случае будет определяться лишь концентрацией ионов кальция в растворе, поскольку по условию задачи вода находится в контакте только с кальцитом и атмосферным воздухом. В этом случае:
Ж = [Са2+]/(МСа2+ fСа2+) = [Са2+]/20,04,
где [Са2+] – концентрация ионов кальция в растворе, моль/л.
Таким образом, для определения жесткости и щелочности раствора, находящегося в равновесии с карбонатными породами и атмосферным воздухом, необходимо определить равновесное значение концентрации ионов кальция.
Концентрация ионов кальция в растворе карбоната кальция, находящегося в равновесии с воздухом, завит от температуры и парциального давления диоксида углерода в воздухе:
[Са2+](моль/л) = (( РСО2КГ(СО2)КСаСО3) / 4К2 )) 1/3
Поскольку условия, определяющие состояние поверхностной воды в рассматриваемом случае идентичны условиям примера 12, воспользуемся полученными в примере 12 значениями соответствующих величин и определим концентрацию ионов кальция в растворе:
К1 = 4,45 · 10-7 моль/л;
К2 = 4,69 · 10-11 моль/л;
КГ(СО2) = 3,3 · 10-2 моль/(л·атм);
КСаСО3 = 3,9 · 10-9;
РСО2 = 3,39 · 10-4 атм.
[Са2+] = ( 3,39 · 10-4 · 4,45 · 10-7 · 3,3 · 10-2 · 3,9 · 10-9 / 4 · 4,69 · 10-11 ) 1/3 ;
[Са2+] = 4,69 · 10-4 моль/л.
Щелочность поверхностных вод будет составлять:
Щ = 2 · 4,69 · 10-4 = 1 · 10-3 (моль/л) = 1 (ммоль/л).
Жесткость поверхностных вод будет равна:
Ж = 2[Са2+] · 103 = 1(моль/м3)
Ответ: при равновесии с кальцитом и атмосферным воздухом поверхностные воды будут иметь жесткость Ж = 1 моль/м3 и щелочность Щ = 1ммоль/л.
Пример 14. На какую максимальную глубину может опуститься уровень природного известнякового плато за 100 лет за счет растворения карбоната кальция в выпадающей на плато дождевой воде, если дождевая вода полностью стекает с поверхности плато, но лишь после установления равновесия между дождевой водой, карбонатом кальция (кальцитом) и атмосферным воздухом? Уровень осадков, выпадающих ежегодно на плато в течение 100 лет, принять одинаковым и равным 800 мм/год. Температура все время составляла 298 К, давление – 101,3 кПа, концентрация диоксида углерода в атмосферном воздухе – 0,035% (об.). Плотность известняка принять равной 2,7 г/см3. В качестве «активной» примеси в воздухе присутствует только диоксид углерода.
Решение. Уменьшение уровня поверхности известнякового плато произойдет вследствие растворения карбоната кальция в дождевой воде. Этот процесс можно представить уравнением реакции:
CaCO3 + СО2 (р-р) ↔ Са2+ + 2НСО32-
Концентрация ионов кальция в воде при равновесии с карбонатом кальция (известняковое плато) и диоксидом углерода, содержащимся в атмосферном воздухе, как отмечалось выше, определяется температурой и парциальным давлением диоксида углерода в воздухе. Поскольку условия растворения аналогичны рассмотренным в примере 13, концентрация ионов кальция в воде будет такой же, какая была получена в этом примере:
[Са2+] = 4,69 · 10-4 моль/л = 0,469 моль/м3.
Объем дождевой воды, который выпадет на каждый квадратный метр поверхности плато за 100 лет, можно определить по уравнению:
V = 100Н,
где V – объем дождевой воды, выпадающей на каждый квадратный метр плато за 100 лет, м3/м2;
Н – ежегодный уровень атмосферных осадков, м3(м2·год), или м/год.
Поскольку по условию задачи Н = 800 мм = 0,8 м, объем воды, выпадающей на каждый квадратный метр плато за 100 лет, составит:
V = 100 · 0,8 = 80 (м3/м2).
Общее количество молей карбоната кальция, переходящих в раствор с поверхности плато, равно количеству молей ионов кальция в дождевой воде после установления равновесия. Поэтому общее количество молей карбоната кальция (МСаСО3), растворившихся за 100 лет на каждом квадратном метре плато, составил:
МСаСО3 = V[Са2+] · 103 = 80 · 0,469 = 37,52 (моль/м2 за 100 лет).
Масса карбоната кальция (mСаСО3), растворившегося за 100 лет на каждом квадратном метре плато, составит (в г):
mСаСО3 = МСаСО3 · МСаСО3
где МСаСО3 - молярная масса кальцита, МСаСО3 = 40 +12 + 16 ·3 = 100 г/моль;
mСаСО3 = 37,52 · 100 = 3752 ( г/м2 за 100 лет)
Объем карбоната кальция, растворившегося за 100 лет на каждом квадратном метре плато, можно найти, зная плотность кальцита. По условию задачи плотность кальцита равна 2,7 г/см3, или 2,7 · 106 г/м3. Поэтому объем растворившегося кальцита будет равен.
V СаСО3 = 3752/(2,7 · 106) = 1,39 · 10-3 (м3/м2 за 100 лет).
Уровень, на который опустится каждый квадратный метр плато за 100 лет, составит
h = V СаСО3/S = 1,39 · 10-3 / 1 = 1,39 · 10-3 (м).
Ответ: уровень известнякового плато может опуститься в результате процесса растворения карбоната кальция за 100 лет на 1,4 · 10-3 м.
Пример 15. Постройте диаграмму pe− - pH для системы Fe – O – H2O, принимая во внимание лишь следующие превращения: Fe2O3 – Fe3O4; Fe3+ - Fe2O3; Fe3+ - Fe2+; Fe2O3 – Fe2+; опишите области устойчивого существования соединений железа при различных значениях pH.
Решение. Все области устойчивого существования соединений железа в рассматриваемой системе должны находиться между границами, определяющими устойчивое состояние воды. Уравнения, характеризующие верхнюю и нижнюю границы устойчивости воды, были рассмотрены ранее; начнем с границы Fe2O3 – Fe3O4. Уравнение, описывающее это превращение, можно представить в следующем виде:
3 Fe2O3 + 2 e− + 2H+ 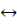 2 Fe3O4 + H2O.
2 Fe3O4 + H2O.
В случае, если оксиды железа (ΙΙ) и железа (ΙΙΙ) не содержат примесей, их активность может быть принята равной единице. В этом случае константа равновесия может быть выражена уравнением:
K = 1/ [(ae-)2 (aH+)2].
Прологарифмируем это уравнение и выразим значение pe− :
lg K = 2 pe− + 2 pH;
pe− = 1/ 2lg K – pH.
На диаграмме эта граница является прямой с тангенсом угла наклона к оси абcцисс, равным -1. Точка пересечения с осью ординат задается величиной константы равновесия, которую можно определить, предварительно рассчитав ΔG° реакции, описывающей данную границу:
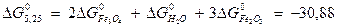 (кДж/моль);
(кДж/моль);
lg Kравн = - 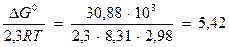
Следовательно, уравнение, определяющее границу, имеет вид:
pe− = 2,71 – pH.
Уравнение, описывающее превращение Fe3+ - Fe2O3, можно представить в виде:
Fe2O3 + 6 H+ 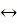 2Fe3+ + 3H2O
2Fe3+ + 3H2O
Константа равновесия этого процесса имеет вид:
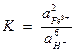 .
.
Логарифм константы равновесия равен:
lg K = 2 lg 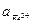 + 6pH.
+ 6pH.
Очевидно, что на диаграмме эта граница является прямой, параллельной оси pe−. Однако прежде чем представить графически границу между растворенной и нерастворенной формами трехвалентного железа, необходимо сделать произвольный выбор величины 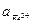 . Обычно для объектов окружающей среды активность растворенной формы железа оценивают значением 10-6 . Тогда для уравнения получим:
. Обычно для объектов окружающей среды активность растворенной формы железа оценивают значением 10-6 . Тогда для уравнения получим:
pH = 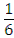 lg Kравн + 2.
lg Kравн + 2.
В ходе рассуждений, аналогичных проделанным ранее, легко вычислить, что lg Kравн = -2,23, откуда
pH = 1,63.
Граница между Fe3+ и Fe2+ задается уравнением
Fe3+ + e− 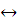 Fe2+.
Fe2+.
Выражения для константы равновесия и pe− имеют вид:
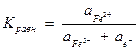
pe− = lg Kравн - lg 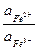 = 13,04 - lg
= 13,04 - lg 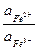
Граница является прямой, параллельной оси pH. Соотношение активностей 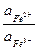 обычно в таких случаях принимается равным 1, но нужно иметь в виду, что выше этой границы могут наблюдаться отличные от нуля концентрации Fe2+, а ниже ее – отличные от нуля концентрации Fe3+.
обычно в таких случаях принимается равным 1, но нужно иметь в виду, что выше этой границы могут наблюдаться отличные от нуля концентрации Fe2+, а ниже ее – отличные от нуля концентрации Fe3+.
Граница Fe2O3 – Fe2+ определяется реакцией Fe2O3 + 2e− +6H+ 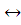 2Fe2+ + 3H2O.
2Fe2+ + 3H2O.
Выражения для константы равновесия и pe− в этом случае имеют вид:
Kравн = 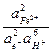 ;
;
pe− = ½ lg Kравн - lg 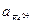 - 3 pH.
- 3 pH.
Вновь встает вопрос о выборе значения 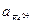 . Если принять, что
. Если принять, что 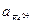 =
= 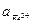 , то не нужно вычислять значение K, поскольку граница Fe2O3 – Fe3+ является прямой линией с тангенсом угла наклона, равным -3, проходящей через точку пересечения границ Fe2O3 – Fe3+ и Fe3+ - Fe2+. Однако при построении диаграмм рекомендуется все же вычислить Kравн и проверить, пройдет ли новая граница через точку пересечения двух других. Если три границы не встретятся в одной точке, это будет свидетельствовать об арифметической ошибке. Неточности в величинах энергии Гиббса привели бы к ошибочному положению точки пересечения, но точка в любом случае должна быть одна.
, то не нужно вычислять значение K, поскольку граница Fe2O3 – Fe3+ является прямой линией с тангенсом угла наклона, равным -3, проходящей через точку пересечения границ Fe2O3 – Fe3+ и Fe3+ - Fe2+. Однако при построении диаграмм рекомендуется все же вычислить Kравн и проверить, пройдет ли новая граница через точку пересечения двух других. Если три границы не встретятся в одной точке, это будет свидетельствовать об арифметической ошибке. Неточности в величинах энергии Гиббса привели бы к ошибочному положению точки пересечения, но точка в любом случае должна быть одна.
Граница Fe3O4 – Fe2+ описывается уравнением
Fе3O4 + 2 e− + 8 H+  3 Fe2+ + 4 H2O.
3 Fe2+ + 4 H2O.
Выражение для константы равновесия и pe− для этой реакции имеют вид:
Kравн = 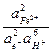 ;
;
pe− = ½ lg Kравн - 3/2 lg 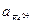 - 4pH.
- 4pH.
Вычисление Kравн не является необходимым, поскольку известен тангенс наклона (-4) и общая точка – пересечение границ Fe2O3 – Fe2+ и Fe3O4 – Fe2+.
На рисунке представлены в виде соответствующих отрезков прямых границы областей существования соединений железа в рассмотренной нами системе. Анализируя полученную диаграмму, можно сделать вывод о том, что Fe3+ является преобладающей формой только в крайне кислых средах, таких, например, которые имеют место в дренажных водах рудников. В щелочной среде железо должно быть нерастворимым при любых значениях pe−; в нейтральной и слабокислой средах железо должно быть нерастворимым в окислительных средах и растворимым (в форме Fe2+) в восстановительных средах.
Пример 16. На сколько единиц снизиться редокс-уровень системы, определяемый верхней границей устойчивости воды. Если парциальное давление кислорода в находящемся в равновесии с водой воздухе снизиться с P= 1 атм до:
а) парциального давления, соответствующего средним значениям в приземном воздухе с относительной влажностью 90%, при температуре 298К и общем давлении, равном 1атм?
б) в миллион раз?
Какое значение будет иметь pe− для случаев а) и б) при pH раствора, равном 7?
Решение. Верхняя граница устойчивости воды связана с возможностью протекания процесса ее окисления. Окислительно-восстановительная реакция, протекающая при этом, может быть представлена уравнением:
 O2 + H+ + e- → H2O.
O2 + H+ + e- → H2O.
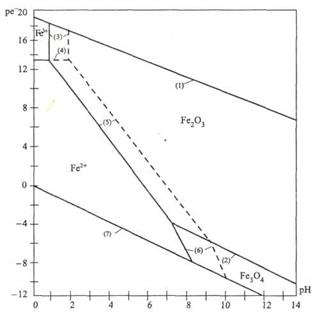
Рис. 1. Диаграмма ре- - рН для системы Fe-O-H2O при 298 К.
На диаграмме pe− - pH для системы Fe-O-H2O при 298К пунктирной линией обозначены границы, соответствующие активности ионов железа в растворе 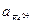 =
= 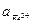 =10-9 моль/л. Цифры в скобках соответствуют номерам следующих химических реакций:
=10-9 моль/л. Цифры в скобках соответствуют номерам следующих химических реакций:
1)  O2 + H+ + e- =
O2 + H+ + e- =  H2O
H2O
2) Fe2O3 + 2 e− + 2H+ = 2 Fe3O4 + H2O
3) Fe2O3 + 6 H+ = 2Fe3+ + 3H2O
4) Fe3+ + e− = Fe2+
5) Fe2O3 + 2 e− + 6 H+ = 2 Fe2+ + 3 H2O
6) Fe3O4 + 2 e− + 8 H+ ↔ 3 Fe2+ + 4 H2O
7) H+ + e- =  H2.
H2.
Зависимость величины редокс-потенциала системы от парциального давления кислорода в равновесном воздухе и от pH раствора описывается уравнением:
pe− = 20,8 +  lg
lg 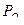 - pH.
- pH.
При парциальном давлении кислорода, равном 1 атм, и pH 7 значение pe− составит:
pe− = 20,8 – 7 =13,8.
При относительной влажности 90% и температуре 298К парциальное давление кислорода в приземном воздухе можно определить по уравнению:
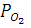 = (Pобщ –
= (Pобщ – 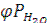 )
) 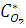
где 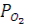 - парциальное давление кислорода; Pобщ и
- парциальное давление кислорода; Pобщ и 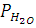 - общее давление и равновесное давление паров воды при заданной температуре;
- общее давление и равновесное давление паров воды при заданной температуре; 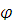 - относительная влажность воздуха;
- относительная влажность воздуха; 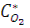 - объемная доля кислорода в приземном слое воздуха (0,2095).
- объемная доля кислорода в приземном слое воздуха (0,2095).
При условиях а) рассматриваемого Примера 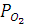 составит:
составит:
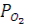 = (1 – 0,9 ∙0,031)∙ 0,2095 = 0,20 (атм).
= (1 – 0,9 ∙0,031)∙ 0,2095 = 0,20 (атм).
Значение pe− будет равно:
pe− = 20,8 -  lg(0,20)- 7 = 13,6.
lg(0,20)- 7 = 13,6.
Для случая а) изменение pe− составит: Δ pe- = 13,8 – 13,6 = 0,2
В случае б) значение pe− будет: pe− = 20,8 –  lg 106 - 7 = 12,3.
lg 106 - 7 = 12,3.
Для случая б) изменение pe− составит:
Δ pe- = 13,8 – 12,3 = 1,5.
Ответ: в случае а) редокс-уровень системы измениться на 0,2 единицы pe− и будет равен pe− =13,6; в случае б) Δpe- = 1,5 и pe− = 12,3.
Пример 17. Какое парциальное давление кислорода должно соответствовать редокс-уровню системы, в которой протекает анаэробный процесс восстановления диоксида углерода до метана (ре- = - 4.2), при наступлении равновесия, если рН раствора равен 7?
Решение. При установлении равновесия в системе редокс-потенциалы всех окислительно-восстановительных реакций должны быть равны друг другу. Поэтому окислительно-восстановительный потенциал реакции, определяющей верхнюю границу устойчивости воды, будет равен окислительно-восстановительному потенциалу реакции восстановления диоксида углерода:
ре- = 20.8+1/4 lg PO2 – pH = - 4.2.
Из этого равенства легко найти PO2; при рН =7 получим:
lg PO2 = - 4.2 - 20.8+ pH = - 4.2 — 20.8+7= - 18.0
lg PO2 = -72
PO2 = 10-72 атм.
Ответ: парциальное давление кислорода в воздухе PO2 = 10-72 атм.
Пример 18 Какое максимальное количество мг органических веществ, общей формулой {СН2О} может быть окислено за счет растворенного кислорода (при высоких значениях ре- ) в каждом литре природной воды, находящейся в равновесии с приземным воздухом (температура 298 К, общее давление 101,3 кПа, парциальное давление паров воды 3,1* 103 Па ) если контакт с воздухом был прерван и поступление дополнительного кислорода в процессе окисления отсутствовало?
Решение. Процесс окисления органического вещества общей формулой {СН2О} можно представить следующим уравнением реакции:
{СН2О} + О2 → СО2 + Н2О.
В связи с отсутствием по условию Примера, дополнительного поступления кислорода максимальное количество органического вещества, которое может быть окислено в воде, будет определяться содержанием кислорода в воде, которое, в свою очередь, будет соответствовать условиям равновесия с воздухом, устанавливающимся до начала процесса окисления. При равновесии с приземным воздухом это количество кислорода составит:
[СО2] = Кг(о2) РО2 .
Парциальное давление кислорода для условии данного примера:
РО2 = (101.3 — 3.1)* 103 * 0.2095 = 20.6 * 103 (Па).
Концентрация растворенного кислорода в воде составит:
[СО2]= Кг(о2) РО2 = 0.00130 *20.5 * 103 / (101.3 * 103)= 2.63 * 10-4 (моль/л),
или
[СО2]=2.63 * 10-4 *Мо2 = 2.63 * 10-4 *32 = 8,4 * 10-3 (г/л)= 8,4 (мг/л).
Количество органических соединений общей формулой {СН2О} (молярная масса которых равна 30 г/моль) можно определить по реакции окисления:
mорг = 30 * 8.4 / 32 = 7.9(мг/л).
Ответ: в каждом литре воды может быть окислено не более 7,9 мг органических соединений общей формулой {СН2О}.
Пример 19. Какой объем природной воды, находившейся в равновесии с атмосферным воздухом, необходимо взять, чтобы после окисления 10 г сахара (среднее количество в стакане чая) содержание кислорода в этой воде составляло более 4 мг/л (количество, при котором рыбы еще не погибают)? Принять, что содержание кислорода в атмосферном воздухе соответствовало средней для приземного воздуха концентрации, температура была равна 298 К, общее давление — 101,3 кПа, парциальное давление паров воды — 3,1∙ 103 Па. Сахар имеет молекулярную формулу С12Н22О11.
Решение. Поскольку в растворе после окисления сахара, по условию примера, остается растворенный кислород, процесс окисления протекает при высоких значениях окислительно-восстановительного уровня системы и может быть представлен следующим уравнением:
С12Н22О11 + 12О2 → 12СО2 + 11Н2О.
Количество кислорода (г.), которое в этом случае потребуется для окисления сахара, составит:
mO2 = 12MO2 mсахара / Mорг. соед,
где 12 — количество молекул кислорода в природной среде соответствует значениям, наблюдаемым при равновесии между водой и приземным воздухом. Эта величина составляет 8,4 мг/л.
Поскольку, по условию примера, остаточное содержание кислорода в воде не должно быть меньше 4 мг/л, на окисление из каждого литра природной воды не должно расходоваться больше, чем
m'О2 = СО2 — СО2 ост ,
где m'О2 - количество кислорода, которое может быть израсходовано на окисление сахара из каждого литра природной воды; СО2 — концентрация кислорода в воде при равновесии с приземным воздухом; СО2 ост - минимальное содержание кислорода в воде после окисления сахара;
m'О2 = 8.4 - 4 = 4.4 (мг/л).
Определим минимальный объем природной воды, кислород из которой будет расходоваться на окисление сахара:
V = mО2 / m'О2 = 11.23 * 103 / 4.4 = 2500 (л).
Ответ: необходимо взять не менее 2500 л природной воды.
Пример 20. Какой минимальный объем природной воды необходимо для растворения сероводорода, образовавшегося при окислении 10 г сахара в процессе сульфат-редукции, если весь выделившийся сероводород переходит в раствор, в котором концентрация H2S не превышает значений подпороговой концентрации, определяемой по запаху (ППКорг = 0.05 мг/л)? Сахар имеет молекулярную формулу С12Н22О11.
Решение: В процессе сульфат-редукции при окислении органического вещества происходит образование сероводорода по реакции:
2Сорг + SO42- + 2H2O → H2S + 2 HCO3.
На каждые два моля углерода, связанных в органическое соединение, образуется молекула сероводорода.
Количество молей углерода (Nc), содержащихся в m г органических соединений, имеющих молярную массу Морг и содержащих n атомов углерода в каждой молекуле органического соединения, можно определить по уравнению:
Nc – mn / Mорг
Для условий Примера количество молей углерода, содержащихся в 10 г сахара (молекулярная формула С12Н22О11), составит:
Nc =10* 12/ 342 = 0,35(молей).
В процессе сульфат-редукции этого количества молей углерода может образоваться Nн2s молей сероводорода:
Nн2s = 1/2 Nc = 0,175 (молей).
Масса образующегося сероводорода составит: Мн2s = Nн2s Мн2s ; Мн2s = 0.175 * 34 * 103 = 5950 (мг).
Объем природной воды, необходимый для растворения этого количества сероводорода при конечной концентрации ниже ППКорг , составит:
V = Мн2s / ППКорг = 5950 / 0.05 = 120000 (л) = 120 (м3).
Ответ: необходимый минимальный объем природной воды равен 120 м3.
Дата: 2019-02-02, просмотров: 547.