Пример 3. Константа диссоциации циановодорода равна 7,9 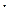 10 –10. Найти степень диссоциации НСN в 0,001 М растворе.
10 –10. Найти степень диссоциации НСN в 0,001 М растворе.
Решение. Поскольку константа диссоциации (Кд) HCN очень мала, то для расчета можно воспользоваться приближенной формулой: 
где 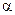 ‑ степень диссоциации;
‑ степень диссоциации;
СМ ‑ молярная концентрация моль/л
Тогда 
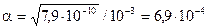

3.4. Вычисление [H+] в растворе одноосновной сильной кислоты.
Пример 4. Вычислить [H+] н рН 0,05 н. раствора соляной кислоты.
Решение. Одноосновные сильные кислоты ( соляная, азотная, хлорная и др.) диссоциируют практически полностью по схеме: НА 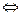 Н+ +А –
Н+ +А –
В их растворах концентрация водородных ионов приблизительно равна концентрации кислоты: [ H+]  CК , где CК ‑ концентрация кислоты моль/л или г-экв/л.
CК , где CК ‑ концентрация кислоты моль/л или г-экв/л.
Тогда [ H+]  0,05 или 5
0,05 или 5  10 –2г-экв/л
10 –2г-экв/л
рН = –  lg[ H+] = lg 5
lg[ H+] = lg 5  10 –2= –( lg5 – 2 lg10) = –lg5 +2 =1,3
10 –2= –( lg5 – 2 lg10) = –lg5 +2 =1,3
3.5. Вычисление [ H+] в растворе одноосновной слабой кислоты.
Пример 5. Вычислить [ H+] и рН 0,2 н. раствора уксусной кислоты.
Решение. Для слабой одноосновной кислоты диссоциирующей по схеме: НА 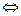 Н+ +А – константа диссоциации равна
Н+ +А – константа диссоциации равна
КК = 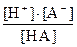
Если обозначить концентрацию диссоциированных молекул кислоты через Х, то [ H+] 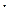 [A–] = Х, а концентрация недиссоциирующих молекул [HA] = СК ‑ Х. Поскольку концентрация диссоциируемых молекул Х в растворе слабой кислоты весьма незначительна по сравнению с ее общей концентрацией, принимают, что СК ‑ Х = СК.
[A–] = Х, а концентрация недиссоциирующих молекул [HA] = СК ‑ Х. Поскольку концентрация диссоциируемых молекул Х в растворе слабой кислоты весьма незначительна по сравнению с ее общей концентрацией, принимают, что СК ‑ Х = СК.
Подставляя эти значения в исходное уравнение, получают КК = 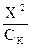 .Отсюда Х =
.Отсюда Х = 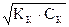 или [ H+] =
или [ H+] = 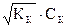
Из таблицы 1 видно, что К 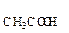 = 1,8
= 1,8  10–5 . Тогда
10–5 . Тогда  [ H+] =
[ H+] = 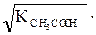
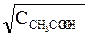 =
= 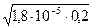 = =
= = 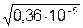 = 1,9
= 1,9  10 –3 г-ион/л
10 –3 г-ион/л
Следовательно рН = –lg 1,9  10 –3 = 2,27.
10 –3 = 2,27.
3.6. Вычисление [ H+] в растворе слабой многоосновной кислоты.
Пример 6. Вычислить [ H+] в 0,025 М растворе сероводородной кислоты.
Решение. Из таблицы 1 видно, что для сероводородной кислоты К1 = 5,7 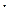 10–3 , а К2 = 1,2
10–3 , а К2 = 1,2 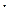 10 –5. Следовательно, почти все ионы водорода получаются в результате диссоциации кислоты по первой ступени : H2S
10 –5. Следовательно, почти все ионы водорода получаются в результате диссоциации кислоты по первой ступени : H2S  Н+ + HS –, а уравнение константы диссоциации имеет вид :
Н+ + HS –, а уравнение константы диссоциации имеет вид :
К 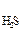 =
= 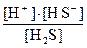


Если обозначить [ H+] = [ HS ] = Х , то получим
К 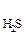 =
= 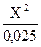
Откуда Х = 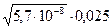 =3,77
=3,77  10 –5 г-ион/л
10 –5 г-ион/л
3.7. Вычисление [ OH –] и р ОН в растворах оснований.
Пример 7. Вычислить [ OH –] и р ОН 0,05 н. раствора едкого натра.
Решение. Эти вычисления аналогичны определению [ H+] и рН в растворах кислот. В растворах сильных оснований
[ OH –] = СО , где СО ‑ концентрация основания
[ OH –] = СNaOH = 0,05 = 5 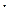 10 –2 г-ион/л
10 –2 г-ион/л
р ОН = 2 – lg5 = 2 –0,7 = 1,3
Можно определить рН: рН = 14 – 1,3 =12,7
Определение рН буферного раствора (слабая кислота и ее соль).
Пример 8. Определить рН раствора, составленного сливанием 20 мл 0,05 М. раствора уксусной кислоты и 30 мл 0,1М. раствора ацетата натрия. Диссоциацию соли считать полной.
Решение. Концентрация ионов водорода в буферном растворе слабой кислоты и ее соли равна:
С (H+) = 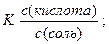 где
где
К ‑ константа диссоциации кислоты.
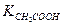 =1,8∙10-5.
=1,8∙10-5.
Определяем концентрацию кислоты и соли в буферном растворе согласно уравнению
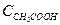 =
=  ;
; 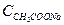 =
=  .
.
Подставляем числовые значения и находим С(Н+):
С (H+)=1,8∙10-5∙  ∙
∙ 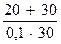 =1,8∙10-5∙
=1,8∙10-5∙ 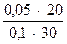 =0,6
=0,6 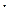 10 –5 = 6
10 –5 = 6 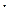 10–6 (моль/л).
10–6 (моль/л).
рН = – lg (6 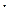 10-6)
10-6)  5,22
5,22
Дата: 2019-02-02, просмотров: 374.