1. а) Как известно, катализатор — это вещество, изменяющее скорость ре-
акции, но не расходуемое в ходе данной реакции.
б) Катализаторы белковой природы называются ферментами (или энзимами). Практически все реакции в живых организмах идут с достаточной скоростью при такой невысокой температуре, как температура тела, только оттого, что ускоряются ферментами.
2. а) По тому, как именно изменяется скорость реакции в присутствии катализатора, иногда различают два типа катализа – положительный (повышение скорости) и отрицательный (снижение скорости).
б) Однако гораздо чаще термин «катализ» употребляют без подобного уточнения, имея в виду лишь положительный вид катализа. А снижение скорости реакции под действием какого-либо вещества называют ингибированием.
3. Кроме того, катализ подразделяют на гомогенный и гетерогенный.
а) В первом случае катализатор находится в той же фазе, что и реагирующее вещество; обычно это жидкая или газовая фаза.
б) При гетерогенном катализе катализатор образует иную (как правило, твердую) фазу; участники же реакции находятся в газовой или жидкой среде.
Тогда реакция проходит на поверхности раздела фаз. Подобный тип катализа используется в промышленности. Мы же далее будем иметь в виду, в основном, гомогенный катализ.
4. Наконец, иногда каталитическим действием обладает какой-либо из продуктов реакции. Такие процессы называются автокаталитическими. Отличие от цепных реакций состоит лишь в природе катализирующего агента: последний не является свободным радикалом.
5. Между тем, свободные радикалы могут образовываться на промежуточных
стадиях каталитического процесса.
а) В качестве примера приведем разложение пероксида водорода:
 |
I . Если в чистом растворе скорость его близка к нулю, то в присутствии ионов Fe2+ процесс резко ускоряется. Начинает функционировать следующий механизм:
 |
Как видно, всего здесь — 5 реакций, суммарное уравнение которых совпадает с уравнением (20.18).
II . Следовательно, ионы Fe2+ выступают в качестве катализаторов. Конкретно, они являются промежуточными донорами электронов, которые необходимы для запуска разложения H2O2.
III . Свободные же радикалы (OH·, HO2· и O2·) образуются лишь на промежуточных стадиях, а не инициируют (как ионы Fe2+) очередной цикл разложения. Поэтому процесс рассматривается как каталитический, а не цепной.
б) Более проста совокупность промежуточных реакций в другом примере.
 |
I . Речь идет о разложении паров ацетальдегида при t ≈ 500°С:
В присутствии паров I2 скорость разложения возрастает примерно в 6000 раз.
II . Механизм катализа включает в данном случае лишь 2 стадии:
 |
III . Здесь катализатор (иод) образует промежуточные соединения с компонентами исходного реагента.
Особенности катализа
Приведенные примеры позволяют сформулировать общие свойства каталитических процессов.
1. Основное из них состоит в том, что в суммарное уравнение реакции катализатор не входит.
2. Отсюда вытекает ряд принципиальных следствий.
а)В ходе реакции катализатор не расходуется (то, что отмечалось нами в самом определении катализатора).
 |
б) Результирующее изменение энергии Гиббса в обоих вариантах реакции (без катализатора и с катализатором) одно и то же:
в) Если реакция — обратимая, то из предыдущего утверждения следует, что не меняется и константа равновесия (поскольку она непосредственно связана с 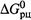 ):
):
 |
Иными словами, катализатор не сдвигает положения равновесия в обратимой реакции.
г) Но Kр = kпр /kобр. Поэтому, если в присутствии катализатора Kр остается неизменной, а kпр возрастает, то точно в такое же число раз возрастает и kобр,
т.е. скорости прямой и обратной реакций увеличиваются в одинаковой степени.
д) Два последних утверждения можно объединить в одно: катализатор только ускоряет (за счет увеличения kпр и kобр) достижение того же (что и в его
отсутствие) положения равновесия.
3. Итак, катализатор не входит в суммарное уравнение реакции. Но, как мы
видели из примеров, он непосредственно участвует в тех или иных промежуточных реакциях.
Следовательно, механизм катализа состоит в том, что исходная реакция
(с низкой константой скорости) заменяется на серию других (с более высокими
константами скорости).
Дата: 2019-02-02, просмотров: 325.