Сделаем еще несколько замечаний по поводу основного уравнения фер-
ментативной кинетики.
1. Параметры уравнения — Vmax и KM.
а) Смысл величины Vmax мы уже отмечали.
 |
Это максимальная скорость, достигаемая при насыщающих концентрациях
субстрата. Согласно (20.34,б) и (20.39,б),
т.е. Vmax зависит от концентрации фермента и максимального числа оборотов отдельных молекул фермента.
б) Смысл KM таков.
I . Положим cS = KM; тогда из уравнения (20.34, а) вытекает:
 |
Следовательно, KM — такая концентрация субстрата, при которой достигается скорость реакции, равная половине максимальной.
II . Несколько упрощая, можно сказать, что K M отражает сродство фермента к
субстрату: чем это сродство выше, тем KM меньше, т.е. тем круче идет кривая
зависимости υ от c S на рис. 20.3.
в) Итак, KM характеризует сродство фермента к субстрату, а Vmax — активность фермента, уже связавшего субстрат.
2. Определение Vmax и KM.
а) Эти параметры обычно определяют экспериментальным путем, для чего измеряют скорость реакции при разных концентрациях субстрата.
б) Но непосредственно по графику υ(c S) трудно заключить, чему равна Vmax: не всегда ясно, к какому пределу стремится кривая. Поэтому преобразовывают уравнение Михаэлиса—Ментен к линейной форме.
в) Наиболее часто используется метод Лануйивера—Берка (или метод обратных величин):
 |

Здесь получается линейная зависимость 1/υ от 1/c S.
г) Итак, по экспериментальным данным строят график для обратных величин (рис. 20.4). И, продолжая его, находят точки пересечения с осями координат. Как видно из рис. 20.4, эти точки отсекают на оси абсцисс величину –1/KM, а на оси ординат – 1/Vmax.
3. Решение уравнения Михаэлиса–Ментен.
 |
а) Если учесть, что
 |
то уравнение Михаэлиса–Ментен — это дифференциальное уравнение относительно c S:
б) Здесь можно разделить переменные и проинтегрировать:
 |
 |
откуда
 Два первых члена правой части — это постоянная интегрирования, опре-
Два первых члена правой части — это постоянная интегрирования, опре-
деляемая из начального условия (при t = 0 c S = 0).
в) Но полученное алгебраическое уравнение является трансцендентным, и в явном виде выразить из него 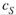 нельзя. Тем не менее, видно, что при росте t c S уменьшается, что примерно отражается графиком на рис. 20.5. Начальная часть графика близка к линейной зависимости {нулевой порядок реакции), а
нельзя. Тем не менее, видно, что при росте t c S уменьшается, что примерно отражается графиком на рис. 20.5. Начальная часть графика близка к линейной зависимости {нулевой порядок реакции), а
конечная — к экспоненциальной {первый порядок).
Краткое содержание главы 20
В главе рассмотрены цепные и каталитические реакции.
1. а) Особенностью ЦЕПНЫХ реакций является то, что среди их продуктов образуются СВОБОДНЫЕ РАДИКАЛЫ, которые вовлекают в процесс новые молекулы реагентов.
В самом процессе различают три стадии – зарождение, продолжение и обрыв цепи. Стадия продолжения состоит из повторяющихся циклов реакций (т.н. звеньев), инициирующих друг друга.
 |
б) Были приведены примеры цепных реакций, в т.ч.:
 |
в) Кинетические уравнения скорости зависят от механизма цепного процесса. В частности, для первой из приведенных реакций уравнение таково:
По мере расходования брома порядок реакции по нему возрастает от 1/2 до 3/2.
2. а) Что касается КАТАЛИТИЧЕСКИХ процессов, то даны краткие представления о ПОЛОЖИТЕЛЬНОМ и отрицательном, ГОМОГЕННОМ и ГЕТЕРОГЕННОМ катализе, АВТОКАТАЛИТИЧЕСКИХ процессах, ФЕРМЕНТАХ – биологических катализаторах белковой природы.
б) Принципиальная особенность катализа состоит в том, что катализатор не входит в суммарное уравнение реакции и увеличивает в равной степени скорость как прямой, так и обратной реакции.
в) Возможные способы действия катализаторов таковы:
- увеличение эффективной концентрации реагентов,
- повышение энергии реагентов (создание напряжения в их молекулах),
- понижение энергетического барьера (путём разбиения исходной реакции на промежуточные стадии с меньшими барьерами).
г) Для ферментативных реакций, протекающих по простейшему механизму:
 |
скорость описывается УРАВНЕНИЕМ МИХАЭЛИСА-МЕНТЕН:
 |
д) При этом КОНСТАНТА МИХАЭЛИСА, КМ , численно равна концентрации субстрата, при которой скорость реакции составляет половину максимальной (0,5 Vmax).
Значения параметров КМ и Vmax можно определить по графику зависимости 1/ v от 1/ cS (метод Лануйивера-Берка).
е) Интегрирование же уравнения Михаэлиса-Ментен приводит к трансцендентному алгебраическому уравнению относительно концентрации субстрата:
cS + KM∙ ln cS = coS + KM∙ ln coS – Vmax .
Глава 21. КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ
Введение
До сих пор речь шла о кинетике лишь гомогенных процессов.
1. Теперь же обратимся к гетерогенным процессам, где реагирующие вещества находятся в разных фазах. Следовательно, в таких процессах реакция происходит на границах раздела фаз.
 2. Конкретным примером являются электродные процессы (главы 14–15) —
2. Конкретным примером являются электродные процессы (главы 14–15) —
электролиз и генерация ЭДС в гальванических элементах.
В частности, возьмем элемент из двух редокс-электродов (рис.14.3).
В левом полуэлементе взаимодействуют растворенное вещество AH2 и платина в составе твердого электрода: эти вещества обмениваются электронами.
Очевидно, сама полуреакция происходит на поверхности электрода.
То же можно сказать о правом полуэлементе.
3. Реакции на границе раздела фаз имеют определенные особенности кинетики. Эти особенности мы обсудим вначале с общих позиций (т.е. применительно к любым гетерогенным процессам), а в следующей главе — в отношении конкретных электрохимических процессов.
а) В гетерогенной реакции различают обычно не менее трех стадий:
I. перенос реагирующих веществ к поверхности раздела фаз,
II. собственно реакцию,
III. отвод продуктов реакции от поверхности.
б) Причём в основе первой и третьей стадий лежат не химические, а физико-химические процессы. Как правило, это диффузия и движение частиц в электрическом поле.
4. В частности, для приведенного выше примера стадии левой полуреакции отражаются схемой:
 |
5. а) Результирующая же скорость гетерогенной реакции определяется, очевидно, самой медленной стадией. Чаще всего такой стадией является именно диффузия.
б) Следовательно, диффузия играет очень важную роль в кинетике гетерогенных процессов. В связи с этим, остановимся на ней подробнее.
Общие сведения о диффузии
1. а)Диффузия — это самопроизвольное перемещение частиц {молекул) из области с более высокой в область с более низкой концентрацией. В основе ее — хаотичное тепловое движение данных частиц.
б) В п. 4.8 мы давали практически такое же определение для осмотических
процессов. И находили, что при переходе п молей вещества от концентрации c1
к меньшей концентрации c2 уменьшение энергии Гиббса системы равно
 |
в) Отсюда следуют два обстоятельства.
I . Во-первых, диффузия — это те же осмотические процессы, но рассматриваемые на уровне частиц и молекул.
II . Во-вторых, в результате диффузии, как и в осмотических процессах, теплота не поглощается и не выделяется, а все изменение ∆G обусловлено изменением только энтропии системы.
г) Причем, видимо, в ходе диффузии энтропия возрастает, т.к. частицы переходят к менее упорядоченному расположению. Таким образом, диффузия — одно из проявлений второго начала термодинамики.
 |
2. а) Важнейшей характеристикой является поток диффузии в каком-либо на-
правлении, jдиф. Это количество вещества (в молях), диффундирующего в единицу времени через единичное поперечное сечение, перпендикулярное данному направлению:
3. Для диффузии характерны следующие три закона.
 |
I . Первый закон Фика (в одномерном варианте):
а) Суть этого закона в том, что поток диффузии в определенном направлении
пропорционален градиенту концентрации вещества в данном направлении.
Иными словами, чем больше разница концентраций между точками пространства, тем сильней диффузия.
б) Знак минус в формуле (21.2, а) обусловлен тем, что диффузия происходит в сторону снижения градиента концентрации (дс/д x < 0), тогда как величина jдиф должна быть положительной.
в) Что касается D , то это — коэффициент диффузии.
 |
II . Второе соотношение — уравнение непрерывности:

а) Чтобы понять его, выделим на направлении диффузии небольшой интервал dx , ограниченный сечениями I и II (рис. 21.2).
Ввиду малости интервала можно полагать, что во
всех его точках концентрация одинакова и равна с.
б) Так вот, уравнение (21.3) констатирует довольно очевидную вещь.
Концентрация вещества в интервале dx изменяется со временем (д c /д t ≠ 0) в том случае, если на границах этого интервала различен диффузионный поток (д jдиф /д x ≠ 0).
 |
в) Действительно, чтобы, например, концентрация убывала со временем, необходимо, чтобы приток вещества в интервал был меньше оттока вещества из интервала:
г) Таким образом, положительный градиент потока диффузии (∂ jдиф/∂х > 0) вызывает снижение концентрации в точках интервала (∂с/∂ t < 0), а отрицательный градиент потока – возрастание концентрации.
 |
III . Наконец, третье соотношение — второй закон Фика. Он следует из первых двух законов, если коэффициент диффузии одинаков во всех точках пространства:
откуда
 |
б) Итак, скорость изменения со временем концентрации вещества в некоторой точ ке пространства пропорциональна второй производной концентрации вещества по направлению диффузии.
4. Завершая краткое изложение сведений о диффузии, отметим также свойст-
ва стационарной диффузии.
а) Диффузия называется стационарной, если концентрация вещества в точках пространства, несмотря на диффузию, не меняется:
 |
б) Исходя из законов диффузии, можно установить ещё три признака стационарной диффузии.
I . Первый признак. Так, из второго закона Фика следует: если д c /д t = 0, то
 |
Иначе говоря, убывание концентрации по направлению диффузии происходит линейно.
II . Второй признак. Из уравнения непрерывности получаем: если д c /д t = 0, то
 |
III . Третий признак. И, наконец, используем первый закон Фика:
 |
Два последних свойства означают: при стационарной диффузии поток диффузии не меняется ни со временем, ни по мере перехода от одной точки пространства к другой.
Дата: 2019-02-02, просмотров: 340.