термодинамики
Согласно п. 3.1, термодинамическая осуществимость процесса определяется балансом двух критериев: теплоты процесса и изменения энтропии.
1. а) С учетом того, что энтропия имеет размер приведенной теплоты, для бесконечно малой стадии процесса данное утверждение записывают так:
 |
Это означает, что процесс может идти только в том случае, если величина слева — отрицательна или равна нулю.
б) Если теплота выделяется, то 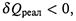 что дает отрицательный вклад в баланс.
что дает отрицательный вклад в баланс.
Аналогично, если энтропия увеличивается, то –T dS тоже меньше 0 (поэтому член T dS взят с обратным знаком). Оба эти изменения способствуют протеканию процесса.
в) Выше говорилось, что процесс может идти за счет и лишь одного стимула, если он «перевешивает» неблагоприятное воздействие второго критерия.
 г) Поскольку
г) Поскольку 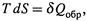 то второе начало термодинамики можно записать и так:
то второе начало термодинамики можно записать и так:
Следовательно, с учетом знака теплота реального процесса — не больше теплоты обратимого процесса, связывающего те же состояния системы.
2. Кроме того, можно объединить первое и второе начала термодинамики в одном выражении.
а) Запишем первое начало (1.7) в дифференциальной форме:
 |
выразим отсюда 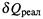 и подставим в неравенство второго начала (3.31):
и подставим в неравенство второго начала (3.31):
 |
Это – так называемое основное неравенство термодинамики, объединяющее оба ее начала.
б) Из последнего неравенства, в частности, следует, какую предельную по величине работу может совершить система в процессе:

(Поскольку работа совершается системой, то 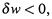 так что слева — положительная величина.)
так что слева — положительная величина.)
3. Нередко утверждают, что существование энтропийного фактора ограничивает возможность системы совершать работу.
а) В общем случае это неверно. Как видно из соотношения (3.35), если dS >0 (энтропия возрастает), то справа оказывается бóльшая величина, т.е. повышается верхний предел работы.
б) Действительно, в процессах жизнедеятельности работа часто совершается за счет только градиента концентраций; происхождение энергии здесь целиком обусловлено энтропийным фактором: внутренняя энергия при выравнивании концентраций разбавленных растворов не меняется.
4. а) В тепловых же машинах, с анализа которых зародилась термодинамика, происходит циклический процесс (как было показано на примере цикла Карно; п.3.2). Причём работа совершается за счёт подводимой извне теплоты (Q1), часть которой (Q2) отдаётся системой холодильнику.
 |
б) Ранее (см. (3.8,а)) было найдено, что
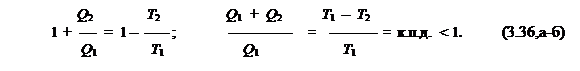 |
Перевернём это равенство и прибавим к каждой его части единицу. Тогда получим:
Здесь учтено, что, в соответствии с (3.6,а-б),
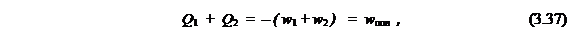 |
где w пол – результирующая полезная работа, совершённая машиной, а отношение w пол к полученной теплоте (Q 1 ) есть коэффициент полезного действия.
в) Неравенство к.п.д. < 1 следует из предположения, что абсолютный нуль температуры недостижим (т.е. Т2 ≠ 0 ).
Действительно, из последнего вытекает, что в тепловой машине даже в обратимом процессе всё получаемое извне тепло трансформироваться в работу не может (что и означает: к.п.д. тепловой машины – меньше единицы).
г) Обычно это утверждение и выражающее его соотношение (3.36) рассматривают как одну из формулировок второго начала термодинамики. Однако суть такого постулата узка и специфична: она справедлива лишь для тепловых машин.
Краткое содержание главы 3
1. В главе дано определение ВТОРОГО НАЧАЛА ТЕРМОДИНАМИКИ: имеются ДВА СТИМУЛА для самопроизвольного изменения термодинамической системы – I.ВЫДЕЛЕНИЕ ТЕПЛОТЫ и II.УВЕЛИЧЕНИЕ ЭНТРОПИИ. Результирующий же критерий, определяющий возможность процесса, есть баланс действия данных стимулов.
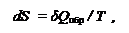 |
2. Фигурирующая здесь ЭНТРОПИЯ – это мера энергетического беспорядка в системе. Но практические её расчёты основаны на соотношении
которое утверждает, что изменение энтропии в любом реальном процессе измеряется приведённой теплотой обратимого процесса, связывающего те же состояния системы.
3. Для доказательства того, что δQобр/ T – ФУНКЦИЯ СОСТОЯНИЯ, был рассмотрен цикл Карно.
4. Получен ряд формул расчёта Δ S и S .
I. Нагревание системы:
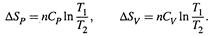
II. Абсолютная энтропия:
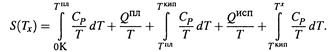
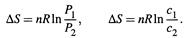 III. Изотермическое расширение газа и изотермическое изменение концентрации раствора:
III. Изотермическое расширение газа и изотермическое изменение концентрации раствора:
5. Рассмотрена также статистическая природа энтропии. Энтропия определяется через ВЕРОЯТНОСТЬ МИКРОСОСТОЯНИЙ (рi) или (при равенстве рi) через ЧИСЛО МИКРОСОСТОЯНИЙ (Ω = 1/ p ):
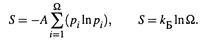
6. Дана также математическая формулировка второго начала термодинамики:
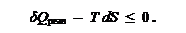 |
Это – запись утверждения о том, что термодинамическая возможность процесса определяется балансом двух критериев – теплоты и изменения энтропии.
Дата: 2019-02-02, просмотров: 399.