До сих пор мы исходили лишь из первого начала термодинамики. Теперь же перейдем к рассмотрению второго начала и связанных с ним термодинамических функций.
Общий смысл второго начала
1. Второе начало дает критерии того, какие процессы могут проходить самопроизвольно, а какие — нет.
а) Опыт показывает, что многие процессы идут с выделением теплоты (ΔH < 0).
б) Но среди самопроизвольных встречаются также процессы с почти нулевым тепловым эффектом (ΔH ≈ 0) и даже эндотермические процессы (ΔH > 0). Примером является растворение аммония нитрата в воде:
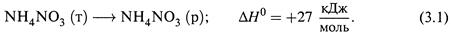 |
В этом самопроизвольном процессе происходит заметное поглощение теплоты, так что жидкость в сосуде сильно охлаждается.
в) Следовательно, тепловыделение не является решающим критерием того, может процесс протекать самопроизвольно или нет.
2. Второе начало термодинамики вводит в рассмотрение еще один критерий — энтропию, S, которая служит мерой энергетического беспорядка в системе. Чтобы понять, что это такое, рассмотрим два примера.
а) Распределение молекул вещества по объему.
Допустим, что все молекулы вещества сосредоточены в небольшой части V1 объема Vo (рис. 3.1, а). Это означает наличие в системе высокой упорядоченности, причем упорядоченности энергетической, поскольку молекулы являются носителями внутренней энергии.
Из опыта известно, что такой порядок неустойчив: частицы (если они ничем не зафиксированы) стремятся занять весь объем Vo, т. е. расположиться в нем самым произвольным образом (рис. 3.1,б).
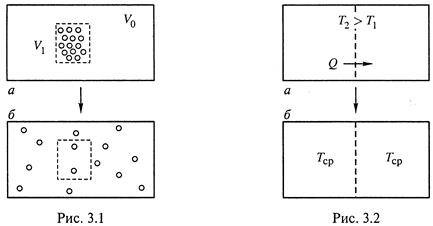 |
В результате в системе повышается степень энергетического беспорядка.
б) Выравнивание температур между частями системы.
Пусть вначале одна часть тела (системы) горячей, чем другая часть. Это тоже означает наличие упорядоченности: частицы с большей энергией находятся в одной части пространства, а частицы с меньшей энергией — в другой.
Хорошо известно, что в такой системе температура частей со временем самопроизвольно выравнивается, т.е. вновь достигается состояние с большим энергетическим беспорядком.
 |
3. а) Напомним, что мера такого беспорядка называется энтропией. Следовательно, в обоих рассмотренных самопроизвольных процессах энтропия системы возрастает:
б) А могут ли происходить процессы, в которых энтропия не увеличивается, а понижается? — Да. Пример — реакции вида
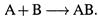 |
Здесь между частицами устанавливается связь, и поэтому они не могут располагаться в пространстве так же произвольно, как прежде. Следовательно, степень энергетического беспорядка уменьшается. И таких самопроизвольных реакций известно очень много.
4. Так каков же критерий самопроизвольности — теплота или энтропия? Оказывается, в общем случае и то, и другое.
а) Чтобы отразить это, можно сформулировать второе начало термодинамики следующим образом.
Имеются два стимула для самопроизвольного изменения термодинамической системы:
I ) снижение суммарной энергии системы (выделение теплоты) и
II ) более равномерное распределение энергии по компонентам и пространству системы (увеличение энтропии).
Результирующий же критерий, определяющий возможность процесса, есть баланс действия этих стимулов.
б) В учебниках в качестве второго начала обычно приводится множество других формулировок, например:
«Теплота не может самопроизвольно передаваться от более холодного тела к более горячему»,
«Коэффициент полезного действия паровой машины всегда меньше единицы» и т.д.
Но они, в основном, важны для физических процессов. А для химических процессов, с моей точки зрения, суть дела лучше всего отражается утверждением о двух стимулах.
5. Заметим: из этого утверждения, в частности, следует, что процессы могут идти и под влиянием только одного стимула, если второй отсутствует или даже оказывает противодействующее, но более слабое, влияние. Поэтому возможны
- самопроизвольные процессы, в которых поглощается теплота (если рост энергетического «беспорядка» является более весомым), и
- процессы, в которых понижается энтропия системы (если это сопровождается более сильным выделением теплоты).
6. а) Сделаем еще одно важное замечание. Выделение системой теплоты приводит к увеличению энтропии окружающей среды (из-за ускорения теплового движения частиц среды «беспорядок» их расположения возрастает), поэтому в балансе двух стимулов первый стимул (выделение теплоты) можно заменить на другой — возрастание энтропии внешней среды.
б) Тогда второе начало термодинамики можно сформулировать следующим образом.
Самопроизвольными являются такие процессы, которые приводят к увели чению общей энтропии окружающей среды и системы:
 |
в) Тем не менее при анализе конкретной системы рассматривать изменения в окружающей среде не всегда возможно, потому-то удобней исходить из первоначальной формулировки второго начала.
7. Важно иметь в виду и то, что сделанное утверждение — это условие необходимости, но не достаточности: наличие термодинамических стимулов означает, что процесс может протекать, но не означает, что он действительно будет идти. Последнее зависит уже от кинетических характеристик.
Дата: 2019-02-02, просмотров: 335.