221. Через раствор хлорида железа(II) пропускали ток, силой 3 ампера, в течение 10 минут. Найдите массу выделившегося железа.
222. Какое количество цинка должно растворяться каждую минуту в гальваническом элементе: Zn | ZnCl2 || CuCl2 | Cu для получения в цепи тока силой в 5 ампер?
223. В ходе никелирования бампера площадью 0,3 м2 ток пропускали 2 часа при постоянной силе тока в 20 А. Вычислить толщину покрытия. (плотность никеля = 8,9 г/см3).
224. При электролизе раствора нитрата хрома (III) за 10 минут на катоде выделилось 0,26 граммов хрома. Какова была сила тока?
225. При электролизе раствора нитрата серебра (I) за 20 минут на катоде выделилось 0,56 граммов серебра. Какова была сила тока?
226. При электролизе раствора нитрата меди (II) за 10 минут на катоде выделилось 0,46 граммов меди. Какова была сила тока?
227. При прохождении тока, силой 3 ампера, в течение 15 минут через раствор соли 3-х валентного металла на катоде выделилось 1,07 граммов металла. Определите атомную массу металла.
228. Покрыть восковую заготовку медью методом электролиза, масса покрытия 100 граммов. Подобрать силу тока, если выход по току составляет 95%, а время пропускания тока 2 часа.
229. В ходе никелирования бампера площадью 0,3 м2 ток пропускали 2 часа при постоянной силе тока в 5 А. Вычислить толщину покрытия. (плотность никеля = 8,9 г/см3).
230. Покрыть восковую заготовку медью методом электролиза, масса покрытия 100 граммов. Подобрать силу тока, если выход по току составляет 85%, а время пропускания тока 3 часа.
231. Через раствор хлорида железа(II) пропускали ток, силой 3 ампера, в течение 10 минут. Найдите массу выделившегося железа.
232. Через раствор хлорида цинка пропускали ток, силой 3 ампера, в течение 10 минут. Найдите массу выделившегося цинка.
233. Вычислите время, в течение которого нужно пропускать электрический ток силой 5 ампер через раствор сульфата железа (II), чтобы выделить на катоде 2,8 граммов железа.
234. Какое количество меди должно раствориться в гальваническом элементе: Cu|CuSO4||AgNO3|Ag , если он работал 30 минут, сила тока в цепи была 3 ампера. Сколько граммов серебра при этом выделилось?
235. Сколько граммов серебра выделится при пропускании через раствор нитрата серебра тока силой 10 ампер в течение 130 минут?
236. При прохождении тока, силой 15 ампера, в течение 40 минут через раствор соли 2-х валентного металла на катоде выделилось 11,7 граммов металла. Определите атомную массу металла.
237. Какое количество серебра должно раствориться в гальваническом элементе: Ag|AgNO3||CuSO4|Cu , если он работал 30 минут, сила тока в цепи была 3 ампера. Сколько граммов серебра при этом выделилось?
238. Через раствор хлорида железа(III) пропускали ток, силой 2 ампера, в течение 100 минут. Найдите массу выделившегося железа.
239. Через раствор хлорида алюминия пропускали ток, силой 0,5 ампера, в течение 3 часов. Найдите массу выделившегося алюминия.
240. При прохождении тока, силой 1 ампера, в течение 30 минут через раствор соли 3-х валентного металла на катоде выделилось 0,35 граммов металла. Определите атомную массу металла.
Приложения.
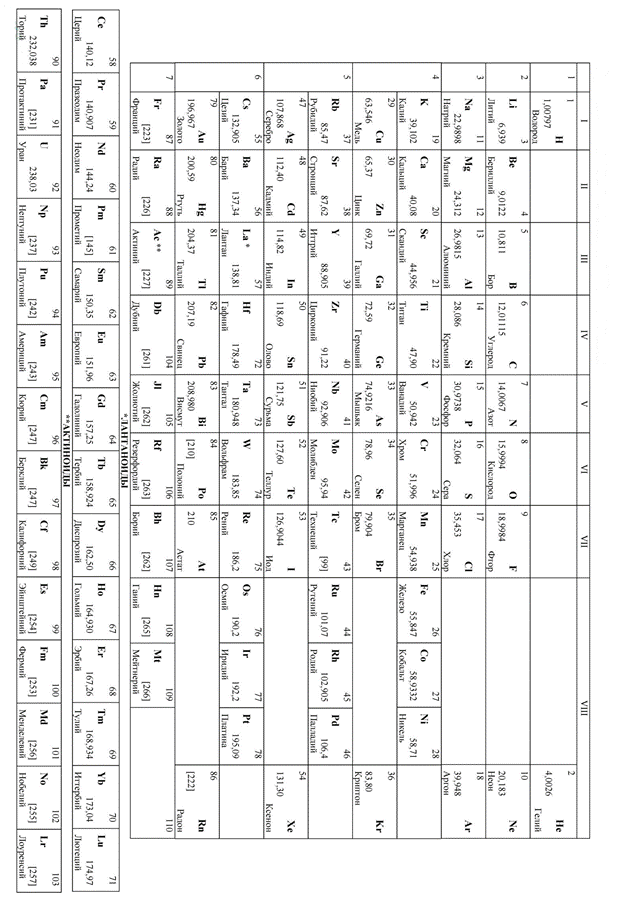
| Приложение 1. Периодическая таблица химических элементов. |
Приложение 2. Названия важнейших кислот и их солей.
| Формула | Образующий элемент | Степень окисления | название | соль |
| HF | Фтор (F) | -1 | Фтороводородная (Плавиковая) | Фторид |
| HBr | Бром (Br) | -1 | Бромоводородная | Бромид |
| HJ | Йод (J) | -1 | Йодоводородная | Йодид |
| HJO3 | Йод (J) | +5 | Йодноватая | Йодат |
| HCl | Хлор (Cl) | ‑1 | Хлороводородная (Соляная) | Хлорид |
| НСlO3 | Хлор (Cl) | +5 | Хлорноватя | Хлорат |
| НClO4 | Хлор (Cl) | +7 | Хлорная | Перхлорат |
| H2S | Сера (S) | ‑2 | Сероводородная | Сульфид |
| H2SO3 | Сера (S) | +4 | Сернистая | Сульфит |
| H2SO4 | Сера (S) | +6 | Серная | Сульфат |
| H2S2O3 | Сера (S) | +6 (‑2) | Тиосерная | Тиосульфат |
| HNO2 | Азот (N) | +3 | Азотистая | Нитрит |
| HNO3 | Азот (N) | +5 | Азотная | Нитрат |
| Н2СгO4 | Хром (Cr) | +6 | Хромовая | Хромат |
| НРO3 Н3РO4 | Фосфор (P) Фосфор (P) | +5 +5 | Метафосфорная Ортофосфорная | Метафосфат Ортофосфат |
| HMnO4 | Марганец(Mn) | +7 | Марганцовая | Перманганат |
| H3BO3 | Бор (B) | +3 | Отоборная | Ортоборат |
| H2CO3 | Углерод (C) | +4 | Угольная | Карбонат |
| H2SiO3 | Кремний (Si) | +4 | Кремниевая | Силикат |
| HCN | Циановодородная | Цианид | ||
| HSCN | Родановодородная | Роданид | ||
| HCOOH | Муравьиная | Формиат | ||
| CH3COOH | Уксусная | Ацетат | ||
| COOH-COOH | Щавелевая | Оксолат | ||
| C2H5OH | Этиловый спирт | Этилат |
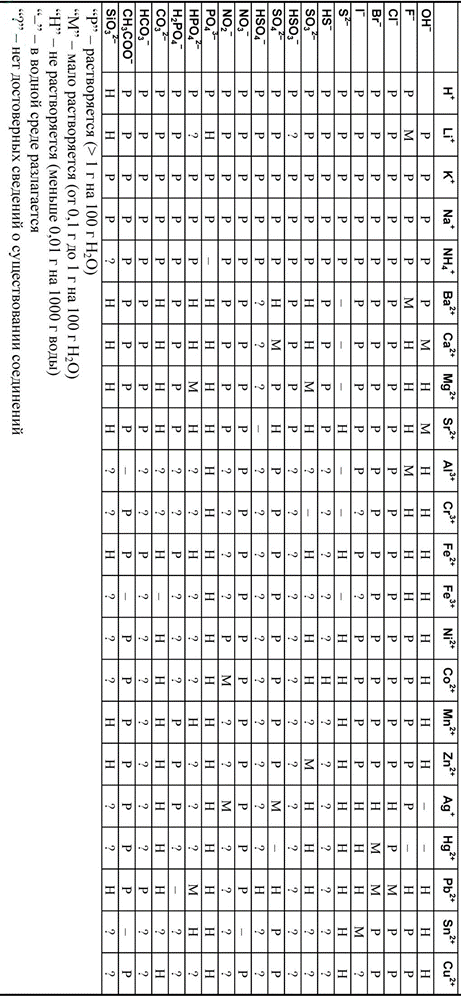
| Приложение 3. Таблица растворимости кислот, солей и оснований в воде. |
| Приложение 4. Стандартные энтальпии (ΔH0298), энтропии (S0298) и энергии Гиббса (ΔG0298) образования некоторых веществ при 298 К. | |||
| Вещество | ΔH0298, кДж/моль | S0298, кДж/моль | ΔG0298, кДж/моль |
| Al2O3 (к.) | -1676,0 | 50,9 | -1582,0 |
| C (графит) | 0 | 5,7 | 0 |
| CCl4 (ж.) | -132,8 | 216,2 | -62,7 |
| CH4 (г.) | -74,9 | 186,3 | -50,8 |
| C2H2 (г.) | 226,8 | 200,8 | 209,2 |
| C2H4 (г.) | 52,3 | 219,4 | 68,1 |
| C2H6 (г.) | -89,7 | 229,5 | -32,9 |
| C6H6 (ж.) бензол | 49,1 | 173,3 | 124,4 |
| C6H6 (г.) бензол | 82,9 | 269,2 | 129,7 |
| CH3OH (ж.) | – 238,6 | 126,8 | -166,3 |
| C2H5OH (ж.) | -277,0 | 160,7 | -174,2 |
| C2H5OH (г.) | -234,8 | 281,4 | -167,9 |
| D-C6H12O6 (глюкоза р-р.) | -1264,0 | 269,0 | -917,0 |
| CH3COOH (ж.) | -484,9 | 159,8 | -389,4 |
| (CH3)2CO (ж.) ацетон | -248,1 | 200,4 | -155,4 |
| (CH3)2CO (г.) ацетон | -217,6 | 294,9 | -153,1 |
| CO (г.) | -110,5 | 197,5 | -137,1 |
| CO2 (г.) | -393,5 | 213,7 | -394,4 |
| CS2 (г.) | 116,7 | 237,8 | 66,6 |
| CS2 (ж.) | 88,7 | 151,0 | 64,4 |
| CaCO3 (к.) | -1207,0 | 88,7 | -1127,4 |
| CaF2 (к.) | -1214,6 | 68,9 | -1161,9 |
| Ca3N2 (к.) | -431,8 | 105 | -368,6 |
| CaO (к.) | -635,5 | 39,7 | -604,2 |
| Ca(OH)2 (к.) | -986,6 | 76,1 | -896,8 |
| Cl2 (г.) | 0 | 222,9 | 0 |
| Cl2O (г.) | 76,6 | 266,2 | 94,2 |
| ClO2 (г.) | 105,0 | 257,0 | 122,3 |
| Cr2O3 (к.) | -1440,6 | 81,2 | -1050,0 |
| CuO (к.) | -162,0 | 42,6 | -129,9 |
| FeO (к.) | -264,8 | 60,8 | -244,3 |
| Fe2O3 (к.) | -822,2 | 87,4 | -740,3 |
| Fe3O4 (к.) | -1117,1 | 146,2 | -1014,2 |
| H2 (г.) | 0 | 130,5 | 0 |
| HBr (г.) | -36,3 | 198,6 | -53,3 |
| HCN (г.) | 135,0 | 113,1 | 125,5 |
| HCl (г.) | -92,3 | 186,8 | -95,2 |
| HF (г.) | -270,7 | 178,7 | -272,8 |
| HJ (г.) | 26,6 | 206,5 | 1,8 |
| H2O (г.) | -241,8 | 188,7 | -228,6 |
| H2O (ж.) | -285,8 | 70,1 | -237,3 |
| H2S (г.) | -21,0 | 205,7 | -33,8 |
| KCl (к.) | -435,9 | 82,6 | -408,0 |
| KClO3 (к.) | -391,2 | 143,0 | -289,9 |
| MgCl2 (к.) | -641,1 | 89,9 | -591,6 |
| MgO (к.) | -601,8 | 26,9 | -569,6 |
| N2 (г.) | 0 | 191,5 | 0 |
| NH3 (г.) | -46,2 | 192,6 | -16,7 |
| NH4Cl (к.) | -314,2 | 95,8 | 203,2 |
| NH4NO3 (к.) | -365,4 | 151 | -183,8 |
| N2O (г.) | 82,0 | 219,9 | 104,1 |
| NO (г.) | 90,3 | 210,6 | 86,6 |
| N2O3 (г.) | 83,3 | 307,0 | 140,5 |
| NO2 (г.) | 33,5 | 240,2 | 51,5 |
| N2O4 (г.) | 9,6 | 303,8 | 98,4 |
| N2O5 (к.) | -42,7 | 178 | 114,1 |
| NiO (к.) | -239,7 | 38,0 | -211,6 |
| O2 (г.) | 0 | 205,0 | 0 |
| OF2 (г.) | 25,1 | 247,0 | 42,5 |
| P2O3 (к.) | -820,0 | 173,5 | --- |
| P2O5 (к.) | -1492,0 | 114,5 | -1348,8 |
| PbO (к.) | -219,3 | 66,1 | -189,1 |
| PbO2 (к.) | -276,6 | 74,9 | -218,3 |
| SO2 (г.) | -296,9 | 248,1 | -300,2 |
| SO3 (г.) | -395,8 | 256,7 | -371,2 |
| SiCl4 (г.) | -687,8 | 204,6 | 57,2 |
| SiO2 (кварц) | -910,9 | 41,8 | -856,7 |
| SnO (к.) | -286,0 | 56,5 | -256,9 |
| SnO2 (к.) | -580,8 | 52,3 | -519,3 |
| Ti (к.) | 0 | 30,6 | 0 |
| TiCl4 (ж.) | -804,2 | 252,4 | -737,4 |
| TiO2 (к.) | -943,9 | 50,3 | -888,6 |
| WO3 (к.) | -842,7 | 75,9 | -763,9 |
| ZnO (к.) | -350,6 | 43,6 | -320,7 |
Приложение 5. Стандартные электродные потенциалы.
Cr
Al
Au
B
Cu
Be
Bi
Br
H
Hg
Ce
Cl
Mn
| Приложение 5. Стандартные электродные потенциалы. | |||||
| Реакция | E0, В | Реакция | E0, В | ||
| Mo | Mo3+ + 3e− → Mo | −0,200 | S | SO42− + H2O + 2e− → SO32− + 2OH− | −0,93 |
| N | NO3− + 7H2O + 8e− → NH4OH + 9OH− | −0,12 | 2SO42− +5H2O + 8e− → S2O32− + 10OH− | −0,76 | |
| NO3− + H2O + 2e− → NO2− + 2OH− | 0,01 | SO32− + 3H2O + 4e− → S + 6OH− | −0,66 | ||
| 2NO2− + 4H2O + 6e− → N2 + 8OH− | 0,41 | S2O32− + 6H+ + 8e− → 2S2− + 3H2O | −0,006 | ||
| NO3− + 2H+ + e− → NO2 + H2O | 0,80 | SO42− + 8H+ + 8e− → S2− + 4H2O | 0,149 | ||
| NO3− + 10H+ + 8e− → NH4+ + 3H2O | 0,87 | SO42− + 4H+ + 2e− → H2SO3 + H2O | 0,17 | ||
| NO3− + 3H+ + 2e− → HNO2 + H2O | 0,94 | SO32− + 6H+ + 6e− → S2− + 3H2O | 0,231 | ||
| NO3− + 4H+ + 3e− → NO + 2H2O | 0,957 | 2SO42− + 10H+ + 8e− → S2O32− + 5H2O | 0,29 | ||
| NO3− + 4H+ + 3e− → NO +2H2O | 0,96 | SO42− + 10H+ + 8e− → H2S + 4H2O | 0,311 | ||
| HNO2 + H+ + e− → NO + H2O | 1,00 | SO42− + 8H+ + 6e− → S + 4H2O | 0,357 | ||
| 2NO3− + 10H+ + 8e− → N2O + 5H2O | 1,116 | Sc Si | Sc3+ + 3e− → Sc | −2,077 | |
| 2NO3− + 12H+ + 10e− → N2 + 6H2O | 1,246 | SiO32− + 3H2O + 4e− → Si + 6OH− | −1,7 | ||
| 2HNO2 + 4H+ + 4e− → N2O + 3H2O | 1,297 |
Sn | SiO32− + 6H+ + 4e− → Si + 3H2O | −0,455 | |
| 2HNO2 + 6H+ + 6e− → N2 + 4H2O | 1,45 | SnO2 + 2H+ + 2e− → SnO + H2O | −0,108 | ||
| Na | Na+ + e− → Na | −2,714 |
| SnO2 + 4H+ + 4e− → Sn + 2H2O | −0,106 |
| Ni | Ni2+ + 2e− → Ni | −0,25 | SnO + 2H+ + 2e− → Sn + H2O | −0,104 | |
| O | O2 + 2H2O + 4e− → 4OH− | 0,401 |
Sr | Sn4+ + 2e− → Sn2+ | 0,151 |
| O2 + 2H+ +2e− → H2O2 | 0,682 | Sr2+ + 2e− → Sr | −2,888 | ||
| O2 + 4H+ + 4e− → 2H2O | 1,229 | Ti | Ti2+ + 2e− → Ti | −1,63 | |
| Pb | PbO + H2O + 2e− → Pb + 2OH− | −0,58 | TiO2 + 4H+ + 4e− → Ti + 2H2O | −0,86 | |
| PbSO4 + 2e− → Pb + SO42− | −0,356 |
V | Ti3+ + e− → Ti2+ | −0,368 | |
| Pb2+ + 2e− → Pb | −0,126 | V2+ + 2e− → V | −1,175 | ||
| PbO + 2H+ + 2e− → Pb + H2O | 0,248 |
Y | V3+ + e− → V2+ | −0,255 | |
| Pb(OH)2 + 2H+ + 2e− → Pb + H2O | 0,277 | Y3+ + 3e− → Y | −2,372 | ||
| PbO2 + H2O + 2e− → PbO + 2OH− | 0,28 | Zn | Zn(OH)2 + 2e− → Zn + 2OH− | −1,245 | |
| PbO2 + 4H+ + 2e− → Pb2+ + 2H2O | 1,455 | ZnO22− + 2H2O + 2e− → Zn + 4OH− | −1,216 | ||
| PbO2+ SO42− +4H+ +2e− → → PbSO4 + 2H2O | 1,685 |
| Zn2+ + 2e− → Zn | −0,763 | |
| Pb4+ + 2e− → Pb2+ | 1,694 | ZnO22− + 4H+ + 2e− → Zn + 2H2O | 0,441 | ||
| Pt | Pt2+ + 2e− → Pt | 1,188 | Zr | ZrO2 + 4H+ + 4e− → Zr + 2H2O | −1,553 |
| Rb | Rb+ + e− → Rb | −2,925 | Zr4+ + 4e− → Zr | −1,539 | |
|
Приложение 6. Элекрохимический ряд напряжений металлов. | |||||||||||||||||||||||
|
Окислительная способность металлов увеличивается
| |||||||||||||||||||||||
| - | |||||||||||||||||||||||
| Men+ | Li+ | K+ | Ba2+ | Ca2+ | Na+ | Mg2+ | Al3+ | Al3+ | Mn2+ | Zn2+ | Cr3+ | Fe2+ | Cd2+ | Co2+ | Ni2+ | Sn2+ | Pb2+ | H+ | Cu2+ | Ag+ | Hg2+ | Pt2+ | Au3+ |
| φ0, В | −3,05 | −2,92 | −2,91 | −2,87 | −2,71 | −2,38 | −1,66 | −1,66 | −1,18 | −0,78 | −0,74 | −0,44 | −0,4 | −0,28 | −0,25 | −0,14 | −0,13 | 0,00 | 0,34 | 0,8 | 0,85 | 1,19 | 1,5 |
| Me | Li | K | Ba | Ca | Na | Mg | Al | Al | Mn | Zn | Cr | Fe | Cd | Co | Ni | Sn | Pb | H | Cu | Ag | Hg | Pt | Au |
| Взаимодействуют с водой. Вытесняют водород из кислот. | Не взаимодействуют с водой. Вытесняют водород из кислот. | Не взаимодействуют с водой. Не вытесняют водород из кислот. | |||||||||||||||||||||
Литература
1. Глинка, Н. Л. Общая химия в 2 т. Том 1: учебник для академического бакалавриата / Н. Л. Глинка ; под ред. В. А. Попкова, А. В. Бабкова. — 20-е изд., пер. и доп. — М.: Издательство Юрайт, 2018. — 353 с. — (Серия : Бакалавр. Академический курс). — ISBN 978-5-9916-9353-0. — Режим доступа: www.biblio-online.ru/book/736D053E-E77C-4726-8CC5-F8E756E674A5.
2. Глинка, Н. Л. Общая химия в 2 т. Том 2 : учебник для академического бакалавриата / Н. Л. Глинка ; под ред. В. А. Попкова, А. В. Бабкова. — 20-е изд., пер. и доп. — М. : Издательство Юрайт, 2018. — 379 с. — (Серия : Бакалавр. Академический курс). — ISBN 978-5-9916-9355-4. — Режим доступа : www.biblio-online.ru/book/EBE718FD-189B-494E-A633-DCA7F607FCC9
3. Коровин Н.В. Общая химия. – М.: Высшая школа, 2002 г.
4. Глинка Н.Л. Общая химия. – М.: Интеграл-Пресс, 2001 г.
5. Глинка Н.Л. Задачи и упражнения по общей химии. ‑ М.: Интеграл-Пресс, 2005 г.
6. Ахметов Н.С. Общая и неорганическая химия. – М.: Высшая школа, 2002 г.
7. Угай Я.А. Общая и неорганическая химия. – М.: Высшая школа, 2000 г.
8. Хомченко И.Г. Общая химия. – М.: Новая волна. ОНИКС, 2001г
9. Хомченко Г.П., Цитович И.К. Неорганическая химия. – М.: Высшая школа, 1987 г
УДК 546 (0758)
Учебно-методическое пособие для самостоятельного разбора задач и контрольных работ по химии для студентов инженерных специальностей Уральского ГАУ по направлению подготовки 15.03.02 Технологические машины и оборудование Профиль: Машины и аппараты пищевых производств.
Составители: старший преподаватель кафедры химии, почвоведения и агроэкологии Суслов Е.А., старший преподаватель кафедры химии, почвоведения и агроэкологии Саетова Н.С., Екатеринбург, УрГАУ, 2018г., с. 66
Подписано в печать формат 60 х 84 1/16
Объем 4,5 п.л. Тираж экз. заказ №
Уральский государственный аграрный университет
620019, Екатеринбург, ул. К. Либкнехта, 42.
Дата: 2018-12-28, просмотров: 693.
