Электродвижущая сила (ЭДС) гальванического элемента – характеристика гальванического элемента, определяемая разницей потенциалов электродов этого элемента. Существуют два подхода для расчета ЭДС гальванического элемента:
Подход 1.
Принимается, что ЭДС равна разнице потенциалов катода и анода, то есть:
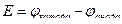
Запишем для гальванического элемента Zn|Zn2+||Cu2+|Cu:
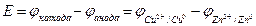
В этом случае используются уравнения и потенциалы, приведенные в таблицах стандартных электродных потенциалов (Приложение 5):
Анод: Zn2++2e‑ → Zn0; 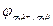 = ‑ 0,76 В.
= ‑ 0,76 В.
Катод: Cu2++2e‑ → Cu0; 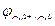 = + 0,52 В.
= + 0,52 В.
Е = 0,52 – (‑0,76)=0,52+0,76=1,28 В.
Подход 2.
Для расчета ЭДС запишем анодный и катодный процессы для гальванического элемента Zn|Zn2+||Cu2+|Cu в том виде, в котором они протекают:
Анод: Zn0 → Zn2++2e‑; 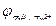 = + 0,76 В.
= + 0,76 В.
Катод: Cu2++2e‑ → Cu0; 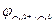 = + 0,52 В.
= + 0,52 В.
Тогда нужно просто сложить значения потенциалов реакций:
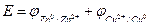
Е = 0,52+0,76=1,28 В.
Если ЭДС>0, значит, реакция протекает самопроизвольно, а схема гальванического элемента и решение верны. Если ЭДС<0, значит, в решении присутствует ошибка.
Пример 1. Цинк-медный гальванический элемент.
Составьте схему, напишите уравнения электродных процессов, вычислите ЭДС гальванического элемента, образованного стандартными электродами цинка и меди.
Нужно заметить, что здесь не указаны растворы, поэтому выберем растворы растворимых солей: ZnSO4 и CuSO4.
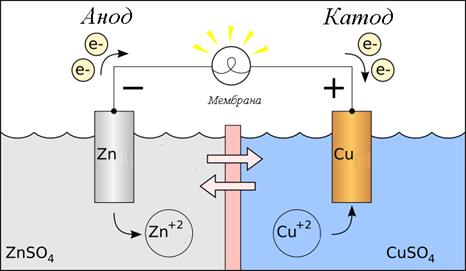
Для простоты восприятия можно нарисовать рисунок, этот рисунок можно использовать как основу для записи схему гальванического элемента:
| Рис. 2. Цинк-медный гальванический элемент. Для разделения пространств вблизи электродов используют мембрану или солевой мостик, суть которых не допустить смешивания раствором. На этой границе происходит смена носителя заряда. | |
|
| |
| Здесь происходит окисление цинка в соответствии с уравнением: Zn0 → Zn2++2e‑; φ0= + 0,76 В. Значит, здесь анод и анодное пространство. | Здесь происходит восстановление меди в соответствии с уравнением: Cu2++2e‑ → Cu0; φ0= + 0,52 В. Значит, здесь катод и катодное пространство. |
| Уравнения для электродных реакций можно найти в справочниках, и в Приложении 5, там же можно посмотреть значения стандартных электродных потенциалов (Приложении 6). | |
| На границе происходит растворение цинка, т.е. металлический цинк переходит в раствор сульфата цинка (ZnSO4) в виде иона (Zn2+). Это можно записать так: Zn|Zn2+ Zn|ZnSO4 | На границе происходит осаждение меди, т.е. медь из раствора сульфата меди (CuSO4) переходит в металлическое состояние и оседает на электроде в виде металла (Cu0). Это можно записать так: Cu2+|Cu CuSO4|Cu |
| Эти два процесса разделены пространственно мембраной, то есть их нужно записать в одну строку и разделить двумя чертами: | |
| Zn|Zn2+||Cu2+|Cu Zn|ZnSO4||CuSO4|Cu | |
| Теперь добавим обозначение анода и катода: | |
| (‑) А Zn|Zn2+||Cu2+|Cu К (+) (‑) А Zn|ZnSO4||CuSO4|Cu К (+) | |
Таким образом, записана схема гальванического элемента. Уравнения электродных процессов были определены в самом начале:
Zn0 → Zn2++2e‑; φ0= + 0,76 В;
Cu2++2e‑ → Cu0; φ0= + 0,52 В.
Теперь нужно вычислить разность потенциалов этого элемента (или ЭДС). Для этого нужно воспользоваться простой математической формулой:
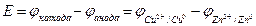
В этом случае используются следующие реакции и их потенциалы:
Zn2++2e‑ → Zn0; 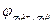 = ‑ 0,76 В.
= ‑ 0,76 В.
Cu2++2e‑ → Cu0; 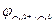 = + 0,52 В.
= + 0,52 В.
Е = 0,52 – (‑0,76)=0,52+0,76=1,28 В.
Дата: 2018-12-28, просмотров: 414.