61. Вычислите, какое количество теплоты выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 граммов железа.
62. Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4(газ) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
63. При взаимодействии газообразных сероводорода и оксида углерода (IV) образуются пары воды и сероуглерод CS2 (газ). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
64. Напишите термохимическое уравнение реакции между СО (газ) и водородом, в результате которой образуются СН4 (газ) и пары воды. Сколько теплоты выделится, если получено 67,2 литра метана при нормальных условиях.
65. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлороводорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект, если в реакцию вступило 10 литров аммиака при нормальных условиях.
66. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и оксида углерода (IV) равен минус 3135,58 кДж. Напишите термохимическое уравнение этой реакции, вычислив теплоту образования С6Н6(ж).
67. Вычислите, сколько теплоты выделится при сгорании 165 литров (условия нормальные) ацетилена С2Н2, если продуктами сгорания являются пары воды и оксид углерода (IV)?
68. При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 литров NO при нормальных условиях?
69. По термохимическому уравнению:
СН3ОН(ж)+1,5О2(газ) → СО2(газ) + 2Н2О(ж), ΔН=?
Вычислите тепловой эффект этой реакции, если теплота образования метанола равна 37,4 кДж.
70. При сгорании 11,5 граммов жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и оксид углерода (IV). Вычислите теплоту образования С2Н5ОН (ж).
71. По термохимическому уравнению:
С6Н6(ж)+7,5 О2(газ) → 6 СО2(газ) + 3Н2О(ж), ΔН=?
Вычислите тепловой эффект этой реакции, если теплота образования бензола равна 33,9 кДж.
72. Вычислите, сколько теплоты выделится при сгорании 1м3 (при нормальных условиях) этана С2Н6(газ), если продуктами сгорания являются пары воды и оксид углерода (IV)?
73. По термохимическому уравнению:
4NН3(газ)+3О2(газ) → 2N2(газ) + 6Н2О(ж), ΔН=‑153,28кДж.
Вычислите теплоту образования аммиака.
74. Определить теплоту образования оксида углерода(II), если известно, что теплота её сгорания равна 67636 кал/моль, а теплота образования СО2 равна 96052 кал/моль.
75. Определить теплоту образования метана, если его теплота сгорания равна 212797 кал/моль, а теплоты сгорания водорода и углерода соответственно равны 68317 и 94052 кал/моль.
76. Вычислить теплоту образования NH4Cl, если известно, что при взаимодействии 1 моля НСl с 1 молем NH3, выделяется 42277 кал и что теплоты образования NH3 и НСl равны 11040 и 22063 кал/моль соответственно.
77. Теплоты образования С2Н2, СО2 и Н2О(ж.) равны 54190, 94052 и 68317 кал/моль соответственно. Определить сколько тепла выделяется при сгорании 5 молей С2Н2.
78. Исходя из теплоты образования ΔHo298(СO2) =‑393.5 кДж/моль и термохимического уравнения:
С(графит) + 2N2O(г) → CO2(г)+2N2(г), ΔHo=‑557.5 кДж/моль,
вычислите теплоту образования N2O.
79. Определить теплоту реакции Fe2O3 + 2А1→ Al2O3 + 2Fe, если теплота образования Fe2O3 равна 196500 кал/моль и теплота образования Аl2O3 равна 399090 кал/моль.
80. Теплота реакции:
СаО + СО2 → СаСО3
равна 42498 кал, теплоты образования СаО и СО2 равны 151900 и 94052 кал/моль соответственно. Найти теплоту образования СаСО3.
Химическая кинетика
В данном разделе речь пойдет о скорости химической реакции. Скорость характеризует направление и быстроту перемещения, то есть изменение координаты в единицу времени. В зависимости от выбранного направления скорость можно представить:
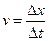 , или в обратном направлении:
, или в обратном направлении: 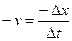
Скорость также может характеризовать изменение какой-либо величины: массы, объема в единицу времени. Химическая реакция как любой процесс происходит во времени, поэтому также характеризуется скоростью и направлением. В этом случае будет изменяться количество вещества в единицу времени. Количество вещества характеризуется концентрацией. Следовательно, скорость химической реакции определяется изменением концентрации в единицу времени:
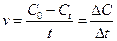 ,
,
здесь C0 – концентрация вещества в начальный момент времени, Ct – концентрация в момент времени t.
В тех случаях, когда для протекания реакции необходимо столкновение двух реагирующих частиц (молекул, атомов), зависимость скорости реакции от концентраций определяется законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Так, для реакции типа
А + В2 → АВ2
закон действия масс выражается следующим образом:
v = k*[A]*[B2].
В этом уравнении [А] и [В2] ‑ концентрации вступающих в реакцию веществ, а коэффициент пропорциональности k ‑ константа скорости реакции, значение которой зависит от природы реагирующих веществ.
В тех случаях, когда для протекания реакции необходимо столкновение трех реагирующих частиц (молекул, атомов), Гораздо реже реакция осуществляется путем столкновения трех реагирующих частиц. Например, реакция типа
А + 2В → АВ2
может протекать по механизму тройных столкновений:
А + В + В → АВ2 .
В этом случае, в соответствии с законом действия масс, можно записать
v = k*[A]*[В]*[В], т. е. v = k*[А]*[В]2 .
Одновременное столкновение более чем трех частиц крайне маловероятно. Поэтому реакции, в уравнения которых входит большое число частиц, протекают в несколько стадий. В подобных случаях закон действия масс применим к отдельным стадиям процесса, но не к реакции в целом.
В реакционной среде происходит конкуренция прямой и обратной реакций:
А + В ↔ C+D,
которые можно представить так:
А + В → C+D – прямая реакция
C+D → А + В – обратная реакция.
Здесь возникают понятия конкуренции реакций и направления протекания реакции. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает состояние химического равновесия и дальнейшего изменения концентраций, участвующих в реакции веществ не происходит.
В случае обратимой химической реакции
A+B↔C+D
зависимость скоростей прямой (v→) и обратной (v←) реакций от концентраций реагирующих веществ выражается соотношениями:
v→ = k→*[А]*[В]; v←= k←*[С]*[D].
В состоянии химического равновесия v→=v←, т. е.
k→*[А]*[В] = k←*[С]*[D]
В условиях равновесия, пользуясь правилом пропорциональных отношений, можно записать следующее:
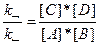 ;
; 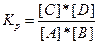
Здесь Кр — константа равновесия реакции.
Концентрации, входящие в выражение константы равновесия, называются равновесными концентрациями. Константа равновесия — постоянная при данной температуре величина, выражающая соотношение между равновесными концентрациями продуктов реакции и исходных веществ.
В тех случаях, когда для протекания реакции необходимо столкновение трех реагирующих частиц (молекул, атомов). Например, реакция типа
A + 2B → C+2D
может протекать по механизму тройных столкновений:
A+B+B → C+D+D
В этом случае, константу равновесия в соответствии, можно записать так:
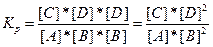
Тогда аналогично можно записать химическую реакцию и константу равновесия для нее в общем виде:
aА + bВ → cС+dD
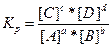
В выражение константы равновесия гетерогенной реакции, как и в выражение закона действия масс, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными.
Если имеется равновесие химической реакции, то его модно сместить в сторону прямой или обратной реакции. Для этого можно изменить следующие факторы:
1 ‑ концентрация веществ;
2 – давление;
3 – температура.
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье: если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Рассмотрим на примерах, как смещается равновесие.
Пример 1. Влияние концентрации на химическое равновесие.
2 NO(г) + O2(г) ↔ 2NO2(г); ΔHo298= ‑ 113,4 кДж/моль.
При введении в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличиваем концентрации NO или O2, значит, увеличиваем количество столкновений исходных веществ, увеличиваем скорость прямой реакции, смещаем равновесие в сторону образования NO2.
Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Пример 2. Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону. В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два.
2 NO(г) +1 O2(г) ↔ 2NO2(г);
При увеличении давления равновесии сместится в сторону меньшего объема (меньшего числа молей), то есть в сторону образования NO2. Уменьшение давления сместит равновесие в обратную сторону.
Если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Пример 3. Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции. Это согласуется с принципом Ле Шателье. Если в ходе прямой реакции выделяется тепло, а мы отводим тепло, по равновесие сместится в сторону продуктов. Если нагреваем реакционную зону, то равновесие сместится в сторону исходных веществ.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
2 NO(г) + O2(г) ↔ 2NO2(г); ΔHo298= ‑ 113,4 кДж/моль.
ΔHo298= ‑ 113,4 кДж/моль, значит, в ходе реакции выделяется тепло, повышается температура. Соответственно повышение температуры сместит равновесие в сторону исходных веществ.
Дата: 2018-12-28, просмотров: 614.