Изменение температуры может не только изменять направление химической реакции, но и задавать скорость реакции. Вспомним, что температура – характеристика внутренней энергии или скорости движения частиц. Так, если температура повышается, то количество столкновений увеличивается. И наоборот, при понижении температуры количество столкновений уменьшается. В первом приближении влияние температуры на скорость реакций определяется правилом Вант-Гоффа:
В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:
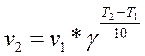
где γ ‑ температурный коэффициент, принимающий значения от 2 до 4.
Пример 4. Влияние температуры на скорость химической реакции.
Растворение образца сульфида цинка в соляной кислоте при 18оС заканчивается через 2,25 минуты, а при 38оС такой же образец соли растворяется за 0,25 минуты. За какое время данный образец растворится при 48оС?
Для решения воспользуемся уравнением Вант-Гоффа. Переведем все значения в систему Си.
2,25 минут = 135 секунд
0,25 минут = 15 секунд
18оС = 291 К
38оС = 311 К
48оС = 321 К
Вспомним, что скорость химической реакции равна обратному времени реакции:
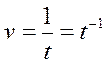
Подставим данные из задачи в уравнение:
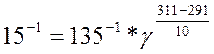
Найдем отсюда значение коэффициента γ:
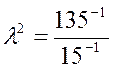
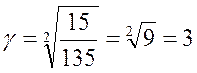
Зная коэффициент γ, легко найдем скорость реакции при температуре 48 оС:
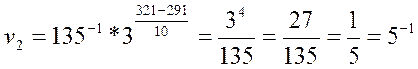
Растворение образца сульфида цинка в соляной кислоте при 48оС протекает со скоростью v=0,2 с-1.
Блок №5.
81. Напишите выражение для константы равновесия экзотермической реакции:
СО+Cl2 → COCl2; ΔHo = ‑111 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
82. Напишите выражение для константы равновесия экзотермической реакции:
S + O2 → SO2 + 279 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
83. Напишите выражение для константы равновесия:
2CO+O2 → 2CO2, ΔHo = ‑571 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
84. Напишите выражение для константы равновесия:
SO2 + 1/2O2→SO3, ΔHo = ‑96,3 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
85. Напишите выражение для константы равновесия:
С + H2O→CO + H2 ‑ 117 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
86. Напишите выражение для константы равновесия:
2NO + O2→2NO2 + 70,2 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
87. Напишите выражение для константы равновесия:
СН4 + 2O2 →CO2 + H2O (г), ΔН =‑802,2 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
88. Напишите выражение для константы равновесия экзотермической реакции:
СО + H2O→CO2 + H2; ΔHo= 2 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 3 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
89. Напишите выражение для константы равновесия:
С + 2N2O → CO2 + 2 N2 + 557,5 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
90. Напишите выражение для константы равновесия:
FeO + CO →CO2 + Fe + 18,2 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
91. Напишите выражение для константы равновесия экзотермической реакции:
СО + Cl2→COCl2; ΔHo = ‑111 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
92. Напишите выражение для константы равновесия:
S + O2→SO2 + 279кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
93. Напишите выражение для константы равновесия:
2CO + O2→2 CO2, ΔH =‑571 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
94. Напишите выражение для константы равновесия:
SO2 + 1/2 O2→SO3, Δ H =‑96,3 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
95. Напишите выражение для константы равновесия:
С + H2O→CO + H2 ‑ 117 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
96. Напишите выражение для константы равновесия:
2NO + O2→2NO2 + 70,2 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
97. Напишите выражение для константы равновесия:
СН4 + 2 O2→CO2 + H2O(г), Δ Н =‑802,2 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
98. Напишите выражение для константы равновесия экзотермической реакции:
СО + H2O→CO2 + H2 ΔHo= 2 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
99. Напишите выражение для константы равновесия:
С + 2N2O→CO2 + 2N2 + 557,5 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
100.Напишите выражение для константы равновесия:
FeO + CO→CO2 + Fe + 18,2 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
Растворы
К расчетным задачам также относятся и задачи на приготовление растворов. Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами — долями или процентами, либо величинами размерными — концентрациями. (Концентрация – это содержание чего-либо в чем-либо: соли в воде, кислоты в воде, воды в кислоте и т.д.). Массовая доля более широкое понятие, и его мы ввели выше:
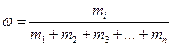 ;
; 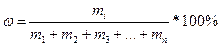
Это понятие также справедливо и для растворов:
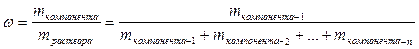 ;
; 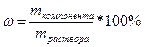
Таким образом, встречается понятие растворов 10 %-ной (25 %-ной, 12 %-ной и т.д.) концентрации.
Для практических расчетов по изменению концентрации раствора или по приготовлению раствора заданной концентрации удобно использовать «правило креста». Суть этого правила или метода расчета сводится к графической записи задачи, из которой смешиваем раствор и воду (растворитель), смешиваем раствор и чистое вещество, с которым готовим раствор (сухую навеску соли, чистое жидкое вещество)
Случай 1
Нужно приготовить раствор KOH с концентрацией 15% из растворов KOH с концентрациями 5% и 60%.
 W1 W1
| 
| |w2-w3| | 15-5=10 |
|  W3 W3
| ||
| W2 | |w1-w3| | 60-15=45 |
Таким образом, мы нашли, что для приготовления раствора с концентрацией 15 % нам нужно взять 10 массовых частей раствора с концентрацией 60% и 45 частей с концентрацией 5%. Далее нам поможет применение пропорции:
45+10=55 - пусть 250 граммов раствора, тогда
10 ‑ х
45 – у
Х=10*250/55=45,45 г.
У=45*250/55=204,54 г.
Случай 2
Нужно приготовить раствор KOH с концентрацией 15% из раствора KOH с концентрацией 60%. В этом случае подразумевается, что этот раствор нужно разбавить водой до нужной концентрации. В этом случае в качестве второго раствора будет выступать раствор с концентрацией ω=0% (содержание вещества в чистой вожже = 0).
 W1 W1
| 
| |w2-w3| | 15-0=15 |

|  W3 W3
| ||
| W2 | |w1-w3| | 60-15=45 |
Таким образом, мы нашли, что для приготовления раствора с концентрацией 15 % нам нужно взять 15 массовых частей раствора с концентрацией 60% и 45 частей с концентрацией 5%. Далее нам поможет применение пропорции:
45+15=60 - пусть 250 граммов раствора, тогда
15 ‑ х
45 – у
Х=15*250/60=62,5 г
У=45*250/60=187,5 г
Случай 3
Нужно приготовить раствор KOH с концентрацией 15% из раствора KOH с концентрацией 5% и сухой навески KOH. Здесь сухой гидроксид калия KOH не содержит воды, то есть его концентрация ω=100%.
 W1 W1
| 
| |w2-w3| | 15-5=10 |
|  W3 W3
| ||
| W2 | |w1-w3| | 100-15=85 |
Таким образом, мы нашли, что для приготовления раствора с концентрацией 15 % нам нужно взять 85 массовых частей раствора с концентрацией 5% и 10 частей с концентрацией 100%. Далее нам поможет применение пропорции:
10+85=95 - пусть 250 граммов раствора, тогда
10- х
85 – у
Х=10*250/95=26,31 г.
У=85*250/95=223,68 г.
Массовая доля завязана на массу, а работать удобнее с объемами. Поэтому нужно ввести и использовать понятие плотности. Фактически, плотность – это масса фиксированного объема (масса одного литра, масса одного миллилитра).
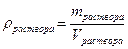
Рассмотрим использование плотности и массовой доли на следующем примере:
Пример 1
Какой объем 20%-ного раствора гидроксида натрия (плотность 1,15 г/мл) необходим для приготовления 300 мл 15%-ного раствора с плотностью 1,09 г/мл.
Для решения данной задачи нужно понимать, что в ней два присутствуют раствора с разными параметрами.
«Какой объем 20%-ного раствора гидроксида натрия (плотность 1,15 г/мл)» ‑ первый раствор.
«300 мл 15%-ного раствора с плотностью 1,09 г/мл» ‑ второй раствор.
Кроме того, задачу удобно решить с конца.
Так как для второго раствора фиксировано количество, то мы можем найти массу растворенного вещества (KOH), которое нужно для его приготовления.
У нас есть плотность и объем, а из них находится масса раствора:
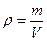 ;
; 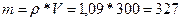 ;
; 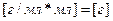
Масса раствора 327 граммов, в котором 15% ‑ это масса KOH, а 85% ‑ это вода.
Для определения массы чистого KOH нужно воспользоваться формулой массовой доли:
15% ~ 0,15
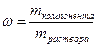 ;
; 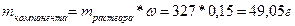
Так определена масса вещества, необходимая для приготовления второго раствора. А берем мы ее из первого. Однако это масса чистого вещества, а у нас есть только раствор. Тогда нужно вычислить массу раствора через массовую долю:
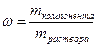 ;
; 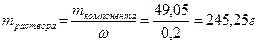
На этом этапе нужно провести оценку разумности результатов. Обратим внимание на концентрации и массы растворов, принимая во внимание, что количество растворенного вещества одинаково. Раствор с большей концентрацией (ω=20%) имеет меньшую массу m=245,25г, чем раствор с меньшей концентрацией (ω=15%) m=327г. Такое соотношение разумно и логично, значит, ход решения идет верно. Если же возникла обратная зависимость, то следует проверить решение на наличие ошибок.
Следующий шаг – вычислить объем первого раствора, зная его массу и плотность:
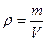 ;
; 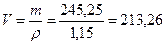 ;
; 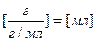
Таким образом, ответ в данной задаче:
213,26 мл 20%-ного раствора гидроксида натрия необходим для приготовления 300 мл 15%-ного раствора.
Рассмотрим для наглядности эту задачу в виде таблицы:
Шаг 1:
Заполним таблицу данными из задачи. Обозначим искомую величину за X. Заметим, что последняя строка mвещества – имеет одинаковые значения по условию задачи. То есть, mвещества1=mвещества2
| Параметры | Раствор 1 | Раствор 2 |
| ω, % | 20% | 15% |
| ρ, г/мл | 1,15 | 1,09 |
| V, мл | X | 300 |
| mраствора, г | --- | --- |
| mвещества, г | --- | --- |
Шаг 2:
Вычисляем массу раствора 2:
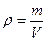 ;
; 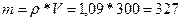 ;
; 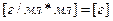
| Параметры | Раствор 1 | Раствор 2 |
| ω, % | 20% | 15% |
| ρ, г/мл | 1,15 | 1,09 |
| V, мл | X | 300 |
| mраствора, г | --- | 327 |
| mвещества, г | (одно значение) | |
Шаг 3:
Вычисляем массу растворенного вещества:
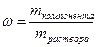 ;
; 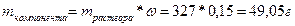
| Параметры | Раствор 1 | Раствор 2 |
| ω, % | 20% | 15% |
| ρ, г/мл | 1,15 | 1,09 |
| V, мл | X | 300 |
| mраствора, г | --- | 327 |
| mвещества, г | ||
49,05
Шаг 4:
Вычисляем массу первого раствора:
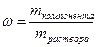 ;
; 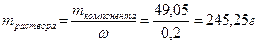
| Параметры | Раствор 1 | Раствор 2 |
| ω, % | 20% | 15% |
| ρ, г/мл | 1,15 | 1,09 |
| V, мл | X | 300 |
| mраствора, г | 245,25 | 327 |
| mвещества, г | 49,05 | |
Шаг 5 :
Вычисляем искомый объем первого раствора:
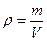 ;
; 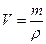 ;
; 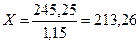 ;
; 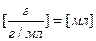
| Параметры | Раствор 1 | Раствор 2 |
| ω, % | 20% | 15% |
| ρ, г/мл | 1,15 | 1,09 |
| V, мл | 213,26 | 300 |
| mраствора, г | 245,25 | 327 |
| mвещества, г | 49,05 | |
Обозначим искомую величину за X
Искомое значение X (объем первого раствора с ω=20%) найдено: X=213,26 мл.
Блок №6.
101.К 0.5 литрам 15 % раствора серной кислоты (плотность 1.1 г/мл) добавили 60 мл воды. Определить концентрацию полученного раствора.
102.Вычислить массовую долю в процентах раствора хлорида калия, если в 2 литрах раствора содержится 10 г соли. Плотность раствора принять за единицу.
103.Какой объем 96 %-ного раствора серной кислоты с плотностью 1,84 г/мл необходим для приготовления 250 мл 20 % раствора.
104.Определить массовую долю в % раствора гидроксида калия, полученного смешением 100 мл 10 %-ного раствора (плотность 1,08 г/мл) и 200 мл 30%-ного раствора с плотностью 1,29 г/мл.
105.Определить массовую долю в процентах раствора серной кислоты, если к 200 мл 50%-ного раствора с плотностью 1,43 г/мл прибавили 500 мл воды.
106.Какую массу соли и какой объем воды нужно взять для приготовления 2 литров 20 %-ного раствора (плотность 1,1 г/мл ).
107.Какой объем 20%-ного раствора гидроксида натрия (плотность 1,15 г/мл ) необходим для приготовления 300 мл 15%-ного раствора с плотностью 1,09 г/мл.
108. Вычислить процентную концентрацию раствора хлорида натрия, если в 500 мл раствора содержится 50 грамм соли. Плотность раствора принять за единицу.
109.Какой объем 25%-ного раствора серной кислоты (плотность 1,18 г/мл ) надо взять для приготовления 1 л 12%-ного раствора с плотностью 1,08 г/мл?
110.Вычислить процентную концентрацию раствора соляной кислоты, полученного смешением 200 г 10% раствора и 250 мл 25% раствора с плотностью 1,17 г/мл.
111.Какой объем 10% раствора гидроксида натрия (плотность 1.1 г/мл) необходим для приготовления 5% раствора массой 100г.
112.Какова процентная концентрация раствора гидроксида натрия, полученного смешением 500 мл 5% раствора (плотность 1,05 г/мл) и 200 г 10% раствора.
113.Из 400 г 20% (по массе) раствора при охлаждении выделилось 50 г растворенного вещества. Чему равна массовая доля этого вещества в оставшемся растворе?
114.Определите массу гидроксида натрия, который надо взять для приготовления 200 мл раствора с массовой долей NaOH 30% (плотность раствора 1,33 г/мл).
115.Какой объем раствора с массовой долей серной кислоты 88% (плотность 1,8 г/мл) надо взять для приготовления 300 мл раствора с массовой долей кислоты 40% (плотность 1,3г/мл).
116.Сколько мл 74% серной кислоты (плотность 1,664 г/мл) потребуется для приготовления 250 г 20% раствора серной кислоты?
117.До какого объёма надо разбавить 500 мл 20% (по массе) раствора хлорида натрия (плотность 1.152 г/мл), чтобы получить 4.5%-ный раствор (плотность 1.029 г/мл).
118.Определите массовую долю вещества в растворе НСl, полученном смешением 300г 25%- ного и 400 г 40% - ного (по массе) растворов этого вещества.
119.Сколько воды надо прибавить к 100 мл 20 % раствора серной кислоты с плотностью 1.14 г/мл, чтобы получить 5 % раствор серной кислоты?
120.Из 400 г 50% (по массе) раствора серной кислоты выпариванием удалили 100г воды. Чему равна массовая доля серной кислоты в оставшемся растворе?
Дата: 2018-12-28, просмотров: 879.