201.Составьте уравнения электродных процессов, протекающих при электролизе раствора сульфата цинка с угольными электродами; с цинковым анодом.
202.Составьте уравнения электродных процессов, протекающих при электролизе раствора нитрата меди с угольными электродами; с медным анодом.
203.Составьте уравнения электродных процессов, протекающих при электролизе раствора и расплава хлорида натрия.
204.Составьте уравнения электродных процессов, протекающих при электролизе раствора нитрата кальция и расплава хлорида меди.
205.Составьте уравнения электродных процессов, протекающих при электролизе раствора сульфата натрия и расплава бромида калия.
206.Составьте уравнения электродных процессов, протекающих при электролизе раствора и расплава хлорида алюминия.
207.Составьте уравнения электродных процессов, протекающих при электролизе раствора нитрата серебра с инертными электродами; с серебряным анодом.
208.Составьте уравнения электродных процессов, протекающих при электролизе раствора нитрата никеля с угольными электродами; с никелевым анодом.
209.Составьте уравнения электродных процессов, протекающих при электролизе раствора и расплава иодида натрия.
210.Составьте уравнения электродных процессов, протекающих при электролизе раствора карбоната калия и расплава бромида меди.
211.Составьте уравнения электродных процессов, протекающих при электролизе раствора хлорид никеля с угольными электродами; с никелевым анодом.
212.Составьте уравнения электродных процессов, протекающих при электролизе раствора нитрат кобальта с угольными электродами; с кобальтовым анодом.
213.Составьте уравнения электродных процессов, протекающих при электролизе раствора и расплава сульфида натрия.
214.Составьте уравнения электродных процессов, протекающих при электролизе раствора сульфата меди с угольными электродами; с медным анодом.
215.Составьте уравнения электродных процессов, протекающих при электролизе раствора и расплава сульфида лития.
216.Составьте уравнения электродных процессов, протекающих при электролизе раствора нитрита кальция и расплава иодида железа(II).
217.Составьте уравнения электродных процессов, протекающих при электролизе раствора сульфита калия и расплава бромида кальция.
218.Составьте уравнения электродных процессов, протекающих при электролизе раствора и расплава сульфида магния.
219.Составьте уравнения электродных процессов, протекающих при электролизе раствора нитрата свинца с инертными электродами; со свинцовым анодом.
220.Составьте уравнения электродных процессов, протекающих при электролизе раствора и расплава хлорида магния
Законы электролиза Фарадея
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод.
m~q или m=K*q,
где m ‑ масса вещества, q – количество электричества (электрический заряд, измеряемый в кулонах; q=I*t, сила тока, прошедшая через электролизер и умноженная на время пропускания тока), K – электрохимический эквивалент вещества.
Второй закон электролиза Фарадея: для данного количества электричества масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
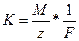 ,
,
где K – электрохимический эквивалент вещества; M – молярная масса элемента; z – заряд элемента; F – постоянная Фрадея (96485 Кл/моль≈96500 Кл/моль).
Для решения практических и теоретических задач используют объединенное выражение законов Фарадея:
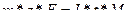
При электролизе также имеет место выход по току. Выход по току – это выраженное в процентах отношение количества фактически затраченного электричества (Qфакт) к теоретически необходимому(Qтеор). Также может быть использована степень отклонения от массы фактически прореагировавшего на электроде вещества (mфакт) к теоретически рассчитанной по закону Фарадея(mтеор):
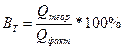 ;
; 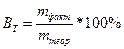 ;
; 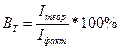
Для решения расчетных задач на тему законов электролиза Фардея необходимо пользоваться объединенным выражением и корректно записать все элементы выражения в системе СИ.
Важно помнить, что mтеор>mфакт; Iфакт>Iтеор
Пример 1. При электролизе в течении 1 часа водного раствора нитрата висмута (Bi(NO3)3) на катоде выделилось 14 грамм висмута (Bi). Выход по току составляет 94 %. Вычислите силу тока.
В этой задаче необходимо использовать оба выражения, приведенные выше. Сначала придется определить теоретическую силу тока:
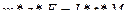
m = 14 граммов.
z = 3 (Bi3+)
F = 96500 Кл/моль
I = ? А
t = 3600 секунд
M = 208,98 г/моль
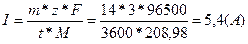
В задаче приводится BT=94%. Используем выражения для выхода по току и рассчитаем фактическую силу тока:
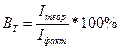 ;
; 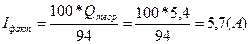
Дата: 2018-12-28, просмотров: 381.