Электролиты ‑ вещества, которые при растворении подвергаются диссоциации на ионы. Диссоциация ‑ растворение, распад. В результате раствор приобретает способность проводить электрический ток, т.к. в нем появляются подвижные носители электрического заряда. Например, при растворении в воде уксусная кислота диссоциирует на ион водорода и ацетат-ион:
CH3COOH ↔ H+ + CH3COO–
Необходимым условием, определяющим возможность процесса электролитической диссоциации, является наличие в растворяемом веществе ионных или полярных связей, а также достаточная полярность самого растворителя. Количественная оценка процесса электролитической диссоциации дается двумя величинами: степенью диссоциации α и константой диссоциации K.
Степенью диссоциации (α) электролита называется отношение числа его молекул, распавшихся на ионы, к общему числу молекул электролита в растворе, т. е.
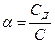
Так, если C=0,1 моль/л, а концентрация диссоциированной части вещества Сд=0,001 моль/л, то для растворенного вещества α=0,001/0,1=0,01, или α=1%. Степень электролитической диссоциации зависит как от природы растворенного вещества, так и от концентрации раствора, увеличиваясь с его разбавлением.
Электролиты можно разделить на две большие группы: сильные и слабые. Сильные электролиты диссоциируют практически полностью. К сильным электролитам относятся: H2SO4, HCl, HNO3, H3PO4, HClO3, HClO4, KOH, а также хорошо растворимые соли: NaCl, KBr, NH4NO3 и др. Для слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами. К слабым электролитам относятся плохо растворимые соли (Приложение 3), вода и большинство органических кислот (например, уксусная CH3COOH, муравьиная HCOOH), а также неорганические соединения: H2CO3, H2S, HCN, H2SiO3, H2SO3, HNO2, HClO, HCNO, NH4OH и др.
Константа равновесия для процесса диссоциации называется константой диссоциации (Kр). В общем случае для электролита, диссоциирующего на два иона:
АВ↔А+ + В–
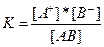
Для приведенного выше процесса диссоциации уксусной кислоты:
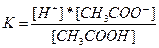
Если обозначить концентрацию электролита, распадающегося на два иона, через C, то
[A+] = [B–] = αC; [AB] = C(1–α);
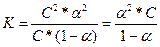
Это уравнение соответствует закону разбавления Оствальда. Если электролит слабый, и диссоциация очень мала (α<<1), то закон разбавления Оствальда упрощается:
K=α2C; 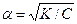 .
.
Таким образом, степень диссоциации возрастает с разбавлением раствора.
Многоосновные кислоты и основания многовалентных металлов диссоциируют ступенчато:
H2CO3 ↔ H+ + HCO3–
HCO3– ↔ H+ + CO32–
Первое равновесие – диссоциация по первой ступени – характеризуется константой
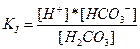
Для диссоциации по второй ступени:
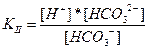
В случае угольной кислоты константы диссоциации имеют следующие значения: KI = 4,3*10–7, KII = 5,6*10–11. Для ступенчатой диссоциации всегда KI>KII>KIII>..., т.к. энергия, которую необходимо затратить для отрыва иона, минимальна при отрыве его от нейтральной молекулы.
Следующий блок заданий сводится к умению пользоваться таблицей растворимости и пониманию сильных и слабых кислот и оснований. Для решения задач в этом блоке необходимо помнить, что вода, газы и осадки не распадаются на ионы и соответственно не расписываются. А так же все реакции в этом разделе – это реакции обмена. Рассмотрим несколько примеров, как составляются молекулярные и ионные уравнения.
Пример 1. Составьте молекулярные и ионные уравнения реакций, протекающих между сульфатом бериллия и гидроксидом калия.
Для начала нужно найти эти соединения и записать их в левую часть уравнения реакции.
BeSO4+KOH→
Если возникает вопрос, что делать дальше, то следует посмотреть в таблицу растворимости и определить: будут ли диссоциировать записанные соединения. Для этого находим в таблице K (K+) в верхней строке и OH (OH‑) в левом столбике и смотрим отметку на их пересечении. Если стоит «М» или «Н», то такое соединение выпадает в осадок, если «Р» ‑ то это соединение растворимо в воде и может быть записано в виде ионов. В соответствии с таблицей можно записать следующее:
Be2++SO42‑+K++OH‑→
Вспомним, что рассматривается реакция обмена, и выделим положительно и отрицательно заряженные ионы:
(Be2++SO42‑)+(K++OH‑)→
Положительные ионы нужно поменять местами:
(Be2++SO42‑)+(K++OH‑)→(K++SO42‑)+(Be2++OH‑)
Теперь нужно учесть, что количество положительных и отрицательных зарядов в одном соединении одинаково:
(Be2++SO42‑)+(K++OH‑)→(2K++SO42‑)+(Be2++2OH‑)
Разобравшись с записью участников реакции перепишем начальное уравнение:
BeSO4+KOH→K2SO4+Be(OH)2
Уравняем количество элементов в левой и правой частях.
BeSO4+2KOH→K2SO4+Be(OH)2
Проверим растворимость каждого соединения по таблице растворимости и запишем в ионном виде:
Be2++SO42‑+2K++2OH‑→2K++SO42‑+Be(OH)2↓
Сокращая одинаковые ионы в правой и левой частях переходим к сокращенному ионному уравнению.
Be2++SO42‑+2K++2OH‑→2K++SO42‑+Be(OH)2↓
Be2++2OH‑→Be ( OH )2↓
В итоге имеем три уравнения: в молекулярном виде, в полном ионном и сокращенном ионном виде.
BeSO4+2KOH→K2SO4+Be(OH)2↓
Be2++SO42‑+2K++2OH‑→2K++SO42‑+Be(OH)2↓
Be2++2OH‑→Be(OH)2↓
Пример 2. Составьте молекулярные и ионные уравнения реакции, протекающей гидроксидом цинка и серной кислота.
Для начала найдем и запишем эти соединения в левую часть уравнения реакции.
Zn(OH)2+H2SO4→
У каждого соединения есть катион (положительный ион, см. таблицу растворимости) и анион (отрицательный ион, см. таблицу растворимости). Поменяем местами положительные ионы и перепишем на своих местах отрицательные.
Zn(OH)2+H2SO4→HOH+ZnSO4
Уравняем коэффициенты.
Zn(OH)2+H2SO4→2HOH+ZnSO4
Записи HOH и H2O равнозначны.
Zn(OH)2+H2SO4→2H2O+ZnSO4
Далее распишем полное ионное уравнение в соответствии с таблицей растворимости. Воды не расписывается.
Zn2++2OH‑+2H++SO42‑→2H2O+Zn2++SO42‑
И сокращенное ионное уравнение.
2OH‑+2H+→2H2O
Встречаются также задачи, обратные рассмотренным, в которых нужно из сокращенного ионного уравнения составить полное ионное и молекулярное.
Пример 3. Составьте молекулярное уравнение реакции, которое выражается ионным уравнением
Sn(OH)2 + 2Н+ → Sn2+ + 2H2O
Из уравнения понятно, что добавлена кислота, которая образует с оловом (Sn) растворимое соединение. Подбираем такой анион в таблице растворимости. Подходят: Cl‑, SO42‑. Можно взять любой.
Sn(OH)2 + 2Н+ + 2Cl‑→ Sn2+ +2Cl‑+ 2H2O
Далее запишем в молекулярном виде.
Sn(OH)2 + 2НCl→ SnCl2+ 2H2O
Пример 3. Составьте молекулярное уравнение реакции, которое выражается ионным уравнением
H++OH‑→H2O
Из уравнения видно, что смешали сильную кислоту и сильное основание. Выберем из таблицы растворимости соответствующие анион и катион.
H++Cl‑+Na++OH‑→H2O+Na++Cl‑
Далее запишем в молекулярном виде.
HCl+NaOH→NaCl+H2O
Дата: 2018-12-28, просмотров: 414.