141.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
NO + K2Cr2O7 + H2SO4 → HNO3 + Cr2(SO4)3 + K2SO4 + H2O
FeCl2 + K2Cr2 O7 + HCl → FeCl3 + CrCl3 + KCl + H2O.
142.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
Al + K2Cr2O7 + H2SO4 → Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O.
Ca3(PO4)3 + C + SiO2 → CaSiO3 + CO + P4
143.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
FeSO4 + KClO3 + H2SO4 → Fe2(SO4)3 + KCl + H2O.
NaCl + MnO2 + H2SO4 → MnSO4 + Na2SO4 + Cl2 + H2O.
144.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
Na + HNO3 → NaNO3 + NH4NO3 + H2O
CrCl3 + KNO3 + KOH → K2CrO4 + KNO2 + KCl + H2O
145.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
CrCl3 + KOH + H2O2 → K2CrO4 + KCl + H2O
KNO3 + KI + H2SO4 → NO + I2 + K2SO4 + H2O
146.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
Al + KNO3 + KOH → K3AlO3 + NH3 + H2O
FeSO4 + KClO3 + H2SO4 → Fe2(SO4)3 + KCl + H2O
147.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
K2Cr2O7 + KI + H2SO4 → K2SO4 + Cr2(SO4)3 + I2 + H2O
Na2S2O3 + Cl2 + H2O → Na2SO4 + HCl + H2SO4
148.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O
Zn + KNO2 + KOH + H2O → K2[Zn(OH)4] + NH3
149.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
KNO2 + KMnO4 + H2SO4 → KNO3 + MnSO4 + K2SO4 + H2O
MnO2 + KClO3 + KOH → K2MnO4 + KCl + H2O
150.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O
KNO2 + PbO2 + HCl → KNO3 + PbCl2 + H2O
151.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
K2S + KMnO4 + H2SO4 → K2SO4 + MnSO4 + S + H2O
HgS + HNO3 + HCl → HgCl2 + S + NO + H2O
152.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
Cl2 + KOH → KClO3 + KCl + H2O
NaBr + NaBrO3 + H2SO4 → Br2 + Na2SO4 + H2O
153.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
H2S + K2Cr2O7 + H2SO4 → Cr2(SO4)3 + S + K2SO4 + H2O
HNO2 → HNO3 + NO + H2O
154.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
K2Cr2O7 + HCl → Cl2 + KCl + CrCl3 + H2O
Pb(NO3)2 → PbO + NO2 + O2
155.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
AsH3 + AgNO3 + H2O → H3AsO4 + Ag + HNO3
156.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
FeSO4 + KMnO4 + H2SO4 → MnSO4 + Fe2(SO4)3 + K2SO4 + H2O
NaI + NaIO3 + H2SO4 → I2 + Na2SO4 + H2O
157.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
MnSO4 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + PbSO4 + H2O
Sn + HNO3 → Sn(NO3)2 + N2O + H2O
158.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
H2S + HNO3 → H2SO4 + NO2 + H2O
Na2S + KMnO4 + H2SO4 → Na2SO4 + K2SO4+ MnSO4 + H2O
159.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
Na2S2O3 + Br2 + NaOH → NaBr + Na2SO4 + H2O
NaBr + MnO2 + H2SO4 → MnSO4 + Na2SO4 + Br2 + H2O
160.Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
Al + KClO4 + H2SO4 → Al2(SO4)3 + KCl + H2O
CrCl3 + Br2 + KOH → K2CrO4 + KBr + KCl + H2O
Гальванический элемент
Гальванический элемент – это устройство или система, где химическая энергия превращается в электрическую. Существует множество вариантов гальванических элементов, где суть сведена к тому, что есть два электрода, разделенные электролитом. И внутри системы происходит окислительно-восстановительная реакция.
Электрод ‑ электронно-проводящая фаза (материал), контактирующий с ионным проводником (электролитом). Переносит заряд без переноса вещества, носители заряда – электроны. В упрощенном виде электрод – это система, состоящая из металла, погруженного в раствор собственной соли (электролит) см. рис. 1.
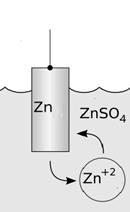
| Рис. 1. Пример электрода. Металлическая пластина (Zn) опущена в раствор соли (ZnSO4). |
На границе металл – раствор устанавливается равновесие:
Zn0 ↔ Zn2++2e‑
Электрод характеризуется электродной реакцией и стандартным электродным потенциалом (φ0). В зависимости от направления выбранной реакции будет меняться знак стандартного электродного потенциала.
Zn0 → Zn2++2e‑; φ0= + 0,76 В.
Zn2++2e‑ → Zn0; φ0= ‑ 0,76 В.
Если есть стандартный электродный потенциал, то есть и нестандартный электродный потенциал, который зависит от концентрации (давления) и температуры и определяется уравнением Нернста (при условии, что активность равна концентрации):
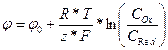 ;
;
где: φ ‑ электродный потенциал (В), φ0 – стандартный электродный потенциал (В), R – универсальная газовая постоянная (8,314 Дж/моль*К), T – абсолютная температура (К), F – постоянная Фарадея (96485,55 Кл/моль), z – число электронов, участвующих в процессе, COx и CRed – концетнрации окисленной и восстановленной форм вещества участвующего в реакции.
Электролит – это фаза (материал), которая проводит электрический ток при переносе вещества. Носителями заряда здесь являются ионы, а перенос электронов через эту фазу пренебрежимо мал. В упрощенном виде электролит – это ионпроводящее вещество. Электролитом может быть раствор, расплав или твердое вещество, отвечающее заявленным требованиям.
Гальванический элемент (химический источник тока) – система, состоящая из двух электродов, разделенных электролитом. На одном электроде будет происходить окисление (Анод), на втором – восстановление (катод).
Для работы с гальваническим элементом нужно уметь записать его схему, рассчитать его разность потенциалов (ЭДС – электродвижущую силу), определить и записать потенциал-образующую реакцию, записать уравнения электродных процессов.
Схемы гальванических элементов могут быть записаны так:
Zn|Zn2+||Cu2+|Cu
(‑) А Zn|ZnSO4||CuSO4|Cu К (+)
При записи схемы гальванического элемента руководствуются следующими правилами:
1 слева записываем того, кто окисляется, справа того – кто восстанавливается.
2 окислителем будет более электроположительный элемент (см. ряд напряжений металлов)
3 граница электрод/электролит (твердое/жидкое) обозначается одной вертикальной чертой: Zn|Zn2+; Cu2+|Cu.
4 разделение электролитов (жидкое/жидкое, мембрана, солевой мостик) – обозначается двумя вертикальными чертами: Zn2+||Cu2+; ZnSO4||CuSO4.
Дата: 2018-12-28, просмотров: 389.