ОГЛАВЛЕНИЕ
1. СТРОЕНИЕ АТОМА. ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ……………………………………………………………… 7
1.1. Основные характеристики энергетического состояния электронов в атоме. 7
1.2. Электронные формулы.. 11
1.3. Возможности определения свойств элементов. 12
2. ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ.. 13
2.1. Термодинамический метод рассмотрения химических процессов 13
2.2. Химическое равновесие. 15
2.3. Константа химического равновесия…………………………16
2.4. Принцип Ле Шателье…………………………………………17
3. КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ.. 19
3.1. Оксиды.. 19
3.2. Кислоты……………………………………………...………...20
3.3. Основания……………..………………………………………22
3.4. Соли……………………………………………………………24
4. ЭЛЕКТРОЛИТЫ ………………………………………………… 25
5. КОНЦЕНТРАЦИЯ РАСТВОРОВ……………………………….28
6. ГИДРОЛИЗ СОЛЕЙ ……………………………………………...29
7. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР)………………………………………………………………….. 30
7.1. Степень окисления Окислители и восстановители…………30
7.2. Составление уравнений окислительно-восстановительных реакций…………………………………………………………………31
8. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ……………………………35
9. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ И РАСТВОРАМИ ЩЕЛОЧЕЙ И КИСЛОТ………………………...37
9.1. Взаимодействие металлов с растворами кислот……………37
9.2. Взаимодействие металлов с водой…………………………..39
9.3. Взаимодействие металлов с водными растворами щелочей 40
10. КОРРОЗИЯ МЕТАЛЛОВ……………………………………… 41
11. ЭЛЕКТРОЛИЗ РАСТВОРОВ…………………………………..42
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ……………………………..45
Тема 1 «Строение атома»…………………………………………..... 45
Тема 2 «Закономерности химичеких процессов»………………..… 46
«Термохимия»……………………...………………………………….46
«Химичекое равновесие»………………………………..……………48 Тема 3 «Классы неорганических веществ»……………...…………..50
Тема 4 «Растворы электролитов»…………………………………….52
Тема 5 «Концентрации растворов»…………………………………..55
Тема 6. «Гидролиз солей»…………………………………………….64
Тема 7 «Окислительно-восстановительные реакции»…………...…65
Тема 8 «Гальванический элемент»…………………………………...69
Тема 9 «Взаимодействие металлов с кислотами, водой и расворами
щелочей»…………………………………………………………….…73
Тема 10 «Электрохимическая коррозия металлов»…………………76 Тема 11 «Электролиз растворов»…………………………………….78
Библиографический список.................................................................80
1. СТРОЕНИЕ АТОМА. ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ
Электронные формулы
Электронной структурой атома элемента называют распределение электронов в атоме по квантовым слоям и орбиталям. Существует два условных способа изображения электронных структур атомов: в виде электронных формул и в форме квантовых ячеек. В электронных формулах атомов элементов цифрой обозначают квантовый слой (энергетический уровень), латинской буквой – орбиталь (энергетический подуровень), надстрочным индексом – число электронов на данной орбитали. Например, электронная формула атома натрия – 11Na 1s22s22p63s1. В форме квантовых ячеек целесообразно записывать распределение валентных электронов – электронов, участвующих в образовании химической связи.
Электронные структуры атомов связаны с положением элемента в периодической системе. Периодическая система элементов является отражением Периодического закона Д. И. Менделеева, современная формулировка которого такова: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра атомов элементов.
При составлении электронных формул атомов элементов следует иметь в виду следующие положения:
· порядковый номер элемента равен общему числу электронов в атоме (сумме верхних индексов в электронной формуле), т.е. у каждого последующего элемента на один электрон больше, чем у предыдущего;
· номер периода соответствует энергетических уровней;
· номер группы, как правило, показывает число валентных электронов;
· распределение электронов по подуровням происходит в порядке возрастания их энергии.
Примеры электронных формул: 17Cl 1s22s22p63s23p5 (элемент 3-го периода, VII группы, главной подгруппы, подчеркнуты валентные электроны);
41Nb 1s22s22p63s23p63d104s24p64 d 3 5 s 2 (элемент 5-го периода, V группы, побочной подгруппы).
1.3. Возможности определения свойств элементов
Физической основой периодического изменения химических свойств элементов является периодическое повторение структуры энергетических уровней и подуровней.
Важнейшими периодически изменяющимися свойствами свободных атомов являются их радиусы, энергия ионизации и сродство к электрону (эти характеристики приводятся в справочной литературе).
Зная закономерности изменения физических и химических свойств в периодах и группах периодической системы, можно предсказать свойства: способность атомов отдавать электроны (металлы), присоединять электроны (неметаллы), реакционную способность элементов, температуру плавления, плотность и т д. Например, элементы, расположенные в Iа подгруппе, являются активными металлами, поскольку на внешнем энергетическом уровне находится один валентный электрон. В VIIа группе расположены типичные неметаллы – галогены, имеющие на внешнем энергетическом уровне семь валентных электронов.
Химическое равновесие
Самопроизвольно протекающие реакции можно разделить на два вида:
· практические необратимые реакции – идут в одном направлении, до полного расходования одного или всех реагирующих веществ: CH4+2O2 = CO2+2H2O
· обратимые реакции – протекают одновременно в двух взаимно противоположных направлениях:
H2 + I2 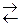 2HI
2HI
2SO2 + O2 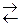 2SO3
2SO3
В результате обратимого процесса в системе устанавливается химическое равновесие. Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называют химическим равновесием.

Рисунок 2. Зависимости скорости прямой (v1) и обратной (v2) реакции от времени.
В состоянии химического равновесия концентрации всех участников реакции постоянны и не изменяются со временем, хотя прямая и обратная реакции не прекращаются. Концентрации веществ (моль/литр) в состоянии химического равновесия принято называть равновесными.
Принцип Ле Шателье
Химическое равновесие устанавливается при определенных значениях трех параметров: концентрации веществ, температуры, давления. Изменение одного из этих параметров приводит к смещению химического равновесия. Это связано с тем, что внешнее воздействие в разной степени изменяет скорость двух взаимно противоположных процессов.
Определить направление смещения состояния равновесия позволяет принцип Ле Шателье:
· если на систему, находящуюся в состоянии химического равновесия оказывают внешнее воздействие, то равновесие смещается в сторону той реакции, которая уменьшает это воздействие.
Влияние температуры
Направление смещения равновесия в результате изменения температуры определяется знаком теплового эффекта реакции:
· нагревание вызывает смещение равновесия в сторону процесса, протекание которого сопровождается поглощением теплоты, т. е. в сторону эндотермического процесса (DH > 0);
· понижение температуры приводит к смещению равновесия в сторону процесса, сопровождающегося выделением теплоты, иначе говоря, в сторону экзотермического процесса (DH < 0).
Реакция синтеза аммиака
N2(г)+3H2(г) 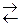 2NH3(г), DH 0х.р= – 92 кДж
2NH3(г), DH 0х.р= – 92 кДж
является экзотермической, поэтому при понижении температуры равновесие в системе смещается в сторону прямой реакции, так как этот процесс идет с выделением теплоты.
Оксиды
Оксиды – сложные вещества, состоящие из кислорода и какого-либо другого химического элемента. Степень окисления кислорода в оксидах равна -2.
|
| |||
|
| Несолеобразующие | ||
| Кислотные | Амфотерные | Основные | CO, NO, N2O, NO2 |
Кислотные оксиды – это:
1) оксиды неметаллов, которым соответствуют кислоты (например, CO2(H2CO3), SO2(H2SO3), SO3(H2SO4) и др.);
2) оксиды металлов в высокой положительной степени окисления (+5, +6, +7; например, Mn2O7, CrO3, Bi2O5 и др.).
Кислоты
Кислоты – это сложные химические соединения, диссоциирующие в растворах с образованием катионов водорода (Н+) и кислотных остатков.
|
| |
| Сильные электролиты | Слабые и средней силы электролиты |
| HCl, HBr, HJ, HNO3, H2SO4, HClO4 HMnO4, H2Cr2O7, H2CrO4, H2SеO4 | Все остальные (HF, H3PO4, H2CO3, HNO2, HClO, H2SO3, H2S и т.д., а также все органические) |
Названия часто встречающихся кислот и их солей
Кислота
Общее
Название солей
Химические свойства кислот
1. Кислоты взаимодействуют с основными оксидами, образуя соль и воду:
2HNO3 + CuO = Cu(NO3)2 + H2O
2. Взаимодействуют с основаниями, образуя соль и воду:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
3. Кислоты реагируют с солями, образуя либо более слабую кислоту, либо осадок, либо газ:
H2SO4 + 2CH3COONa = Na2SO4 + 2CH3COOH
сильная слабая
кислота кислота
H2SO4 +BaCl2 = BaSO4¯ + 2HCl
Осадок
H2SO4 +Na2S = Na2SO4 + H2S
газ
4. Кислоты реагируют с активными металлами и металлами средней активности с выделением водорода, а с H2SO4 (конц.) и HNO3 реагируют без выделения водорода (см. гл. 7 «Окислительно-восстановительные реакции (ОВР)»).
Zn + 2HCl = ZnCl2 + H2
5. Действие кислоты на индикатор:
Н+ + метилоранж ® красный цвет
Н+ + лакмус ® красный цвет
6. Разложение кислот (некоторых) при нагревании:
t
H2SO3 = SO2 + H2O
Основания
Основания – это сложные химические соединения, состоящие из катионов металла (или иона аммония NH4+) и гидроксогрупп (ОН -). Гидроксиды щелочных и щелочноземельных металлов называются щелочами. Они хорошо растворимы в воде. Остальные основания в воде практически нерастворимы, (кроме NH4ОН).
|
ОСНОВАНИЯ
| |
| Сильные электролиты | Слабые электролиты |
| Все щелочи: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 | Все остальные основания: Mg(OH)2, Cu(OH)2, Ni(OH)2, Co(OH)2, Mn(OH)2, Fe(OH)2, NH4ОН и т.д. |
Соли
Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка. Соли представляют собой продукты полного или частичного замещения ионов водорода ионами металла (или аммония) у кислот. Типы солей: средние (нормальные), кислые и основные.
Средние соли – это продукты полного замещения катионов водорода у кислот ионами металла (или аммония) : Na2CO3, NiSO4, NH4Cl и т. д.
Химические свойства средних солей :
1. Соли взаимодействуют с кислотами, щелочами и другими солями, образуя либо слабый электролит, либо осадок, либо газ:
Ba(NO3)2 + H2SO4 = BaSO4¯ + 2HNO3
Na2SO4 + Ba(OH)2 = BaSO4¯ + 2NaOH
CaCl2 + 2AgNO3 = 2AgCl¯ + Ca(NO3)2
2CH3COONa + H2SO4 = Na2SO4 + 2CH3COOH
слабая
кислота
NiSO4 + 2KOH = Ni(OH)2¯ + K2SO4
слабое
основание
NH4NO3 + NaOH = NH3 + H2O + NaNO3
газ
2. Соли взаимодействуют с более активными металлами. Более активный металл вытесняет менее активный из раствора соли (приложение 1 Табл. 1. 5.).
Zn + CuSO4 = ZnSO4 + Cu
Кислые соли – это продукты неполного замещения катионов водорода у кислот ионами металла (или аммония): NaHCO3, NaH2PO4, Na2HPO4 и т. д. Кислые соли могут быть образованы только многоосновными кислотами. Практически все кислые соли хорошо растворимы в воде.
Получение кислых солей и перевод их в средние:
1. Кислые соли получают при взаимодействии избытка кислоты или кислотного оксида с основанием:
H2CO3 + NaOH = NaHCO3 + H2O
CO2 + NaOH = NaHCO3
2. При взаимодействии избытка кислоты с основным оксидом:
2H2CO3 + CaO = Ca(HCO3)2 + H2O
3. Кислые соли получают из средних солей, добавляя кислоту:
· одноименную
Na2SO3 + H2SO3 = 2NaHSO3 ;
· другую
Na2SO3 + HCl = NaHSO3 + NaCl
4. Кислые соли переводят в средние, используя щелочь:
NaHCO3 + NaOH = Na2CO3 + H2O
Основные соли – это продукты неполного замещения гидроксогрупп (ОН-) основания кислотным остатком: MgOHCl, AlOHSO4 и т.д. Основные соли могут быть образованы только слабыми основаниями многовалентных металлов. Эти соли, как правило, труднорастворимы.
Получение основных солей и перевод их в средние:
1. Основные соли получают при взаимодействии избытка основания с кислотой или кислотным оксидом:
Mg(OH)2 + HCl = MgOHCl¯ + H2O
гидроксо-
хлорид магния
Fe(OH)3 + SO3 = FeOHSO4¯ + H2O
гидроксо-
сульфат железа (III)
2. Основные соли образуются из средней соли при добавлении недостатка щелочи:
Fe2(SO4)3 + 2NaOH = 2FeOHSO4 + Na2SO4
3. Основные соли переводят в средние, добавляя кислоту (лучше ту, которая соответствует соли):
MgOHCl + HCl = MgCl2 + H2O
2MgOHCl + H2SO4 = MgCl2 +MgSO4 + 2H2O
ЭЛЕКТРОЛИТЫ
Электролиты – это вещества, распадающиеся на ионы в растворе под влиянием полярных молекул растворителя (Н2О). По способности к диссоциации (распаду на ионы) электролиты условно делят на сильные и слабые. Сильные электролиты диссоциируют практически полностью (в разбавленных растворах), а слабые распадаются на ионы лишь частично.
К сильным электролитам относятся:
· сильные кислоты ;
· сильные основания – щелочи ;
· практически все растворимые соли.
К слабым электролитам относятся:
· слабые кислоты ;
· основания – не щелочи;
· Н2О.
Одной из основных характеристик слабого электролита является константа диссоциации – К. Например, для одноосновной кислоты,
HA Û H+ + A- ,
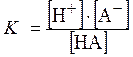 ,
,
где [H+] – равновесная концентрация ионов H+;
[A-] – равновесная концентрация анионов кислоты А-;
[HA] – равновесная концентрация молекул кислоты,
Для слабого основания
MOH Û M+ + OH- ,
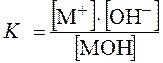 ,
,
где [M+] – равновесная концентрация катионов M+;
[OH-] – равновесная концентрация гидроксид ионов ОН-;
[MOH] – равновесная концентрация молекул слабого основания.
Константы диссоциации некоторых слабых электролитов (при t = 25 °С)
| Вещество | К | Вещество | К |
| 1 | 2 | 3 | 4 |
| HCOOH | K = 1,8×10-4 | H3PO4 | K1 = 7,5×10-3 |
| CH3COOH | K = 1,8×10-5 | K2 = 6,3×10-8 | |
| HCN | K = 7,9×10-10 | K3 = 1,3×10-12 | |
| H2CO3 | K1 = 4,4×10-7 K2 = 4,8×10-11 | HClO H3BO3 | K = 2,9×10-8 K1 = 5,8×10-10 |
| 1 | 2 | 3 | 4 |
| HF | K = 6,6×10-4 | K2 = 1,8×10-13 | |
| HNO2 | K = 4,0×10-4 | K3 = 1,6×10-14 | |
| H2SO3 | K1 = 1,7×10-2 | H2O | K = 1,8×10-16 |
| K2 = 6,3×10-8 | NH3× H2O | K = 1,8×10-5 | |
| H2S | K1 = 1,1×10-7 | Al(OH)3 | K3 = 1,4×10-9 |
| K2 = 1,0×10-14 | Zn(OH)2 | K1 = 4,4×10-5 | |
| H2SiO3 | K1 = 1,3×10-10 | K2 = 1,5×10-9 | |
| K2 = 1,6×10-12 | Cd(OH)2 | K2 = 5,0×10-3 | |
| Fe(OH)2 | K2 = 1,3×10-4 | Cr(OH)3 | K3 = 1,0×10-10 |
| Fe(OH)3 | K2 = 1,8×10-11 | Ag(OH) | K = 1,1×10-4 |
| K3 = 1,3×10-12 | Pb(OH)2 | K1 = 9,6×10-4 | |
| Cu(OH)2 | K2 = 3,4×10-7 | K2 = 3,0×10-8 | |
| Ni(OH)2 | K2 = 2,5×10-5 |
Правила составления уравнений диссоциации электролитов:
1. При диссоциации сильных электролитов ставится знак « = » (равенства) или « ® » (одна стрелочка). Этот знак обозначает полную диссоциацию.
2. При диссоциации слабых ( и средней силы) электролитов используется знак « Û » (обратимости). Этот знак обозначает частичную диссоциацию.
Правила написания ионных уравнений:
На ионы расписываются:
1.) сильные кислоты;
2.) щелочи;
3.) растворимые соли.
| Сильные электролиты | Слабые электролиты |
| Основания: Са(OH)2 = Ca2+ + 2OH- Кислоты: HCl = H++Cl- Соли: Na2CO3=2Na++CO32- | Основания: Fe(OH)2 ÛFeOH+ + OH- I ступень FeOH+ÛFe2++OH- II ступень |
| Сильные электролиты | Слабые электролиты |
| KH2PO4=K++H2PO4- анион слабой кислоты H2PO4-ÛH++HPO42- HPO42-ÛH++PO43- AlOHCl2ÛAlOHCl2 = AlOH2++2Cl- осадок растворимая катион слабого часть основания AlOH2+ÛAl3++OH- | Кислоты:
H2CO3ÛH++HCO3- I ступень
HCO3-ÛH++CO32- II ступень
Амфотерные гидроксиды:
1.  Zn(OH)2ÛZnOH++OH- по осн. Zn(OH)2ÛZnOH++OH- по осн.
 ZnOH+ÛZn2++OH- типу
2. H2ZnO2ÛH++HZnO2- по кисл. HZnO2-ÛH++ZnO22- типу
Вода:
H2OÛH++OH- ZnOH+ÛZn2++OH- типу
2. H2ZnO2ÛH++HZnO2- по кисл. HZnO2-ÛH++ZnO22- типу
Вода:
H2OÛH++OH-
|
КОНЦЕНТРАЦИЯ РАСТВОРОВ
Важнейшей характеристикой количественного содержания компонентов в системе является концентрация растворов.
Концентрацией растворов называют определенное массовое (или объемное) содержание растворенного вещества в определенном массовом (или объемном) количестве растворителя или раствора.
Существуют несколько методов выражения концентрации растворов. Рассмотрим самые распространенные из них.
Массовая доля растворенного вещества – это отношение массы растворенного вещества к общей массе раствора:
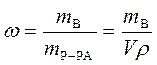 ,
,
где w - массовая доля растворенного вещества, безразмерная величина;
mВ - масса растворенного вещества, г;
mР-РА - масса раствора, г;
V - объем раствора, мл;
ρ - плотность раствора, г/мл.
Процентная концентрация:

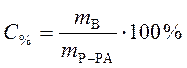 ,
,
где С% - процентная концентрация, %;
mВ - масса растворенного вещества, г;
mР-РА - масса раствора, г.
Молярная концентрация, или молярность, – число молей растворенного вещества в 1 дм3 (1 литр) раствора:
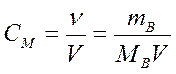 ,
,
где СМ – молярная концентрация, или молярность (иногда обозначают М);
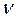 - количество (число моль) растворенного вещества, моль;
- количество (число моль) растворенного вещества, моль;
mВ - масса растворенного вещества, г;
МВ - молярная масса растворенного вещества, г/моль;
V - объем раствора, дм3 (л).
ГИДРОЛИЗ СОЛЕЙ
Гидролиз – это процесс взаимодействия соли с водой, в результате которого происходит смещение ионного равновесия воды и изменение значения рН раствора. Возможность и характер протекания гидролиза определяется природой основания и кислоты, образующих соль.
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются. Их водные растворы нейтральны.
KNO3+H2O ¹; pH=7.
В гидролизе участвуют ионы слабого основания и/или слабой кислоты.
Гидролиз солей, образованных сильной кислотой и слабым основанием, например NH4Cl:
NH4Cl = NH4++Cl-
Гидролизу подвергается катион слабого основания NH4+:
NH4+ + HOH Û NH4OH + H+ (ионы H+ в избытке).
Молекулярное уравнение:
NH4Cl + H2O Û NH4OH + HCl – кислая среда (рН < 7).
Гидролиз солей, образованных слабой кислотой и сильным основанием, например Na2SO3:
Na2SO3 = 2Na+ + SO32-
Гидролизу подвергается анион слабой кислоты SO32-:
1-я ступень: SO32-+HOH Û HSO3-+OH- (ионы OH- в избытке).
Молекулярное уравнение 1-й ступени:
Na2SO3 + H2O Û NaHSO3 + NaOH – щелочная среда (рН > 7).
При обычных условиях гидролиз протекает главным образом по первой ступени.
Гидролиз солей, образованных слабым основанием и слабой кислотой, Например (NH4)2CO3, Al2S3 и т. д. Гидролиз соли происходит как по катиону, так и по аниону. В этом случае гидролиз соли протекает до конца: в уравнении происходит замена знака «Û» на «=», а рН среды определяется силой кислоты и основания:
NH4ClO = NH4+ + ClO-
NH4+ + ClO- + HOH = NH4OH + HClO
NH4ClO + H2O = NH4OH + HClO
K (HClO) = 3×10-8 < K (NH4OH) = 1,8×10-5, так как основание является более сильным электролитом, чем кислота. Среда слабощелочная рН > 7.
Совместный гидролиз двух солей Если в растворе одновременно присутствуют ионы, связывающие Н+ и ОН-, то в соответствии с принципом Ле Шателье равновесие смещается в сторону усиления процесса гидролиза. Гидролиз может протекать необратимо с образованием малорастворимого и газообразного веществ.
В качестве примера можно рассмотреть совместный гидролиз следующих солей:
Al2(SO4)3 + K2S + H2O ®
2Al3+ + 3S2- + 6H2O = 2Al(OH)3 + 3H2S
Al2(SO4)3 + 3K2S + 6H2O = 2Al(OH)3¯ + 3H2S + 3К2SO4, pH » 7
7. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ (ОВР)
Окислительно-восстановительными называются реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ. Например:
+4 -1 +2 0
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
ОВР в нейтральной среде
В нейтральной среде применяются правила уравнивания атомов кислорода для кислой и щелочной среды. Эти правила используют так, чтобы в левых частях обеих полуреакций получились молекулы воды, а в правых – ионы Н+ и ОН-. Это возможно, если недостающие атомы кислорода в левой части полуреакций восполнять молекулами воды, а недостающие атомы кислорода в правой части задавать удвоенным числом ОН--групп.
Сказанное выше можно представить в виде таблицы:
Правила использования среды
| Процессы | Среда в окислительно-восстановительных реакциях в расчете на «О2– »в соединении | ||
| кислая (Н+) | щелочная (ОН-) | нейтральная (Н2О) | |
| Связывание «О2– » NO3–® NO2– | О2– + 2Н+ = Н2О | О2– + Н2О = 2ОН– | О2– + Н2О = 2ОН– |
| Ввод «О2–» SO32– ® SO42– | Н2О = О2– + 2Н+ | 2ОН – = О2– + Н2О | Н2О = О2– + 2Н+ |
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
На границе металл-раствор возникает электрохимический потенциал, называемый электродным. В данном случае металлический электрод непосредственно участвует в реакции
Me – ne 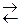 Men+ .
Men+ .
Величина потенциала зависит от природы, концентрации веществ, участвующих в электродном процессе, от температуры и находится по уравнению Нернста:
j = j0 + 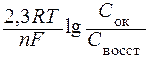 ,
,
где j 0 – стандартный потенциал, В;
R – универсальная газовая постоянная (8,31 Дж/(моль·К));
Т – абсолютная температура, К;
n – число электронов, участвующих в электродном процессе;
F – число Фарадея (96500 Кл/моль);
Сок и Свосст – произведения концентраций (активностей) веществ, моль/л, принимающих участие в соответствующей полуреакции в окисленной и восстановленной формах.
После подстановки значений R, F и T = 298 К в данную формулу электродный потенциал металла в растворе его соли можно рассчитать по формуле
j = j0 + 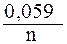 lg [Men+].
lg [Men+].
Из двух электродов, погруженных в раствор своей соли, можно составить систему, которая называется гальваническим элементом. В нем химическая энергия ОВР превращается в электрическую. Электрод, имеющий меньшее значение потенциала в конкретной паре электродов, называется анодом (–), на нем идет процесс окисления, т. е. отдачи электронов. Электрод, имеющий большее значение потенциала, называется катодом (+), на нем протекает процесс восстановления, т. е. приема электронов.
В схеме записи гальванического элемента слева принято записывать анод.
Электродвижущая сила (ЭДС) гальванического элемента – это равновесная разность потенциалов между катодом и анодом, которая всегда положительна по величине.
Пример. Рассмотрим работу и вычислим ЭДС железомедного гальванического элемента Fe / FeSO4 // CuSO4 0,01М / Cu. Вычислим электродные потенциалы и установим роль каждого из электродов.
Решение.
Поскольку концентрация раствора FeSO4 не указана, то она принимается стандартной, т. е. 1 моль/л. Тогда jFe2+/Fe = j0Fe2+/Fe = – 0,44 B (см. таблицу стандартных потенциалов в приложении 1 табл. 1. 5.).
Для расчета электродного потенциала медного электрода воспользуемся уравнением Нернста:
jCu2+/Cu = j0 Cu2+/Cu + 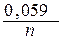 lg [Cu2+] = 0,34 +
lg [Cu2+] = 0,34 +  lg0,01 = 0,34 – 0,059 = 0,281 B.
lg0,01 = 0,34 – 0,059 = 0,281 B.
Сравнивая величины электродных потенциалов, выясняем, что медный электрод является катодом, а железный – анодом (jк > jа).
На аноде идет процесс окисления:
А (-): Fe0 – 2ē = Fe2+.
На катоде идет процесс восстановления:
К(+): Cu2+ + 2ē = Cu0.
Кислотой
В концентрированной серной кислоте окислителем является S+6, поэтому ни один металл из концентрированной H2SO4 водород (H2) не вытесняет. Продукты реакции зависят от активности металла.
Предлагается схема взаимодействия H2SO4 конц с металлами разной активности.
–2
  акт. Me акт. Me
| соль + H2O + H2S↑ | |
| +6 | cр. акт. Me | |
 Me0 + H2SO4 конц. Me0 + H2SO4 конц.
| 
| соль + H2O + S0↓ |
| Red Ox | мало акт. Me | +4 |

| соль + H2O + SO2↑ | |
Ряд активности металлов можно разбить на следующие группы:
1) активные металлы - [Li…Al]
2) металлы средней активности [Mn…Pb]
3) малоактивные металлы [Cu…Au]
КОРРОЗИЯ МЕТАЛЛОВ
Коррозия металлов – самопроизвольный окислительно-восстановительный процесс разрушения металла под действием окружающей среды.
|
Коррозия
| |
 Химическая
Возникает в отсутствии электролита:
2Fe + 3Cl2 = 2FeCl3
4Al + 3O2 = 2Al2O3 Химическая
Возникает в отсутствии электролита:
2Fe + 3Cl2 = 2FeCl3
4Al + 3O2 = 2Al2O3
| Электрохимическая Происходит в присутствии электролита и сопровождается возникновением микротоков в микрогальваноэлементах |
Пример Рассмотрим электрохимическую коррозию, происходящую при контакте цинка с медью в щелочном растворе в присутствии кислорода:
| Zn | Cu |
| NaOH + H2O + O2 | |
|
| |
Выписываем окислительно-восстановительные потенциалы обоих металлов в щелочной среде по таблице «Стандартных окислительно-восстановительные потенциалов ряда металлов».
j(ZnO22-/Zn) = -1,22 В, j(Cu(OH)2/Cu) = -0,22 В.
Определяем по потенциалам более активный металл – Zn. Цинк разрушается в первую очередь, является восстановителем:
Zn0 – 2e + 4OH- ® ZnO22- + 2H2O.
Второй металл (Cu) не разрушается, он является проводником электронов:
 е
е
 Zn Zn
| Cu |
| NaOH + H2O + O2 | |
Окислителем в данном примере может быть O2 и H2O. Выписываем потенциалы окислителей для щелочной среды из таблицы «Стандартных окислительно-восстановительные потенциалов ряда металлов»:
 j(2Н2О/Н2) = -0,83 В
j(2Н2О/Н2) = -0,83 В
j(О2/4OH-) > j(2Н2О/Н2).
j(О2/4OH-) = +0,40 В
Окислитель выбираем с большим потенциалом (О2).
Процесс восстановления кислорода происходит на меди:
на Cu : O2 + 4e + 2H2O ® 4OH-
Суммарный процесс при коррозии латуни в щелочной среде в присутствии кислорода записываем в следующей форме:
| 2 | Zn0 – 2e + 4OH- ® ZnO22- + 2H2O |
| На Cu: 1 | O2 + 4e + 2H2O ® 4OH- |
| 2Zn0 + 8OH- + O2 + 2H2O ® 2ZnO22- + 4H2O + 4OH- | |
| 2Zn + 4OH- + O2 ® 2ZnO22- + 2H2O | |
Молекулярное уравнение коррозии:
2Zn + 4NaOH + O2 ® 2Na2ZnO2 + 2H2O
Более активный металл Zn – анод, Cu – катод:
 е
е
 (А) - Zn (А) - Zn
| Cu + (К) |
| NaOH + H2O + O2 | |
ЭЛЕКТРОЛИЗ РАСТВОРОВ
Электролиз – это совокупность окислительно-восстановительных процессов, происходящих при прохождении электрического тока через электрохимическую систему, состоящую из двух электродов и электролита.
Электрохимия открыла принципиально новые и чрезвычайно перспективные методы получения многих веществ. При электролизе расплавов получают щелочные и щелочноземельные металлы, алюминий, бериллий, магний.
В связи с растущей потребностью в жаростойких и сверхпрочных материалах важное значение приобретает получение порошков чистых тугоплавких металлов (вольфрама, молибдена, титана, циркония, ванадия, тантала, ниобия и др.) в результате электролиза расплава соответствующих веществ.
Современная техника предъявляет большие требования к чистоте материалов, в частности металлов. В цветной металлургии для очистки металлов от примесей применяют электролиз с растворимым анодом. Электролитическому рафинированию подвергают железо, медь, серебро, золото, свинец, олово, никель и другие металлы.
Важнейшая область прикладной электрохимии – гальванотехника, которая объединяет два направления: гальваностегию – получение гальванических покрытий на металлах и гальванопластику – электрохимическое получение точных металлических копий с рельефных поверхностей. Гальванопластика используется для нанесения металлических рисунков на полупроводники и непроводящие покрытия (например, в производстве печатных радиосхем для миниатюрных радиоприемников).
Гальванические покрытия наносят для защиты металлов от коррозии, а также в декоративных и специальных целях (увеличение отражательной способности волноводов и рефлекторов, уменьшение сопротивления электрических контактов). Покрытие осуществляют электролизом растворов как с растворимым анодом (никелирование, кадмирование, цинкование, лужение, серебрение), так и с нерастворимым (хромирование, золочение). Покрываемое изделие всегда является катодом.
Катодом называют электрод, на котором происходит восстановление; он заряжен отрицательно. Электрод, на котором происходит окисление, называется анодом; он заряжен положительно.
При электролизе водных растворов протекают процессы, связанные с электролизом воды (растворителя).
Катодные процессы
На катоде возможно восстановление:
· катионов металла Меn+ + nē = Me ;
· катиона водорода (свободного или в составе молекул воды).
2H+ + 2ē = H 2 ( в кислой среде) ;
2H2O + 2ē =H 2+ 2 OH – ( в нейтральной и щелочной средах).
Для выбора приоритетного процесса следует сравнить стандартные электродные потенциалы металла и водорода. Потенциал восстановления катионов водорода необходимо использовать с учетом перенапряжении: 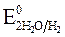 » - 1 В, т.е. потенциал выделения водорода на катоде гораздо более отрицательный, чем равновесный потенциал, отвечающий рН данного раствора.
» - 1 В, т.е. потенциал выделения водорода на катоде гораздо более отрицательный, чем равновесный потенциал, отвечающий рН данного раствора.
Перенапряжением называют сдвиг потенциала электрода от данного равновесного значения, вызванный замедленностью электрохимической реакции разряда или образования ионов при данной плотности тока.
Перенапряжение водорода очень сильно зависит от природы катода и состояния его поверхности. Самым незначительным оказывается перенапряжение водорода на гладкой платине. При выделении металлов на катоде, как правило, перенапряжение невелико.
Все металлы по своему поведению при электролизе водных растворов можно разделить на 3 группы:
1. Активные металлы (Li - Al) из-за низкой окислительной способности их ионов на катоде не осаждаются, вместо них идет восстановление ионов водорода.
2. Металлы средней активности (Mn, Zn, Fe, Sn) могут осаждаться на катоде с одновременным выделением водорода.
3. Неактивные металлы (стоящие в ряду напряжений после водорода) из-за высокой окислительной способности их ионов осаждаются на катоде без выделения водорода.
Анодные процессы
На аноде возможны процессы окисления:
· материала анода Ме - nē = Men+;
· молекул воды 2H2O - 4ē =О 2+ 4H+ ;
· анионов солей 2Cl - - 2ē = Cl2; NO2- - 2ē + H2O = NO3- + 2H+.
Анионы кислородосодержащих кислот, имеющие в своем составе атом элемента в высшей степени окисления (SO4 2-, NO3- и др.), при электролизе водных растворов на аноде не разряжаются. С учетом перенапряжения величину потенциала выделения кислорода нужно считать равной 1,8 В.
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
Тема 1 Строение атома
Задание 1. Напишите электронные формулы атомов и ионов. Укажите валентные электроны атомов.
Задание 2. Распределите по квантовым ячейкам валентные электроны и определите какой это элемент.
Задание 3. Укажите значение главного и орбитального (побочного) квантовых чисел для подуровней
| Номер варианта | Задание 1 | Задание 2 | Задание 3 |
| 1 | Ag, Ba2+ | 2s22p2 | 2p |
| 2 | As, Ti4+ | 2s22p6 | 4f |
| 3 | Sr, In3+ | 3s23p3 | 3d |
| 4 | Xe, Br- | 3s2 | 3s |
| 5 | Cs, Ga3+ | 2s22p1 | 4p |
| 6 | F, Mg2+ | 3s23p1 | 5d |
| 7 | S, Li+ | 6s2 | 4s |
| 8 | N, S2- | 5s25p3 | 3p |
| 9 | Ne, Al3+ | 5s25p2 | 4d |
| 10 | Si, Na+ | 4s23d2 | 5p |
| 11 | O, I - | 5s24d2 | 5s |
| 12 | P, F- | 4s13d10 | 5f |
| 13 | Mg, Ar | 6s25d2 | 2s |
| 14 | K, S2- | 6s25d5 | 1s |
| 15 | Ca, Cl- | 6s26p3 | 5d |
| 16 | Al, Te2- | 5s25p1 | 1s |
| 17 | C, K+ | 6s25d4 | 6d |
| 18 | Se, Be2+ | 5s25p6 | 5f |
| 19 | Mn, Se2- | 6s15d10 | 7s |
| 20 | Cl, Si4+ | 5s14d10 | 4p |
| 21 | Si, Ge4+ | 5s25p4 | 5s |
| 22 | Na, B3+ | 6s26p6 | 6s |
| 23 | Zn, Hg2+ | 3s23p5 | 2p |
| 24 | Ar, Zn2+ | 2s22p2 | 3d |
| 25 | He, Hf | 3s23p3 | 2s |
| 26 | B, Y3+ | 3s23p1 | 3p |
| Номер варианта | Задание 1. | Задание 2. | Задание 3 |
| 27 | Au, P5+ | 3s23p6 | 4s |
| 28 | Cd, Br- | 2s22p4 | 4f |
| 29 | Ne, Sn2+ | 3s23p5 | 1s |
| 30 | At, Cr3+ | 4s1 | 5d |
Пример решения и оформления задания раздела 1.
1. Пример. Напишите электронные формулы атомов и ионов. Подчеркните валентные электроны.
4Ве: 1s22s2
9F–: 1s22s22p6.
2. Пример. Распределите по квантовым ячейкам валентные электроны и определите какой это элемент.
1s22s22p4 – это кислород 8O (8-й порядковый номер)

3. Пример. Укажите значение главного и орбитального (побочного) квантовых чисел для подуровней.
6d: n = 6
l = 2
Тема 2. Закономерности химических процессов
Термохимия
Задание 1. Приведите значение теплового эффекта реакции при стандартных условиях, укажите – это экзо- или эндотермическая реакция, (см. таблицу «термодинамических величин» в приложении).
Задание 2. Определите температуру, при которой устанавливается химическое равновесие реакции (см. таблицу «термодинамических величин» в приложении).
Задание 3. Сделайте вывод о возможности протекания данной реакции при стандартных условиях и при температуре 1500 К.
| Номер варианта | Реакция |
| 1 | 2SO2(г)+O2(г)Û2SO3(г) |
| 2 | 4NH3(г)+5O2(г)Û4NO(г)+6H2O(ж) |
| 3 | CO2(г)+C(графит)Û2CO2(г) |
| 4 | 4NO(г)Û2N2O(г)+O2(г) |
| 5 | CH4(г)ÛC(графит)+2H2(г) |
| 6 | CaO(тв)+H2(г)ÛCa(тв)+H2O(г) |
| 7 | 4HCl(г)+O2(г)Û2H2O(г)+2Cl2(г) |
| 8 | N2(г)+3H2(г)Û2NH3(г) |
| 9 | 2HNO3(г)ÛH2(г)+N2(г)+3O2(г) |
| 10 | 2N2(г)+O2(г)Û2N2O(г) |
| 11. | C(графит)+H2O(г)ÛCO(г)+H2(г) |
| 12 | CO(г)+H2O(г)ÛCO2(г)+H2(г) |
| 13 | 2Ag2O(тв)Û4Ag(тв)+O2(г) |
| 14 | SiF4(г)ÛSi(тв)+2F2(г) |
| 15 | 2CO(г)+O2(г)Û2CO2(г) |
| 16 | 3S(тв)+2H2O(ж)ÛSO2(г)+2H2S(г) |
| 17 | SO2(г)+NO2(г)ÛSO3(г)+NO(г) |
| 18 | C(графит)+2F2(г)ÛCF4(г) |
| 19 | 2H2S(г)+O2(г)Û2S(тв)+2H2O(г) |
| 20 | Cl2(г)+2O2(г)Û2ClO2(г) |
| 21 | 2H2(г)+O2(г)Û2H2O(г) |
| 22 | 2NO2(г)Û2NO(г)+O2(г) |
| 23 | O2(г)+2F2(г)Û2OF2(г) |
| 24 | H2S(г)+Cl2(г)Û2HCl(г)+S(тв) |
| 25 | CO(г)+H2(г)ÛC(графит) + H2O(г) |
| 26 | SO2(г)+2H2S(г)Û3S(тв)+2H2O(ж) |
| 27 | С(алмаз)+H2O(г)ÛCO(г)+H2(г) |
| 28 | 2N2O(г)+O2(г)Û4NO(г) |
| 29 | Si(тв)+3F2(г)ÛSiF6(г) |
| 30 | CO(г)+Cl2(г)ÛCOCl2(г) |
Пример решения и оформления задания раздела
Пример. Вычислить стандартные изменения энтальпии, энтропии, энергии Гиббса в реакции CO2(г) + С (графит) = 2CO(г). Определить температуру, при которой устанавливается химическое равновесие реакции, и сделать вывод о возможности протекания реакции в прямом направлении.
Решение :
· Производим расчет стандартного изменения энтальпии реакции по следствию из закона Гесса:
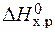 = å (n
= å (n 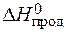 ) – å (m
) – å (m 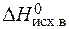 ) = 2
) = 2 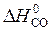 – (
– ( 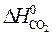 +
+ 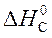 ) =
) =
= 2×(–110,5) – (–393,5 + 0) = 172,5 кДж.
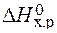 >0 – эндотермическая реакция.
>0 – эндотермическая реакция.
· Стандартное изменение энтропии реакции также определяем по следствию из закона Гесса:
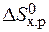 = å (n
= å (n 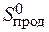 ) – å (m
) – å (m 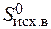 ) = 2
) = 2 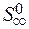 – (
– ( 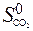 +
+ 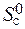 ) = 2× 197,5 – (213,7 + 5,7) = 175,6 Дж/К = 176,5×10-3 кДж/К.
) = 2× 197,5 – (213,7 + 5,7) = 175,6 Дж/К = 176,5×10-3 кДж/К.
· Стандартное изменение энергии Гиббса реакции равно:
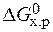 =
= 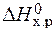 – Т×
– Т× 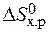 = 172,5 –298×176,5×10-3 = 120,2 кДж.
= 172,5 –298×176,5×10-3 = 120,2 кДж.
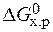 > 0, при Т = 298К прямая реакция невозможна.
> 0, при Т = 298К прямая реакция невозможна.
· Определим температуру, при которой устанавливается химическое равновесие.
Если пренебречь зависимостями DН и DS от температуры и считать их постоянными, можно рассчитать энергию Гиббса при нестандартной температуре Т: DG = DН – Т×DS » 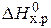 – Т×
– Т× 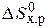
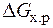 =
= 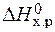 – Т×
– Т× 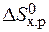 = 0 Þ Т =
= 0 Þ Т = 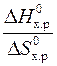 =
= 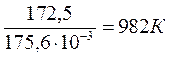 .
.
Химическое равновесие
Задание 1. Напишите математическое выражение Кс (константы химического равновесия) для обратимых реакций.
Задание 2. Укажите направление смещения равновесия при изменении условий:
а) при увеличении парциального давления одного из исходных газообразных веществ;
б) понижении давления;
в) повышении температуры.
| Номер варианта | Уравнение реакции | DН0, кДж/моль |
| 1 | 2N2O (г) + O2 (г)  4NO (г) 4NO (г)
| 196 |
| 2 | 4NH3(г) + 5 O2 (г)  4NO (г) + 6 H2O (г) 4NO (г) + 6 H2O (г)
| 908 |
| 3 | 2H2S (г) + 3 O2 (г)  2 SO2 (г) + 2 H2O (г) 2 SO2 (г) + 2 H2O (г)
| 1038 |
| 4 | CO2 (г) + H2 (г)  CO(г) + H2O(г) CO(г) + H2O(г)
| 41 |
| 5 | 2 H2 (г) + O2 (г) 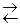 2 H2O (г) 2 H2O (г)
| – 484 |
| 6 | 2 SO2 (г) + O2(г)  2SO3(г) 2SO3(г)
| – 196 |
| 7 | 2NO (г) + O2 (г)  2 NO2 (г) 2 NO2 (г)
| – 112 |
| 8 | Fe3O4 (т) + H2 (г) 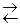 3 FeO (т) + H2O (г) 3 FeO (т) + H2O (г)
| 62 |
| 9 | FeO (т) + H2 (г)  Fe (т) + H2O (г) Fe (т) + H2O (г)
| – 272 |
| 10 | C( графит) + H2O (г) 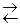 CO (г) + H2 (г) CO (г) + H2 (г)
| 131 |
| 11 | CO (г) + H2O (г)  CO2 (г) + H2(г) CO2 (г) + H2(г)
| – 41 |
| 12 | SO3 (г) + H2 (г)  SO2 (г) + H2O (г) SO2 (г) + H2O (г)
| – 144 |
| 13 | H2 (г) + Cl2 (г)  2HCl (г) 2HCl (г)
| – 184 |
| 14 | FeO (т) + CO (г)  Fe (т) + CO2 (г) Fe (т) + CO2 (г)
| – 11 |
| 15 | 2ZnS (т) + 3 O2 (г) 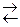 2 ZnO (т) + 2SO2 (г) 2 ZnO (т) + 2SO2 (г)
| – 878 |
| 16 | N2 (г) + 3 H2 (г)  2 NH3 (г) 2 NH3 (г)
| – 92 |
| 17 | СaCO3 (т)  СaO (т) + CO2 (г) СaO (т) + CO2 (г)
| 175 |
| 18 | 2 MgCl2 (т) + O2 (г)  2 MgO (т) + 2 Cl2 (г) 2 MgO (т) + 2 Cl2 (г)
| 82 |
| 19 | Сa(OH)2 (т)  CaO (т) + H2O (г) CaO (т) + H2O (г)
| 48 |
| 20 | H2O (г) + CO (г)  CO2 (г) + H2 (г) CO2 (г) + H2 (г)
| – 41 |
| 21 | Si(тв) +3F2(г)  SiF6(г) SiF6(г)
| 1614 |
| 22 | CO (г) + H2 (г)  C( графит) + H2O (г) C( графит) + H2O (г)
| – 131 |
| 23 | SO2 (г) + H2O (г)  SO3 (г) + H2 (г) SO3 (г) + H2 (г)
| 144 |
| 24 | MgO (т) + CO2 (г)  MgCO3 (т) MgCO3 (т)
| – 98,5 |
| 25 | СaO (т) + CO2 (г)  СaCO3 (т) СaCO3 (т)
| – 175 |
| 26 | 2 MgO (т) + 2 Cl2 (г)  2 MgCl2 (т) + O2 (г) 2 MgCl2 (т) + O2 (г)
| – 82 |
| 27 | СaO (т) + SO3 (г)  СаSO4 (т) СаSO4 (т)
| – 393,7 |
| Номер варианта | Уравнение реакции | DН0, кДж/моль |
| 28 | 2HCl (г)  H2 (г) + Cl2 (г) H2 (г) + Cl2 (г)
| 184 |
| 29 | C( графит) + 2F2 (г)  CF4 (г) CF4 (г)
| 1614 |
| 30 | Fe2O3 (т) + H2 (г)  2FeO (т) + H2O (г) 2FeO (т) + H2O (г)
| – 26 |
Пример решения и оформления задания раздела
Пример. Напишите математическое выражение Кс (константы равновесия) для обратимой реакции N2 + 3H2  2NH3; DH 0х.р = – 92 кДж и укажите направление смещения равновесия при изменении условий:
2NH3; DH 0х.р = – 92 кДж и укажите направление смещения равновесия при изменении условий:
1) при увеличении концентрации NH3;
2) при увеличении давления; 
3) при понижении температуры.
Константа равновесия записывается следующим образом:
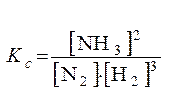
При изменении параметров равновесие смещается:
 1) с увеличением
1) с увеличением 
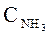 (влево) в обратном направлении;
(влево) в обратном направлении;
 2) с увеличением общего давления (вправо) в прямом направлении;
2) с увеличением общего давления (вправо) в прямом направлении;
 3) при понижении температуры (вправо) в прямом направлении.
3) при понижении температуры (вправо) в прямом направлении.
Раздела 4.
Пример 1: Приведите название солей. Напишите уравнения их диссоциации.
Al(OH)2Cl – основная соль, дигидроксохлорид алюминия.
Al(OH)2Cl → Al(OH)2Clр-р → Al(OH)+ + Cl–
осадок
Al(OH)+ Û AlOH2+ + OH–
AlOH2+Û Al3+ + OH–
NH4NO3 – средняя соль, нитрат аммония.
NH4NO3 → NH4+ + NO3–
Са(HCO3)2 – кислая соль, гидрокарбонат кальция.
Са(HCO3)2 → Са2+ + 2HCO3–
HCO3– Û H+ + CO32–
Пример 2: Осуществить превращения NаОН ® NаНSО3 ® Nа2SO3 . Решение. NаОН + Н2SO3 = NаНSO3 + Н2O
ОН– + Н2SO3 = НSО3– +Н2О
NаHSO3 +NаОН = Nа2SO3 + Н2O
НSО3– + ОН – = SO32 – + Н2О
Пример 3. Осуществить превращения Ni(ОН)2 ® (NiOH)2SO4 ® NiSO4.
Решение. 2Ni(ОH)2 + Н2SO4 = (NiOН)2SO4 + 2Н2O
2Ni(ОН)2 + 2Н+ + SO42 – = (NiОН)2SO4 + 2Н2O
(NiОН)2SO4 + Н2SO4 = 2NiSO4 + 2Н2О
(NiOН)2SO4 + 2Н+ = 2Ni 2+ + SO42– + 2Н2О
Пример 4. По ионным уравнениям реакций составить молекулярные.
Решение. 1. Са2+ + СО32– = ¯СаСО3
СаCl2 + Nа2СО3 = ¯СаСО3 + 2NаС1
Са(ОН)2 + К2СО3 = ¯СаСО3 + 2КОН
2. Сu2+ + 2OН – = ¯Сu(ОН)2
СuSO4 + 2NаОН =¯Cu(OH)2 + Nа2SO4
СuС12 + 2КОН = ¯Сu(ОН)2 + 2КС1;
3. Сu2+ + S2– = ¯СuS
СuС12 + К2S = ¯СuS + 2КС1
Сu(NO3)2 + Nа2S =¯СuS + 2NаNО3
Тема 5: «Концентрации растворов»
В соответствии с условием решить две задачи по теме «Mолярная и процентная концентрация». Если необходимо, то воспользуйтесь таблицами перевода плотности в процентную концентрацию, приведенными в приложении 1 Табл 1.4.
При решении задач необходимо обращать особое внимание на размерность применяемых величин и обязательно приводить их в соответствие друг другу. Поэтому при подстановке численных значений в формулы надо указывать размерность величин. Решение задач оформлять обязательно в соответствии с приведенными ниже примерами.
Вариант 1
1. Определите молярную концентрацию 30%-ного раствора серной кислоты.
2. К 500 мл раствора соляной кислоты (ρ = 1,10 г/мл) прибавили 2,5 л воды, после чего раствор стал 4%-ным. Определите процентное содержание растворенного вещества в исходном растворе.
Вариант 2
1. Рассчитайте массу хлорида натрия, необходимую для приготовления 12%-ного раствора.
2. Определите молярную концентрацию 10%-ного раствора азотной кислоты (ρ = 1,06 г/мл).
Вариант 3
1. Раствор глауберовой соли (Na2SO4×10H2O) приготовили взяв навеску 20 г на 1 литр воды. Определите массовую долю раствора в процентах.
2. Определите молярную концентрацию раствора сульфата калия, в 200 мл которого содержится 1,74 г растворенного вещества.
Вариант 4
1. Определите молярную концентрацию 10%-ного раствора хлорида аммония.
2. Определите процентное содержание растворенного вещества 1М раствора нитрaта никеля(II), плотность которого составляет 1,08 г/мл.
Вариант 5
1. Какова масса сульфата алюминия, взятого для приготовления 1 литра 10%-ного раствора?
2. Определите молярную концентрацию 10%-ного раствора серной кислоты (ρ = 1,07 г/мл).
Вариант 6
1. Каким объемом требуется разбавить 5М раствор KOH, чтобы достичь концентрации 1М?
2. Сколько миллилитров воды следует прибавить к 100 мл 20%-ного раствора серной кислоты (ρ = 1,14 г/мл) для получения 5%-ного раствора?
Вариант 7
1. Сколько граммов карбоната натрия нужно взять, чтобы приготовить 5 литров 10%-ного раствора?
2. В каком объеме воды следует растворить 32,2 г Na2SO4×10H2O, чтобы получить 5%-ный раствор сульфата натрия?
Вариант 8
1. Определите молярность 10%-ного раствора уксусной кислоты.
2. Определите процентное содержание растворенного вещества 0,9М раствора H3PO4 (ρ = 1,05 г/мл).
Вариант 9
1. До какого объема следует разбавить 500 мл соляной кислоты (30 %), чтобы приготовить 2,5%-ный раствор?
2. Сколько граммов медного купороса СuSO4×5H2O и воды требуется для приготовления 150 г 8%-ного раствора СuSO4 в расчете на безводную соль?
Вариант 10
1. Раствор сульфата натрия приготовили, взяв 200 г соли и 2,5 литра воды. Какова его массовая доля в процентах?
2. Определите молярную концентрацию 27%-ного раствора соляной кислоты (ρ = 1,14 г/мл).
Вариант 11
1. Какой объем 0,25М азотной кислоты необходим для нейтрализации 50 мл 0,5М раствора гидроксида калия?
2. До какого объема следует разбавить 1,5 л 20%-ного раствора хлорида аммония (ρ = 1,06 г/мл), чтобы получить 10%-ный раствор (ρ = 1,03 г/мл)?
Вариант 12
1. Какова массовая доля раствора аммиака, приготовленного растворением 2,5 л аммиака в 120 мл 15%-ного раствора аммиака?
2. Сколько миллилитров 70%-ного раствора нитрата калия (ρ = = 1,16 г/мл) требуется для приготовления 0,5 л 0,2М раствора?
Вариант 13
1. К 40 мл 20%-ного раствора гидроксида натрия добавили 400 мл воды. Определите массовую долю полученного раствора.
2. Сколько граммов кристаллической соды Na2CO3×10H2O надо взять для приготовления 2 л 0,2М раствора Na2CO3?
Вариант 1 4
1. Вычислите молярную концентрацию 12 % раствора сульфата аммония.
2. Cколько миллилитров 36%-ного раствора соляной кислоты (ρ = = 1,18 г/мл) требуется для приготовления 4 л 0,5М раствора?
Вариант 15
1. Сколько миллилитров 10%-ного раствора соляной кислоты требуется для нейтрализации 100 мл 4,5 %-ного раствора гидроксида натрия.
2. К 1 л 20%-ного раствора гидроксида натрия (ρ = 1,22 г/мл) прибавили 10 л воды. Определите процентное содержание растворенного вещества в полученном растворе.
Вариант 16
1. Определите молярную концентрацию 8%-ного раствора сульфата натрия (ρ = 1,08 г/мл).
2. Сколько миллилитров 10%-ного раствора Na2CO3 (ρ = 1,10 г/мл) следует прибавить к 1 л 2%-ного раствора (ρ = 1,02 г/мл), чтобы получить 3%-ный раствор этой соли?
Вариант 17
1. Сколько миллилитров 15%-ного раствора серной кислоты потребуется для нейтрализации 50 мл 2,5М раствора NaOH?
2. Определите процентное содержание растворенного вещества в 2М растворе гидроксида натрия (ρ = 1,08 г/мл).
Вариант 18
1. Сколько миллилитров 30%-ного раствора азотной кислоты нужно для приготовления 500 мл 12%-ного раствора?
2. Сколько миллилитров воды следует прибавить к 25 мл 40%-ного раствора KOH (ρ =1,40 г/мл), чтобы получить 2%-ный раствор?
Вариант 1 9
1. Определите процентную концентрацию 0,25М раствора хлорида кальция.
2. Сколько миллилитров 96 %-ного раствора серной кислоты (ρ = = 1,84 г/мл) требуется для приготовления 300 мл 0,5М раствора?
Вариант 20
1. Вычислите массовую долю раствора фосфорной кислоты, полученной в результате взаимодействия 71 г оксида фосфора (P2O5) и 600 мл воды.
2. Сколько граммов медного купороса СuSO4 ×5H2O следует добавить к 150 мл воды, чтобы получить 5%-ный раствор СuSO4?
Вариант 21
1. Сколько миллилитров 0,2М раствора карбоната натрия требуется для осаждения карбоната кальция из раствора CaCl2 0,02М?
2. Сколько миллилитров 30%-ного раствора азотной кислоты (ρ = = 1,84 г/мл) требуется для приготовления 250 мл 0,5М раствора?
Вариант 22
1. Определите массовую долю 1М раствора нитрата никеля.
2. Определите процентное содержание растворенного вещества в 0,25М растворе гидроксида натрия (ρ = 1,01 г/мл).
Вариант 23
1. Рассчитайте, сколько граммов хлорида калия потребуется для приготовления 2,5 литров 0,5 М раствора.
2. Сколько миллилитров 0,1М раствора HCl можно приготовить из 20 мл 0,5М раствора этой кислоты?
Вариант 24
1. Определите, какова была молярная концентрация раствора сульфата меди, если для осаждения ее гидроксида потребовалось 2 литра 0,5М раствора гидроксида натрия.
2. Определите молярную концентрацию 10%-ного раствора соляной кислоты (ρ = 1,05 г/мл).
Вариант 25
1. Сколько потребуется 4М раствора соляной кислоты, чтобы при взаимодействии с карбонатом кальция получить 4,5 л углекислого газа (н.у.)?
2. Сколько миллилитров 30%-ной азотной кислоты с ρ= 1,18 г/мл требуется для приготовления 250 мл 11%-ного раствора (ρ = = 1,07 г/мл)?
Вариант 26
1. Сколько граммов кристаллической соды Na2CO3×10H2O надо взять для приготовления 2 л 0,2М раствора Na2CO3.
2. Сколько миллилитров 30%-ного раствора KOH (ρ = 1,29 г/мл) требуется для приготовления 300 мл 0,1М раствора?
Вариант 27
1. Определите молярность 0,8%-ного раствора сульфата никеля.
2. К 760 мл 20%-ного раствора NaOH (ρ = 1,22 г/мл) прибавили 140 мл 10%-ного раствора NaOH (ρ = 1,11 г/мл). Определите процентное содержание растворенного вещества.
Вариант 28
1. Какова массовая доля гидроксида кальция, полученного растворением 1 г оксида кальция в 200 мл воды?
2. К 50 мл 96%-ного раствора серной кислоты (ρ = 1,84 г/мл) прибавили 50 мл воды. Определите процентное содержание растворенного вещества в полученном растворе.
Вариант 29
1. Вычислите молярность сульфата цинка (10 %).
2. Определите молярную концентрацию 72%-ного раствора азотной кислоты (ρ = 1,43 г/мл).
Вариант 30
1. Сколько миллилитров 96%-ной серной кислоты следует взять, чтобы приготовить 2 литра 4%-ного раствора.
2. Определите молярную концентрацию 6%-ного раствора фосфорной кис-лоты (ρ = 1,03 г/мл).
Примеры решения типичных задач к разделу 5.
Пример 1. Задача на разбавление
Какой объем 95%-ного раствора серной кислоты (r = 1,84 г/мл) надо взять для приготовления 400 г 10%-ного раствора кислоты? Приготовление раствора означает, что концентрированный раствор разбавляют водой. При этом остается неизменной масса растворенного вещества.
Кратко запишем условия задачи, обозначив параметры исходного раствора с индексом 1, приготовляемого раствора с индексом 2.
 Дано: Решение:
Дано: Решение:
С% 1=95% Из выражения для процентной концентрации r 1 =1,84 г/мл приготовляемого раствора выразим необходимую
m2 Р-РА=400 г массу растворенного вещества (серной кислоты):
 C % 2=10%
C % 2=10% 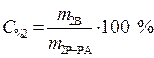
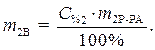 (1)
(1)
Найти: V1=? Определяем массу серной кислоты (m1В) в исход- ном растворе:
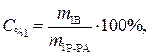 так как m1Р-РА= V1ρ1, то
так как m1Р-РА= V1ρ1, то
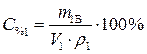
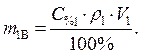 (2)
(2)
Поскольку m1В = m2В, то приравниваем выражения (1) и (2).
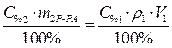
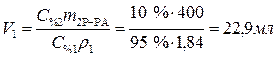
Ответ: Объем 95%-ного раствора серной кислоты равен 22,9 мл.
Пример 2. Задача с расчетом по уравнению химической реакции
Какая масса 25%-ного раствора гидроксида калия расходуется на нейтрализацию 75 г 15%-ного раствора уксусной кислоты?
Обозначим параметры, относящиеся к уксусной кислоте, индексом 1, гидроксиду калия – индексом 2.
 Дано: Решение
Дано: Решение
C % 1= 15% Уравнение реакции нейтрализации:
m1 Р-РА=75 г СH3COOH + KOH = CH3 COOK + H2O
C % 2= 25% Рассчитаем массу растворенного вещества,
содержащегося в растворе уксусной кислоты: 
Найти: m 2Р-РА=?
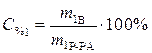 ,
, 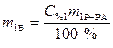 .
.
Определяем количество вещества (уксусной кислоты), содержащееся в растворе:
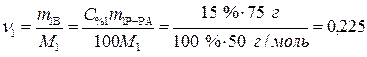 моль
моль
По уравнению реакции 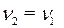 . Рассчитаем
. Рассчитаем 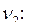
n2 = n1 = 0,225 моль.
Найдем массу растворенного вещества, содержащегося в растворе гидроксида калия:
m2B = M2n2 = 56 г/моль·0,225 моль = 12,6 г.
Определяем массу раствора гидроксида калия, содержащего данное количество растворенного вещества – гидроксида калия:
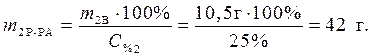
Ответ: 42 г – масса раствора гидроксида калия, которая расходуется на реакцию с уксусной кислотой.
Пример 3. Задача на приготовление раствора соли из кристаллогидрата
В 450 г воды растворили 50 г CuSO4×5H2O. Вычислить процентное содержание кристаллогидрата (CuSO4×5H2O) и безводной соли (CuSO4) в растворе.
Обозначим параметры раствора кристаллогидрата индексом 1, а раствора безводной соли с индексом 2.
 Дано: Решение
Дано: Решение
 = 450 г Найдем общую массу раствора:
= 450 г Найдем общую массу раствора:
 m1В = 50 г mР-РА= m1Р-РА= m2Р-РА= mH2O+ m1В.
m1В = 50 г mР-РА= m1Р-РА= m2Р-РА= mH2O+ m1В.
Найти: mР-РА = 450 г + 50 г = 500 г.
С% 1, С% 2 = ?
Рассчитаем процентное содержание кристаллогидрата в растворе:
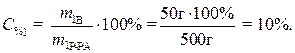
Определим массу безводной соли в растворе:
 ,
, 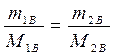 ,
, 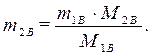
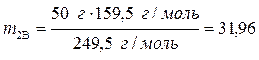 г
г
Процентное содержание безводной соли в растворе:
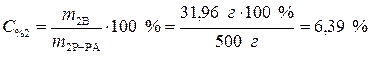
Ответ: 10% – содержание кристаллогидрата в растворе, 6,39% – содержание безводной соли в растворе.
Пример 4. Задача на расчет молярной концентрации, если известна процентная концентрация.
 Определить молярную концентрацию 36,2%-го (по массе) раствора соляной кислоты, плотность которого равна 1,18 г/мл.
Определить молярную концентрацию 36,2%-го (по массе) раствора соляной кислоты, плотность которого равна 1,18 г/мл.
Дано: Решение
С% = 36,2 % Из выражения для процентной
 r = 1,18 г/мл концентрации данного раствора выразим Найти: СМ =? необходимую массу растворенного вещества (HCl):
r = 1,18 г/мл концентрации данного раствора выразим Найти: СМ =? необходимую массу растворенного вещества (HCl):
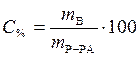 ,
, 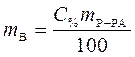 .
.
Подставляем массу соляной кислоты (m В) в формулу, выражающую молярную концентрацию раствора и, учитывая, что mР-РА = V ρ, записываем формулу перехода от процентной концентрации к молярной:
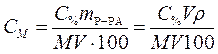 . (2)
. (2)
Для приведения размерности применяемых величин в соответствие выразим плотность раствора в r =1,18·103 г/л, тогда объем раствора получится в литрах и сокращается, формула приобретает следующий вид:
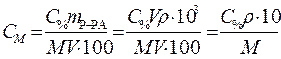 . (3)
. (3)
Производим расчет, используя формулу (3) для перехода от процентной концентрации к молярной:
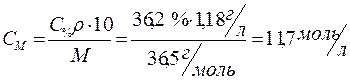
Ответ: 11,7 моль/л.
Пример 5. Задача на определение процентной концентрации, если известна молярная концентрация раствора.
Определить процентное содержание растворенного вещества в 1,68 М растворе H2SO4, плотность которого равна 1,1 г/мл.
 Дано: Решение
Дано: Решение
СМ = 1,68 моль/л
 r = 1,1г/мл Для перехода от молярной концентрации к про центной
r = 1,1г/мл Для перехода от молярной концентрации к про центной
(вывод формулы можно произвести самостоя Найти: С% =? тельно, используя пример на с. 62):
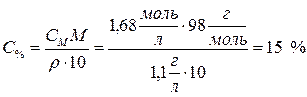 .
.
Ответ: 15 %.
Тема №6: «Гидролиз солей»
Задание 1. Напишите в молекулярной и ионной формах уравнения гидролиза солей, укажите значения рН растворов этих солей (больше или меньше 7).
Задание 2. Напишите в молекулярной и ионной формах уравнения реакций совместного гидролиза солей.
| Задание 1 | Задание 2 |
| 1. NaNO2, Cu(NO3)2 | 1. Fe2(SO4)3 + Na2CO3 |
| 2. AlCl3, NaHCO3 | 2. Na2S + Al2(SO4)3 |
| 3. Na3PO4, ZnCl2 | 3. SnCl2 + K2SO3 |
| 4. FeCl2, K2S | 4. Cr2(SO4)3 + K2S |
| 5. K2SO3, ZnSO4 | 5. K2CO3 + Bi(NO3)3 |
| 6. NH4Cl, KClO | 6. Na2S + AlCl3 |
| 7. Na2Se, MnCl2 | 7. FeCl3 + K2CO3 |
| 8. ZnSO4, BaS | 8. Cr2(SO4)3 + Na2SO3 |
| 9. Ni(NO3)2, KNO2 | 9. K2SO3 + AlBr3 |
| 10. NH4Br, Na2S | 10. Bi(NO3)3 + Na2CO3 |
| 11. Na2HPO4, Mg(NO3)2 | 11. CrCl3 + K2S |
| 12. Al2(SO4)3, Na2SeO3 | 12. Na2CO3 + Cr(NO3)3 |
| 13. CuSO4, K3PO4 | 13. K2SiO3 + Bi(NO3)3 |
| 14. Na2SO3, Fe2(SO4)3 | 14. Na2SO3 + CrCl3 |
| 15. NaCN, FeSO4 | 15. Be(NO3)2 + Na2SO3 |
| 16. Ba(CH3COO)2, CoSO4 | 16. AlCl3 + Na2SO3 |
| 17. NiSO4, NaF | 17. SnCl2 + Na2CO3 |
| 18. Pb(NO3)2, Ba(NO3)2 | 18. Na2S + Al2(SO4)3 |
| 19. Cr2(SO4)3, NaCH3COO | 19. Fe(NO3)3 + K2CO3 |
| 20. KHS, MgSO4 | 20. Al2(SO4)3 + Na2CO3 |
| 21. CdCl2, NaClO | 21. Na2SO3 + SnCl2 |
| 22. Cr(NO3)3, K2CO3 | 22. NH4Cl + Na2SiO3 |
| 23. KHSO3, MnSO4 | 23. K2SO3 + CrCl3 |
| 24. Li2S, CrCl3 | 24. AlBr3 + Na2SO3 |
| 25. SrS, SnBr2 | 25. BeCl2 + Na2S |
| 26. Ca(HCO3)2, CuBr2 | 26. BeCl2 + Na2SO3 |
| 27. Li2SO3, AlCl3 | 27. Fe2(SO4)3 + K2SO3 |
| 28. Zn(NO3)2, К3PO4 | 28. Na2S + Al(NO3)3 |
| 29. (NH4)2SO4, RbHSO3 | 29. SnCl2 + Na2SO3 |
| 30. SnSO4, KF | 30. SnCl2+ K2CO3 |
Примеры решения задач и оформления задания раздела 6
Пример 1. Гидролиз солей, образованных сильной кислотой и слабым основанием, например NH4NO3:
NH4Cl = NH4++ NO3-
Гидролизу подвергается катион слабого основания NH4+:
NH4+ + HOH Û NH4OH + H+ (ионы H+ в избытке).
Молекулярное уравнение:
NH4NO3+ H2O Û NH4OH + HNO3 – кислая среда (рН < 7).
Пример 2. Гидролиз солей, образованных слабой кислотой и сильным основанием, например Na2CO3:
Na2SO3 = 2Na+ + CO32-
Гидролизу подвергается анион слабой кислоты CO32-:
1-я ступень: CO32-+HOH Û HCO3-+OH- (ионы OH- в избытке).
Молекулярное уравнение 1-й ступени:
Na2CO3 + H2O Û NaHCO3 + NaOH – щелочная среда (рН > 7).
При обычных условиях гидролиз протекает главным образом по первой ступени.
Пример 3. Совместный гидролиз двух солей, например Al(NO3)3 + + Na2S + H2O, протекает необратимо с образованием слабого основания и слабой кислоты:
Итоговое ионное уравнение:
2Al3+ + 3S2- + 6H2O = 2Al(OH)3 + 3H2S (рН » 7),
т. к. образуются 2 слабых электролита.
Молекулярное уравнение:
2Al(NO3)3 + 3Na 2S + 6H2O = 2Al(OH)3 + 3H2S + 6NaNO3
И растворами щелочей»
Используя потенциалы (см. таблицу «Окислительно-восстановительные потенциалы водорода, кислорода и
некоторых металлов в разных средах»), допишите уравнения реакций (по две для каждого варианта) и составьте к ним электронно-ионные схемы. Для реакций металлов с H2SO4 концентрированной и HNO3 значение потенциала окислителя примите равным более 1 В. Оцените практическую устойчивость металлов в данной среде.
| 1. Al + HCl H2SO4конц. + Сu | 13. Sn + H2O + O2 H2SO4конц. + Bi |
| 2. Al + H2O + O2 H2SO4конц. + Sn | 14. Co + NaOH + H2O + O2 H2SO4конц. + Co |
| 3. Al + H2O H2SO4конц. + Zn | 15. Sn + NaOH + H2O + O2 H2SO4конц. + Be |
| 4. Al + KOH + H2O HNO3разб. + Be | 16. Ni + H2O + O2 HNO3разб. + Pb |
| 5. Al + NaOH + H2O HNO3разб. + Cd | 17. Pb + KOH + H2O + O2 HNO3разб. + Cr |
| 6. Cu + H2O + O2 HNO3разб. + Mg | 18. Cr + KOH + H2O + O2 H2SO4конц., t° + Al |
| 7. Cu + NaOH + H2O + O2 HNO3конц. + Ba | 19. Pb + H2O + O2 HNO3разб. + Bi |
| 8. Fe + H2O + O2 HNO3конц. + Pb | 20. Bi + KOH + H2O + O2 HNO3конц., t° + Ni |
| 9. Cr + H2O HNO3разб. + Fe ® Fe3+ | 21. Cr + HCl H2SO4конц. + Mg |
| 10. Zn + H2O H2SO4конц., t° + Al ® | 22. Al + HCl Zn + NaOH + H2O |
| 11. Zn + NaOH + H2O H2SO4конц., t° + Ni ® | 23. Ti + H2SO4конц., t° Cd + KOH + H2O + O2 |
| 12. Zn + H2SO4разб. +O2 HNO3конц., t° + Fe ® Fe3+ | 24. Ti + HNO3разб. Cd + KOH + H2O |
| 25. Cr + H2O + O2 HNO3разб. +Cu | 28. Cd + HCl + O2 Be + H2SO4конц. |
| 26. Zn + NaOH + H2O + O2 H2SO4конц., t° + Fe ® Fe3+ | 29. Fe + KOH + H2O + O2 Ag + HNO3 конц. |
| 27. Cr + NaOH + H2O HNO3разб. + Sn | 30. Ni + KOH + H2O + O2 Mn + H2SO4конц. |
Примеры решения и оформления заданий к разделу 9
Пример 1
Рассмотрите возможность растворения кальция в воде. Составьте электронно – ионную схему, ионное и молекулярное уравнения.
Ca + H2O →
Red Ox
Восстановителем в данном процессе является металл – Са.
φСа2+/ Ca = –2,84 В;
Окислителем является Н2О. φ2Н2О/H2 = - 0,41 В.
Реакция теоретически возможна, т. к. разность потенциалов окислителя и восстановителя Dφ2Н2О/H2 - φСа2+/ Ca = – 0,41 – (– 2,84) = 2,43 В > 0. В воде практически растворяются щелочные и щелочно-земельные металлы, гидроксиды которых являются растворимыми соединениями.
Электронно – ионная схема, ионное и молекулярное уравнения:
| 1 1 | Ca – 2ē = Ca2+ 2Н2О + 2ē = Н2 + 2ОН - |
Ca + 2Н2О = Ca2+ + 2ОН - + Н2
Ca + 2Н2О = Ca(OH)2 + Н2
Пример 2.
Рассмотрите возможность растворения цинка и меди в соляной кислоте.
Восстановителем в рассматриваемых окислительно-восстановительных реакциях могут быть Zn и Cu:
φZn2+ /Zn = – 0,76 В , φCu2+ /Cu = + 0,34 B.
Окислителем является Н+. φ2Н+/ H2 = 0.
Медь не растворяется в соляной, а также серной кислоте разбавленной, т. к. разность потенциалов Dφ = φ2Н+/ H2 – φCu2+ /Cu = 0 – 0,36 = – 0,36 В меньше нуля.
Цинк растворяется в растворах разбавленных кислот, т. к. в этом случае Dφ = φ2Н+/ H2 – φZn2+ /Zn = 0 – (– 0,76) = + 0,76 В больше нуля.
Электронно-ионная схема, ионное и молекулярное уравнения:
| 1 1 | Zn – 2ē = Zn2+ 2Н+ + 2ē = Н2 |
Zn + 2Н+ = Zn2+ + Н2
Zn + 2HCl = ZnCl2 + Н2
Пример 3
Рассмотрите возможность растворения алюминия в растворе щелочи.
Al + NaOH + H2O
Red среда Ox
Восстановитель – Al. φ AlO2–/ Al = – 2,36 B.
Окислитель – Н2О. φ 2Н2О/H2 = – 0,41 B.
Возможность протекания процесса:
Dφ = Е2Н2О/H2 – φ AlO2–/ Al = – 0,41 – (– 2,36) = 1,95 В. Разность потенциалов больше нуля, следовательно, реакция теоретически возможна. Практически она также осуществима, так как гидроксид алюминия проявляет амфотерные свойства.
Электронно-ионная схема, ионное и молекулярное уравнения:
| 2 3 | Al – 3ē + 4OH– = AlO2– + 2Н2О 2Н2О + 2ē = Н2 + 2ОН - |
2Al + 8 OH – + 6Н2О = 2AlO2– + 3Н2 + 4Н2О + 6 OH –
2Al + 2OH– + 2Н2О = 2AlO2– + 3Н2
2Al + 2NaOH + 2Н2О = 2NaAlO2 + 3Н2
Пример 4
Допишите правую часть предполагаемого взаимодействия, используя схемы, предложенные выше: запишите электронно-ионные уравнения полуреакций, ионное и молекулярное уравнения реакции:
Al + H2SO4 (конц) "
Red Ox
Al + H2SO4 (конц) " Al2(SO4)3 + H2S + H2O
| 8 3 | Al – 3ē = Al3+ SO42– + 8ē + 10H+ = H2S + 4H2O |
8Al + 3SO42– + 30H+ = 8Al3+ + 3H2S + 12H2O
8Al + 15H2SO4 (конц) = 4Al2(SO4)3 + 3H2S + 12H2O
Пример 5
Допишите правую часть предполагаемого взаимодействия, используя схемы, предложенные выше, запишите электронно-ионные уравнения полуреакций, ионное и молекулярное уравнения реакции:
Zn + HNO3 (разб.) "
Red Ox
Zn + HNO3 (разб.) " Zn(NO3)2 + N2 + H2O
| 5 1 | Zn – 2ē = Zn2+ 2 NO3– + 10ē + 12H+ = N2 + 6H2O |
5Zn + 2NO3– + 12H+ = 5Zn2+ + N2 + 6H2O
5Zn + 12HNO3 (разб.) = 5Zn(NO3)2 + N2 + 6H2O
Тема 10 «Электрохимическая коррозия
Металлов»
Задание 1. Используя потенциалы (см. таблицу «Окислительно-восстановительные потенциалы водорода, кислорода и
некоторых металлов в разных средах»), укажите анод и катод гальванопары, направление движения электронов, рассчитайте ЭДС,
Задание 2. Напишите уравнения анодного и катодного процессов, молекулярное уравнение коррозии.
Гальванопары
| Коррозионная среда | ||
| H2O + O2 | NaOH + H2O | H2O |
| 1. Zn/Sn | 11. Al/Cu | 21. Pb/Sn |
| 2. Pb/Zn | 12. Cu/Zn | 22. Fe/Mg |
| 3. Fe/Zn | 13. Zn/Fe | 23. Ni/Zn |
| 4. Fe/Cu | 14. Fe/Cr | 24. Cu/Pb |
| 5. Fe/Ni | 15. Co/Al | 25. Zn/Sn |
| 6. Zn/Cu | 16. Cr/Ni | 26. Mg/Cd |
| 7. Pb/Fe | 17. Al/Fe | 27. Cr/Bi |
| 8. Bi/Ni | 18. Zn/Al | 28. Co/Mg |
| 9. Mg/Fe | 19. Cr/Bi | 29. Mg/Fe |
| 10. Ni/Mg | 20. Co/Cu | 30. Sn/Bi |
Примеры решения и оформления заданий к разделу 10
Пример 1. Гальванопара алюминий-железо в воде (среда нейтральная). В воде растворен кислород.
Решение
1. Схема гальванопары: Al / H2O, O2 / Fe.
2. Потенциалы: 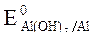 = -1,88 B;
= -1,88 B; 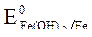 = -0,46B;
= -0,46B;
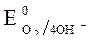 = +0,814B.
= +0,814B.
Восстановитель – Al, окислитель - О2.
 3. Al(-): 4 Al - 3ē + 3Н2О = Al(OH)3+ 3Н+ - процесс окисления;
3. Al(-): 4 Al - 3ē + 3Н2О = Al(OH)3+ 3Н+ - процесс окисления;
Fe(+): 3 О2 + 4ē + 2Н2 О = 4ОН- - процесс восстановления
 4Al + 3О 2 + 6Н2О = 4Al(OH)3
4Al + 3О 2 + 6Н2О = 4Al(OH)3
4. Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:
 ē
ē
 (-) Al/ Fе (+) ē
(-) Al/ Fе (+) ē
 О2 , Н2О
О2 , Н2О
Пример 2. Определить процессы, протекающие при коррозии луженого железа (среда – влажный воздух, содержащий кислород, пары воды и ионы Н+), если нарушена сплошность покрытия.
Решение
1. Схема гальванопары
Fe / Н2 О, О2, Н+ / Sn.
2. Потенциалы 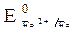 = -0,44 B;
= -0,44 B; 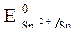 = -0,136 B;
= -0,136 B;
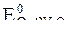 = +1,228 B.
= +1,228 B.
Восстановитель – железо, окислитель – кислород.
 3. Fe(-): 2 Fe - 2ē = Fe 2+ – процесс окисления;
3. Fe(-): 2 Fe - 2ē = Fe 2+ – процесс окисления;
Sn(+): 1 О2 + 4ē + 4Н+ =2Н2О – процесс восстановления
 2Fe + О2 + 4Н+ = 2Fe2+ + 2Н2О
2Fe + О2 + 4Н+ = 2Fe2+ + 2Н2О
2Fe + О2 + 4НCl = 2FeCl2 + 2Н2О
При нарушении целостности покрытия будет разрушаться Fe.

 4. Электроны движутся от участка с меньшим потенциалом к участку с большим потенциалом: ē
4. Электроны движутся от участка с меньшим потенциалом к участку с большим потенциалом: ē
(-) Fe/ Sn (+) ē
 О2 , Н+
О2 , Н+
Пример 3. Рассмотреть коррозию детали из железа и алюминия в щелочной среде (КОН), если растворенный кислород отсутствует.
Решение
1. Схема гальванопары:
Al / КОН/ Fe
2. Потенциалы: 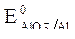 = -2,36 B;
= -2,36 B; 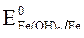 = -0,874 B;
= -0,874 B;
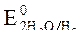 = -0,827 B.
= -0,827 B.
Восстановитель - алюминий, окислитель - вода.
3.
| Al(-): | 2 | Al - 3ē + 4OH – = AlO2– + 2H2O – процесс окисления; |
| Fe(+): | 3 | 2H2O + 2ē = 2OH – + H2 – процесс восстановления |
| 2Al + 8 OH – + 2H2O = 2AlO2– + 3H2 |
2Al + 8 КOH + 2H2O = 2КAlO2 + 3H2
Разрушается алюминий.
4. Направление перемещения электронов в системе:
ē


(-) Al/ Fe (+) ē
 H2O, KOH
H2O, KOH
К разделу 11
Пример 1. Электролиз водного раствора сульфата калия с инертными электродами:
K2SO4 = 2K + + SO42-
| (-) Kатод K+, H2O | (+) Aнод SO4 2-, H2O |
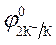 = - 2,92 B ; = - 2,92 B ; 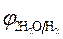 = -1 B.
Так как = -1 B.
Так как  > > 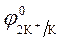 ,
происходит восстановление воды: 2 H 2 O +2ē = H 2 + 2 OH -
Среда щелочная ,
происходит восстановление воды: 2 H 2 O +2ē = H 2 + 2 OH -
Среда щелочная
| Сульфат-ионы не разряжаются, т. к. сера находится в высшей степени окисления.
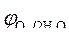 » 1,8 B.
2 H 2 O - 4ē = O 2 + 4 H +
Среда кислая » 1,8 B.
2 H 2 O - 4ē = O 2 + 4 H +
Среда кислая
|
Пример 2. Электролиз водного раствора хлорида олова с инертными электродами: SnCl 2 = Sn 2+ + 2Cl –
| (-) Kатод Sn 2 + , H 2 O | (+) Aнод Cl - , H 2 O |
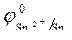 = - 0,136 B ; = - 0,136 B ;
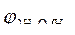 = -1B.
Так как = -1B.
Так как 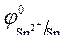 > > 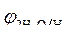 ,идет процесс восстановления ионов олова: Sn 2+ + 2ē = Sn . ,идет процесс восстановления ионов олова: Sn 2+ + 2ē = Sn .
| 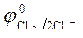 = 1,36 В ; = 1,36 В ; 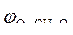 » 1,8 B
Так как » 1,8 B
Так как 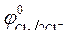 < < 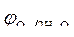 , идет
процесс окисления ионов Сl -:
2 Cl - - 2ē = Cl 2 . , идет
процесс окисления ионов Сl -:
2 Cl - - 2ē = Cl 2 .
|
Пример 3. Электролиз сульфата меди с медным анодом:
CuSO4 = Cu2+ + SO42-
| (-) Kатод Cu 2+, H2O | (+) Aнод С u, SO4 2-, H2O |
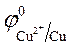 = + 0,34 B ; = + 0,34 B ;
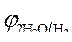 = -1 B.
Так как = -1 B.
Так как 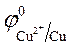 > > 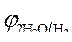 , происходит восстановление ионов меди: Cu 2+ +2ē = Cu . , происходит восстановление ионов меди: Cu 2+ +2ē = Cu .
| 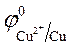 = + 0,34 B; = + 0,34 B;
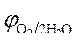 » 1,8 B.
Сульфат-ионы не разряжаются.
Так как » 1,8 B.
Сульфат-ионы не разряжаются.
Так как 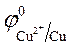 < < 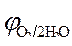 ,
анод растворяется:
Cu - 2ē = Cu 2+ . ,
анод растворяется:
Cu - 2ē = Cu 2+ .
|
Количественные соотношения при электролизе определяют в соответствии с законами, открытыми М. Фарадеем в 1834 г. Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока:
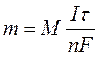 ,
,
где m - масса образовавшегося вещества , г;
М - молярная масса вещества, г/ моль;
n - количество электронов, участвующих в электродном процессе;
I - сила тока, А;
t - время электролиза, с;
F - константа Фарадея (96500 Кл/моль).
Для газообразных веществ, выделяющихся при электролизе, формула принимает вид:
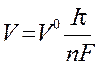 ,
,
где V- объем газа, выделяющегося на электроде, л
V 0 - объем 1 моль газообразного вещества при нормаль ных условиях (22,4 л/моль).
Пример 4. Рассчитать массу олова и объем хлора при нормальных условиях, выделившихся при электролизе раствора хлорида олова с инертными электродами в течение 1 часа при силе тока 4 А.
Решение


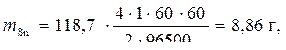
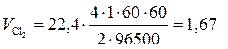 л.
л.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Коровин Н. В. Общая химия: учебник для вузов /Н. В. Коровин. – 3-е изд., испр. – М.: Высшая школа, 2002. – 558 с.
2. Угай А. Я. Общая и неорганическая химия: учебник для вузов /А. Я. Угай. – 4-е изд., испр. – М.: Высшая школа, 2000. – 527 с.
3. Гельфман М. И. Химия: учебник для студентов, обучающихся по техни-ческим специальностям и направлениям / М. И. Гельфман, В. П. Юстратов. – 3-е изд., стер. – СПб.; М.; Краснодар: Лань, 2003. – 480 с.
4. Глинка Н. Л. Общая химия: учеб. пособие для вузов /Н. Л. Глинка; под ред. А. И. Ермакова. – 30-е изд., испр. – М.: Интеграл-ПРЕСС, 2004. – 728 с.
5. Глинка Н. Л. Задачи и упражнения по общей химии: учеб. пособие для студентов нехимических специальностей /Н. Л. Глинка; под ред. В. А. Рабиновича, Х. М. Рубинной. – 26-е изд., испр. – М.: Интеграл–ПРЕСС, 2004. – 204 с.
6. Краткий справочник физико-химических величин / под ред. А. Равделя, А. М. Пономаревой. – Л.: Химия, 1986. – 232 с.
ПРИЛОЖЕНИЕ 1
Таблица П. 1.1.
Таблица П. 1.2.
КАТИОНЫ
Ag+
Н
Р
Н
Н
Н
Н
Н
Н
–
Примечание.
P – растворимые, Н – нерастворимые, M – малорастворимые – – в водных растворах не существуют. Гидроксиды и соли, образованные катионами К+, Na + , NH 4 + , а также соли азотной кислоты (анион NO 3 – ) растворимы.
Таблица П. 1.3.
Таблица П. 1.4.
Таблица П. 1.6.
Окислительно-восстановительные потенциалы водорода, кислорода и
некоторых металлов в разных средах
| Кислота ( pH=0 ) | φ ,В | Вода (pH = 7) | φ ,В | Щелочь (pH = 14) | φ ,В |
| 2H+/H2 | 0,00 | 2H2O/H2 | -0,41 | 2Н2О/H2 | -0,83 |
| O2/2H2O | + 1,22 | O2/4OH– | +0,81 | О2/4OH– | +0,40 |
| Al3+/Al | -1,66 | Al(OH)3/Al | -1,88 | AlO2–/Al | -2,36 |
| Bi3+/Bi | +0,32 | ВiO+/Bi | -0,04 | Bi2O3/Bi | -0,45 |
| Cd2+/Cd | -0,40 | Cd(OH)2/Cd | -0,41 | Cd(OH)2/Cd | -0,82 |
| Co2+/Co | -0,28 | Со(ОН)2/Сo | -0,32 | Co(OH)2/Co | -0,73 |
| Cr3+/Cr | -0,74 | Cr(OH)3/Cr | -0,93 | CrO2–/Cr | -1,32 |
| Cu2+/Cu | +0,34 | Cu(OH)2/Cu | +0,19 | Cu(OH)2/Cu | -0,22 |
| Fe2+/Fe | -0,44 | Fe(OH)2/Fe | -0,46 | Fe(OH)2/Fe | -0,87 |
| Mg2+/Mg | -2,36 | Mg(OH)2/Mg | -2,38 | Mg(OH)2/Mg | -2,69 |
| Ni2+/Ni | -0,25 | Ni(OH)2/Ni | -0,30 | Ni(OH)2/Ni | -0,72 |
| Pb2+/Pb | -0,13 | Pb(OH)2/Pb | -0,14 | РbO22–/Pb | -0,54 |
| Sn2+/Sn | -0,14 | Sn(OH)2/Sn | -0,50 | SnO22–/Sn | -0,91 |
| Zn2+/Zn | -0,76 | Zn(OH)2/Zn | -0,81 | ZnO22–/Zn | -1,22 |
ПРИЛОЖЕНИЕ 2
БИЛЕТ № 1
БИЛЕТ № 1
БИЛЕТ №1
1. Для атома Sn:
· составьте полную электронную формулу, отметьте валентные электроны;
· укажите высшую и низшую степени окисления;
· приведите формулу высшего оксида, укажите его кислотно-основной характер.
2. Напишите уравнения возможных реакций (в молекулярной и ионной формах) предложенных соединений с раствором гидроксида натрия:
H2SO3, Ca(OH)2, NaHCO3, SnO, FeCl3.
3. Для реакции
NH4Cl(т)  NH3(г) + HCl(г):
NH3(г) + HCl(г):
· рассчитайте величину ΔH0298, укажите тип реакции – экзо- или эндотермическая;
· составьте математическое выражение константы химического равновесия;
· укажите направление смещения равновесия:
– при уменьшении концентрации NH3;
– при понижении давления в системе;
– при понижении температуры в системе.
4. Напишите уравнения реакций в молекулярной и ионной формах для следующих превращений:
Na3PO4 → H3PO4 → Ca(H2PO4)2 → H3PO4
5. Рассмотрите возможность протекания гидролиза солей, укажите область значений pH растворов (>, », < 7), ответ подтвердите уравнениями реакций:
KNO3, AlBr3, Ca(NO2)2
6. Рассчитайте концентрацию ионов H+, OH– (моль/л) и pH в растворе NaOH с концентрацией 0,1 моль/л.
7. Составьте электронно-ионные схемы и молекулярные уравнения реакций. Укажите окислитель и восстановитель.
KMnO4 + NaNO2 + H2O → MnO2, NO3–
7. Рассмотрите коррозию гальванопары, используя потенциалы, укажите анод и катод, напишите уравнения анодного и катодного процессов, молекулярное уравнение реакции коррозии, укажите направление перемещения электронов в системе:
Sn/Cu KOH + H2O + O2
ПО ДИСЦИПЛИНЕ «ХИМИЯ»
| Номер вопроса | Балл |
| 1 | 2 |
| 2 | 5 |
| 3 | 4 |
| 4 | 3 |
| 5 | 3 |
| 6 | 2 |
| 7 | 3 |
| 8 | 3 |
| Сумма 25 | |
< 12 баллов → «неудовлетворительно»;
12 – 17 баллов → «удовлетворительно»;
18 – 23 баллов → «хорошо»;
24 – 25 баллов → «отлично».
ОГЛАВЛЕНИЕ
1. СТРОЕНИЕ АТОМА. ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ……………………………………………………………… 7
1.1. Основные характеристики энергетического состояния электронов в атоме. 7
1.2. Электронные формулы.. 11
1.3. Возможности определения свойств элементов. 12
2. ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ.. 13
2.1. Термодинамический метод рассмотрения химических процессов 13
2.2. Химическое равновесие. 15
2.3. Константа химического равновесия…………………………16
2.4. Принцип Ле Шателье…………………………………………17
3. КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ.. 19
3.1. Оксиды.. 19
3.2. Кислоты……………………………………………...………...20
3.3. Основания……………..………………………………………22
3.4. Соли……………………………………………………………24
4. ЭЛЕКТРОЛИТЫ ………………………………………………… 25
5. КОНЦЕНТРАЦИЯ РАСТВОРОВ……………………………….28
6. ГИДРОЛИЗ СОЛЕЙ ……………………………………………...29
7. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР)………………………………………………………………….. 30
7.1. Степень окисления Окислители и восстановители…………30
7.2. Составление уравнений окислительно-восстановительных реакций…………………………………………………………………31
8. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ……………………………35
9. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ И РАСТВОРАМИ ЩЕЛОЧЕЙ И КИСЛОТ………………………...37
9.1. Взаимодействие металлов с растворами кислот……………37
9.2. Взаимодействие металлов с водой…………………………..39
9.3. Взаимодействие металлов с водными растворами щелочей 40
10. КОРРОЗИЯ МЕТАЛЛОВ……………………………………… 41
11. ЭЛЕКТРОЛИЗ РАСТВОРОВ…………………………………..42
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ……………………………..45
Тема 1 «Строение атома»…………………………………………..... 45
Тема 2 «Закономерности химичеких процессов»………………..… 46
«Термохимия»……………………...………………………………….46
«Химичекое равновесие»………………………………..……………48 Тема 3 «Классы неорганических веществ»……………...…………..50
Тема 4 «Растворы электролитов»…………………………………….52
Тема 5 «Концентрации растворов»…………………………………..55
Тема 6. «Гидролиз солей»…………………………………………….64
Тема 7 «Окислительно-восстановительные реакции»…………...…65
Тема 8 «Гальванический элемент»…………………………………...69
Тема 9 «Взаимодействие металлов с кислотами, водой и расворами
щелочей»…………………………………………………………….…73
Тема 10 «Электрохимическая коррозия металлов»…………………76 Тема 11 «Электролиз растворов»…………………………………….78
Библиографический список.................................................................80
1. СТРОЕНИЕ АТОМА. ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ
Основные характеристики энергетического состояния электронов в атоме
Все известные элементы классифицированы в Периодической системе Д. И. Менделеева, которая состоит из семи периодов (1-3 малые, 4-7 большие), восьми групп. Каждая группа разделена на главную и побочную подгруппы. Главная (а) подгруппа содержит элементы малых и больших периодов, а побочная (б) – только больших (табл. П.1).
Химические свойства элементов определяются количеством и состоянием электронов в атоме, т. е. электронным строением атома.
Состояние электронов в атоме характеризуют квантовые числа:
· n – главное квантовое число, характеризует энергию электрона, а также размеры орбиталей. Орбиталь – та часть пространства, в которой наиболее вероятно нахождение электрона. Главное квантовое число принимает целочисленные значения: n = 1, 2, 3, 4, 5, 6, 7. Электроны, имеющие одинаковое значение n, образуют квантовый слой (оболочку) или уровень энергии. Количество квантовых слоев совпадает с номером периода, в котором находится элемент;
· l – орбитальное (побочное) квантовое число, характеризует энергию электрона в зависимости от формы орбитали, принимает целочисленные значения: 0, 1, 2, 3, 4… (n – 1).
Каждый энергетический уровень состоит из подуровней с одинаковым значением орбитального квантового числа. Подуровни имеют буквенные обозначения.
| Орбитальное квантовое число, l | 0 | 1 | 2 | 3 |
| Обозначение подуровня | s | p | d | f |
· ml – магнитное квантовое число описывает ориентацию орбитали в пространстве и зависит от орбитального квантового числа l. Магнитное квантовое число принимает целочисленные значения от – l до + l, включая 0.
Условно энергетические подуровни изображают в виде квантовых ячеек: для s -орбитали одна квантовая ячейка (£), для p -орбитали три – (£££), для d – пять – (£££££), для f – семь – (£££££££).
Таблица 1
Возможные значения орбитального, магнитного квантовых чисел и соответствующее, им число орбиталей
| Орбитальное квантовое число, l | Магнитное квантовое число, ml | Число орбиталей с данным значением, l |
| 0 | 0 | 1 |
| 1 | – 1, 0, +1 | 3 |
| 2 | – 2 , – 1, 0, +1, +2 | 5 |
| 3 | – 3, – 2, – 1, 0, +1, +2, +3 | 7 |
|
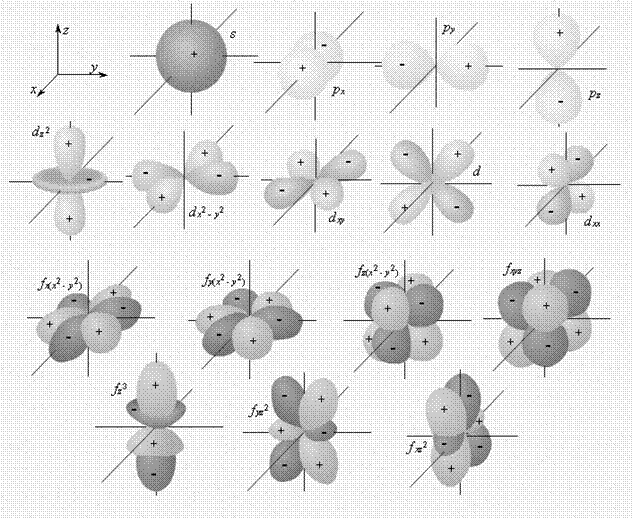
| ||
| Рисунок 1. Пространственное изображение s - , p - , d - и f - орбиталей | ||
· mS – спиновое квантовое число.
Элементарные частицы, в частности протоны, нейтроны и электроны, обладают собственным моментом импульса. Проекция собственного момента импульса на выделенное направление может принимать для них лишь два значения:
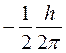 и
и 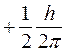 или
или 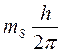
где h – постоянная Планка; mS – спиновое квантовое число:
mS = 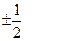
Графически это изображается антипараллельными стрелками в квантовой ячейке ↑↓.
Заполнение подуровней электронами происходит в соответствии с принципом Паули, принципом наименьших энергий и правилом Гунда.
Принцип Паули. В 1925 г. В. Паули сформулировал принцип: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Из принципа Паули следует, что максимальное число электронов на энергетическом уровне определяется по формуле Nmax = 2n2. Количество электронов на подуровнях находят по формуле Lmax = 2(2l + 1). В табл. 2, 3 приведены максимальные количества электронов на первых четырех энергетических уровнях и их подуровнях. Таким образом, любое устойчивое состояние электрона в атоме характеризуется определенными значениями квантовых чисел n, l, m и s. Таблица 2
Значения квантовых чисел и электронная формула уровня
| Главное квантовое число n (номер уровня) | Максимальное количество электронных состояний на энергетическом уровне N max | Орбитальное (побочное) квантовое число l | Максимальное количество электронных состояний на энергетическом подуровне L max | Электронная формула уровня | ||||||
| s | p | d | f | s | p | d | f | |||
| 1 | 2 | 0 | - | - | - | 2 | - | - | - | 1s 2 |
| 2 | 8 | 0 | 1 | - | - | 2 | 6 | - | - | 2s 22p 6 |
| 3 | 18 | 0 | 1 | 2 | - | 2 | 6 | 10 | - | 3s 23p 63d 10 |
| 4 | 32 | 0 | 1 | 2 | 3 | 2 | 6 | 10 | 14 | 4s 24p 64d 104f 14 |
Таблица 3
Строение атома по Бору
| Строение атома | Энергетические уровни | |||
| n = 1 | n = 2 | n = 3 | n = 4 | |

| ) | )) | ))) | )))) |
| Энергетические подуровни: | s | s p | s p d | s p d f |
Принцип наименьших энергий. Электроны заполняют орбитали в порядке возрастания энергии орбиталей.
Последовательность заполнения электронами энергетических уровней и подуровней в многоэлектронных атомах имеет вид:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<5d  4f< 6p <7s<6d
4f< 6p <7s<6d  5f< 7p:
5f< 7p:
· электроны в пределах подуровня стремятся занять наибольшее число свободных орбиталей (квантовых ячеек);
· каждая орбиталь может быть занята не более, чем двумя электронами с антипараллельными спинами.
Правило Клечковского. Детализирует принцип наименьшей энергии: заполнение подуровней электронами происходит в порядке возрастания суммы (n + l), если для двух подуровней сумма (n + l) одинакова, то в первую очередь заполняется подуровень с меньшим значением n.
Правило Гунда. Определяет порядок заполнения электронных орбиталей данного подуровня электронами. Суммарное спиновое квантовое число электронов данного подуровня должно быть максимальным.
Электронные формулы
Электронной структурой атома элемента называют распределение электронов в атоме по квантовым слоям и орбиталям. Существует два условных способа изображения электронных структур атомов: в виде электронных формул и в форме квантовых ячеек. В электронных формулах атомов элементов цифрой обозначают квантовый слой (энергетический уровень), латинской буквой – орбиталь (энергетический подуровень), надстрочным индексом – число электронов на данной орбитали. Например, электронная формула атома натрия – 11Na 1s22s22p63s1. В форме квантовых ячеек целесообразно записывать распределение валентных электронов – электронов, участвующих в образовании химической связи.
Электронные структуры атомов связаны с положением элемента в периодической системе. Периодическая система элементов является отражением Периодического закона Д. И. Менделеева, современная формулировка которого такова: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра атомов элементов.
При составлении электронных формул атомов элементов следует иметь в виду следующие положения:
· порядковый номер элемента равен общему числу электронов в атоме (сумме верхних индексов в электронной формуле), т.е. у каждого последующего элемента на один электрон больше, чем у предыдущего;
· номер периода соответствует энергетических уровней;
· номер группы, как правило, показывает число валентных электронов;
· распределение электронов по подуровням происходит в порядке возрастания их энергии.
Примеры электронных формул: 17Cl 1s22s22p63s23p5 (элемент 3-го периода, VII группы, главной подгруппы, подчеркнуты валентные электроны);
41Nb 1s22s22p63s23p63d104s24p64 d 3 5 s 2 (элемент 5-го периода, V группы, побочной подгруппы).
1.3. Возможности определения свойств элементов
Физической основой периодического изменения химических свойств элементов является периодическое повторение структуры энергетических уровней и подуровней.
Важнейшими периодически изменяющимися свойствами свободных атомов являются их радиусы, энергия ионизации и сродство к электрону (эти характеристики приводятся в справочной литературе).
Зная закономерности изменения физических и химических свойств в периодах и группах периодической системы, можно предсказать свойства: способность атомов отдавать электроны (металлы), присоединять электроны (неметаллы), реакционную способность элементов, температуру плавления, плотность и т д. Например, элементы, расположенные в Iа подгруппе, являются активными металлами, поскольку на внешнем энергетическом уровне находится один валентный электрон. В VIIа группе расположены типичные неметаллы – галогены, имеющие на внешнем энергетическом уровне семь валентных электронов.
Дата: 2018-11-18, просмотров: 762.

 Оксиды
Оксиды

 Солеобразующие
Солеобразующие
 Кислоты
Кислоты