Этим термином обозначаются количественные методы аналитической химии, выполнение которых основано на принципе измерения объема титранта (раствор с известной концентрацией реагента - титрант, который приливают к определенному объему исследуемого раствора, по каплям, до точки окончания реакции - этот процесс и называется титрованием), с последующим расчетом по уравнению реакции, неизвестной концентрации вещества в исследуемом растворе.
К титриметрическим методам относятся методы кислотно-основного титрования, осадительного, комплексообразовательного, окислительно-восстановительного. Наибольшее распространение получил метод кислотно-основного титрования (метод нейтрализации), в котором при анализе раствора кислоты титрантом служит раствор щелочи (ацидиметрия), а при анализе раствора щелочи титрантом служит раствор кислоты (алкалиметрия). Точка эквивалентности (конечная точка титрования) устанавливается с помощью кислотно-основных индикаторов; для сильных кислот и оснований в точке эквивалентности образуется нейтральный раствор (рН = 7). При расчетах по результатам кислотно-основного титрования исходят из того, что объемы исследуемого раствора Vp. вещества B и титранта, содержащего вещество А, в точке эквивалентности обратно пропорциональны нормальностям этих растворов N.
Закон эквивалентов:
NAVA= NBVB
В объёмном анализе концентрацию раствора выражают через титр T(X) и молярную концентрацию эквивалента С H(Х). (Последнюю также называют "нормальной" концентрацией и обозначают N)
Титр показывает содержание растворенного вещества в граммах в 1 мл раствора:
(Х)
T(Х) = ______ (г/мл)
V(р-ра)
Молярная концентрация эквивалента показывает содержание растворенного вещества в молях эквивалентов в одном литре раствора:
m(Х)
С H(Х) = ______________ (моль/л)
Э(Х) . V (р-ра)
где Э(Х) – масса эквивалента, Мэ
Способы выражения концентрации связаны между собой следующими соотношениями:
t(Х) . 1000
С H(Х) = _______________
M(1/Z Х)
Молярная масса эквивалента Э(X) определяется следующим образом:
Э(Х) = М(Х)/( вал-сть катиона ·заряд катиона)
Эквивалент вещества не является неизменной величиной, а зависит от того, в какой конкретной реакции участвует это вещество.
Эквивалент - это доля частицы Х, эквивалентная одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции.
Эквивалент – это реальная или условная частица вещества Х, которая в данной кислотно-основной реакции эквивалентна (соответствует) одному иону Н+ или ОН-, а в окислительно–восстановительной реакции эквивалентна одному электрону.
Количество вещества эквивалента n(1/ZХ) определяется отношением:
m(Х)
n (эквивалентовX) = ____________
Э(Х)
Тогда в соответствии с законом эквивалентов
n1(эквХ1) = n2(эквХ2)
Т.е. количества эквивалентов реагирующих или образующихся веществ равны между собой.
С H(Х)1 V1 = С H(Х)2. V2
N 1 V1 = N 2 V2
Таким образом, объёмы V1 и V2 растворов веществ, вступивших в реакцию, обратно пропорциональны их молярным концентрациям эквивалентов. Концентрацию анализируемого раствора вычисляют но формуле:
V2
N1 = N2 . _______
V1
Расчёт навески (в граммах), необходимой для приготовления V литров раствора с молярной концентрацией эквивалента С H(Х) производится по формуле:
m(Х) = С H(Х). Э(Х). V(р-ра)
Определение жёсткости воды
Содержание в природной воде ионов кальция и магния обуславливают её жесткость.
Различают постоянную (ПЖ) и временную, карбонатную (КЖ) жёсткость воды. Постоянная жёсткость обусловлена присутствием в воде сульфатов, хлоридов, нитратов и других растворимых солей кальция и магния (за исключением гидрокарбонатов). Постоянная жёсткость при кипячении не изменяется. Гидрокарбонаты кальция и магния составляют временную (карбонатную) жёсткость воды. Её можно устранить кипячением:
Са(НСО3)2 –® CaСO3¯ + CO2 + Н2O
Суммарная концентрация катионов Ca2+ и Мg2+ называется общей жёсткостью (ОЖ = ПЖ + КЖ). Жёсткость воды выражают в миллимолях на литр (ммоль/л).
Гидрокарбонаты кальция и магния создают в воде щелочную реакцию вследствие гидролиза, поэтому временную жёсткость можно определить титрованием воды раствором cерной или соляной кислоты:
Са(НСО3)2 + H2SO4 –® CaSO4 + 2CO2↑ + 2Н2O
Mg(НСО3)2 + 2HCl –® MgCl2 + 2CO2↑ + 2Н2O
При титровании растворов солей слабой кислоты и сильного основания скачок титрования находится в кислой среде, т.е. в качестве индикатора можно использовать метиловый оранжевый.
С1/Z(HCl) . Vср р-ра (HCl) . 1000
КЖ = __________________________________________ (ммоль/л)
V(H2O)
Общая жёсткость воды количественно определяется с помощью комплексонометрического титрования пробы воды раствором трилона Б с индикатором хромоген чёрный.
Расчёт общей жёсткости воды (ОЖ) производится по следующей формуле:
С(1/z тр.Б) . Vср (тр.Б) . 1000
ОЖ = ___________________________________ ммоль/л)
V(H2O)
Примеры решения задач
Пример 1. Определите молярную массу эквивалента ортофосфорной кислоты в реакции её нейтрализации гидроксидом калия с образованием соответствующего моногидрофосфата.
Решение. Из уравнения указанной реакции

следует, что фактор эквивалентности 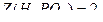
Таким образом,  .
.
Пример 4. Рассчитайте молярную массу эквивалента перманганат-анионов, восстанавливаемых в кислой среде водного раствора.
Решение. В кислой среде осуществляется следующая полуреакция восстановления: MnO-4
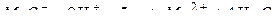
Как видно, Z = 5, 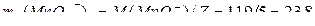 (г / моль).
(г / моль).
Контрольные задания
211. Для определения общей кислотности желудочного сока 5 мл сока оттитровали раствором щелочи с С(1/ZХ) = 0,09 моль/л в присутствии фенолфталеина. На реакцию израсходовано 2,8 мл раствора щёлочи. Рассчитайте кислотность (рН) анализируемого сока. (Ответ:1,3).
212. Сколько миллилитров раствора серной кислоты с плотностью 1,84 г/мл
(w = 95,6 %) необходимо взять для приготовления 2 л раствора с С(1/ZH2SO4) = 0,1 моль/л? (Ответ:5,57 мл).
213. Определите титр и нормальную концентрацию раствора соляной кислоты с плотностью 1,14 г/мл (w = 28,2 %). (Ответ:0,3215 г/мл; 8,81моль/л).
214. Сколько граммов Na2CO3.10H2O потребуется для приготовления 500 мл раствора с С(1/ZХ) = 0,12 моль/л? в реакции полного ионного обмена? (Ответ:8,58 г).
215. Определите титр и молярную концентрацию эквивалента раствора NH4ОН, 10 мл которого оттитровывались 15 мл раствора серной кислоты, титр которого равен 0,005020 г/мл. (Ответ: 0,005379 г/мл; 0,154 моль/л).
216. Найдите титр раствора серной кислоты, если навеска карбоната натрия, равная 0,5330 г, после растворения оттитровывается 12 мл раствора кислоты.
(Ответ: 0,04106 г/мл).
217. Какой объём раствора серной кислоты с плотностью 1,4 г/мл (массовая доля 50,5 %) нужно взять для приготовления двух литров раствора с титром, равным 0,0049 г/мл?
(Ответ:13,86 мл).
218. Рассчитайте временную жёсткость воды, если на титрование 250 мл ее в присутствии индикатора метилового оранжевого было затрачено 7,5 мл раствора соляной кислоты с С(1/ZНС1) = 0,1 моль/л. (Ответ: 3 ммоль/л).
219. Рассчитайте временную жёсткость воды, если на титрование 100 мл её пошло в среднем 3,0 мл раствора серной кислоты, титр которого равен 0,004850 г/мл. (Ответ: 2,97 ммоль/л).
220. Рассчитайте, сколько граммов соли Са(НСО3)2 содержится в 4 м3 воды, временная жёсткость которой составляет 5 ммоль/л. (Ответ: 3240 г).
ПРИЛОЖЕНИЕ
Таблица 1
Дата: 2018-11-18, просмотров: 969.