 Многие молекулы с уже реализованными химическими связями способны вступать в дальнейшее взаимодействие с образованием более сложных молекул второго порядка.
Многие молекулы с уже реализованными химическими связями способны вступать в дальнейшее взаимодействие с образованием более сложных молекул второго порядка.
А. Вернером (1893) была создана координационная теория для объяснения строения и свойств этих необычных соединений:
1. В молекуле любого комплексного соединения один из ионов или атомов металла занимает центральное место и называется комплексообразователем (М).
2. Вокруг центрального иона или атома располагается, или координируется, некоторое число (х) отрицательно заряженных ионов-анионов или нейтральных молекул (L), которые называются лигандами: М + х (׃ L) → [М(׃L)Х ].
 Комплексообразователь -М
Комплексообразователь -М

 Лиганды - L
Лиганды - L
 [Cr(NH3)6] Cl3 Внешняя сфера
[Cr(NH3)6] Cl3 Внешняя сфера



 Координационное число
Координационное число
 Внутренняя сфера
Внутренняя сфера
Центральный ион с расположенными вокруг него лигандами образует так называемую внутреннюю координационную сферу соединения.
3. Ионы, находящиеся за пределами координационной сферы, составляют внешнюю сферу комплекса.
4. Число, определяющее количество лигандов, окружающих центральный ион или комплексообразователь, называется координационным числом.
 В некоторых лигандах могут содержаться несколько групп атомов, с помощью которых они могут присоединяться к комплексообразователю. Так, в молекуле этилендиамина H2N-CH2-CH2-NH2 содержатся две NH2 -группы, которые легко вступают во взаимодействие с комплексообразующим ионом. Следовательно, лиганды подобного типа могут занимать два места во внутренней сфере комплекса. Такие лиганды, как CN−, Hal−, H2O, NH3, занимают только одно координационное место. По этому признаку определяется координационная емкость лиганда – число мест занимаемых каждым лигандом во внутренней сфере комплекса. Лиганд, который предоставляет центральному атому одну электронную пару, занимает одно координационное место и является монодентатным (H2O, NH3, NO2−, CN−, OH−,NO−3 и др.). Лиганды, у которых два и больше атомов способны образовывать связь с центральным атомом, занимают соответствующее число координационных мест и являются полидентатными. Буквально, «многозубыми» (лат. dens-зуб). Комплексы подобной структуры называют хелатными (лат. kela – клешня), а полидентатный лиганд называют хелатообразующим. Многие природные вещества – металлоферменты, гемоглобин, хлорофилл и др. – являются комплексными соединениями такого типа.
В некоторых лигандах могут содержаться несколько групп атомов, с помощью которых они могут присоединяться к комплексообразователю. Так, в молекуле этилендиамина H2N-CH2-CH2-NH2 содержатся две NH2 -группы, которые легко вступают во взаимодействие с комплексообразующим ионом. Следовательно, лиганды подобного типа могут занимать два места во внутренней сфере комплекса. Такие лиганды, как CN−, Hal−, H2O, NH3, занимают только одно координационное место. По этому признаку определяется координационная емкость лиганда – число мест занимаемых каждым лигандом во внутренней сфере комплекса. Лиганд, который предоставляет центральному атому одну электронную пару, занимает одно координационное место и является монодентатным (H2O, NH3, NO2−, CN−, OH−,NO−3 и др.). Лиганды, у которых два и больше атомов способны образовывать связь с центральным атомом, занимают соответствующее число координационных мест и являются полидентатными. Буквально, «многозубыми» (лат. dens-зуб). Комплексы подобной структуры называют хелатными (лат. kela – клешня), а полидентатный лиганд называют хелатообразующим. Многие природные вещества – металлоферменты, гемоглобин, хлорофилл и др. – являются комплексными соединениями такого типа.
С точки зрения природы химической связи можно дать следующее определение комплексным соединениям:
молекулярные соединения определенного состава , образование которых из более простых молекул не связано с возникновением новых электронных пар, называются комплексными.
Координационное число комплексообразователя определяется, главным образом, наличием у него свободных орбиталей. Координационное число 2 встречается в основном у однозарядных ионов (Cu+, Ag+, Au+). Геометрия таких молекул линейная (рис.11а).
Координационное число 4 – одно из важнейших координационных чисел, для которого характерны два типа геометрии – тетраэдрическая (рис.11б) и квадратная. Тетраэдрические структуры, как правило, образуют катионы непереходных металлов, а также переходных, расположенных у правой границы d – ряда. Например , [Li(H2O)4]+, [BeF4]2−, [AlCl4]−, [CoBr4]2−. Квадратные комплексы характерны для Cu2+, Ni2+, Pd2+, Pt2+, Au3+, Rh+ и Ir+.
Координационное число 5 встречается реже, чем 4 и 6. Для него характерны два типа геометрии – тригональная бипирамида и квадратная пирамида (рис.11в).
Катионы, характеризующиеся координационным числом 6, образуют комплексы с октаэдрической геометрией (рис.11г)
Координационное число не является неизменной величиной для данного комплексообразователя, а обусловлено также природой лиганда, его электронными свойствами.
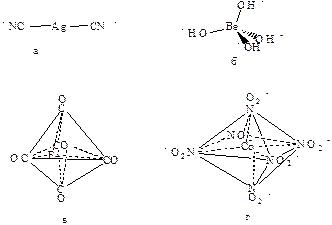
Рис.11 Структуры некоторых комплексов:
а - линейная, б - тетраэдр, в - тригональная пирамида,
г - октаэдр
Дата: 2018-11-18, просмотров: 778.