Окислитель и восстановитель всегда реагируют между собой в количествах, пропорциональных их эквивалентам.
Эквивалентом окислителя называют такое массовое количество окислителя, которое соответствует одному присоединённому электрону в данной окислительно-восстановительной реакции. Чтобы определить эквивалент окислителя, надо его молярную массу разделить на число электронов, присоединённых одной молекулой окислителя.
Эквивалентом восстановителя называют такое массовое количество восстановителя, которое соответствует одному отданному электрону в данной окислительно-восстановительной реакции. Для определения эквивалента восстановителя надо его молярную массу разделить на число электронов, отданных одной молекулой восстановителя. В общем виде эквивалент определяется по формуле:
Э = М / n ,
где Э – эквивалент окислителя или восстановителя, М – молярная масса окислителя или восстановителя, n – число электронов, полученных или отданных атомами или ионами каждой молекулы окислителя или восстановителя.
Эквивалент окислителя (восстановителя) не является постоянной величиной (как, например, молярная масса), а может принимать различные значения в зависимости от реакции. Например, перманганат калия KMnO4 . В зависимости от условий проведения реакции марганец восстанавливается в различной мере.
В кислой среде реакция протекает по уравнению:
2KMn+7O4 + 8H2SO4 + 5Na2S+4O3 = 2Mn+2SO4 + 5Na2S+6O4 + K2SO4 + 8H2O
Процесс восстановления характеризуется следующим электронным уравнением: Mn+7 + 5ē = Mn+2.
Эквивалент окислителя для этой реакции определяется: Э = М/5. Влияние кислоты на характер процесса можно объяснить тем, что ионы Н+ связывают кислород иона MnO4− в малодиссоциированные молекулы воды и смещают равновесие вправо.
В нейтральной и слабощелочной средах реакция протекает по уравнению
2KMn+7O4 + H2O + 3Na2S+4O3 = 2Mn+4O2 + 3Na2S+6O4 + 2KOH.
Процесс восстановления характеризуется следующим электронным уравнением: Mn+7 + 3ē = Mn+4 .
Эквивалент KMnO4 в этой окислительно-восстановительной реакции определяется: Э = М/3.
В сильнощелочной среде реакция протекает по уравнению:
2KMn+7O4 + 2KOH + Na2S+4О3 = 2K2Mn+6O4 + Na2S+6O4 + H2O
Cтепень окисления марганца изменяется в соответствии с уравнением:
Mn+7 + 1ē = Mn+6 ;
эквивалент KMnO4 определяется Э = M/1.
Контрольные задания
161. Определите, к какому виду окислительно-восстановительных процессов относятся следующие реакции:
а) HCl + KMnO4 ® KCl + MnCl2 + Cl2 + H2O;
б) S + HNO3 ® H2SO4 + NO;
в) Cu + HNO3 (разб.) ® Cu(NO3)2 + NO + H2O.
С помощью метода электронного баланса расставьте коэффициенты в этих уравнениях.
162. Составьте электронные уравнения и расставьте коэффициенты в уравнениях реакций. Укажите, какое вещество является окислителем, какое – восстановителем.
а) P + HNO3 + H2O ® H3PO4 + NO;
б) H2S + SO2 ® S + H2O;
в) Zn + H2SO4 (конц.) ® ZnSO4 + SO2 + H2O.
163. Определите степени окисления всех компонентов, входящих в состав следующих соединений: H2S, S, SO2 , SO3 , H2SO4 . Какие из веществ являются только окислителями, только восстановителями, и окислителями и восстановителями? Расставьте коэффициенты в уравнении реакции:
H2S + Br2 + H2O ® H2SO4 + HBr
Укажите окислитель и восстановитель.
164. Используя метод электронного баланса, подберите коэффициенты в уравнениях реакций:
a) KMnO4 + H2O + K2SO3 ® K2SO4+ MnO2+ KOH;
б) MnO2 + HCl ® MnCl2 + Cl2 + H2O.
165. Укажите реакции, в которых азот окисляется, восстанавливается, не изменяет степени окисления.
а) HNO2 + Cl2 + H2O ® HNO3+ HCl;
б) С + HNO3 ® CO2 + NO + H2O;
в) NH4NO3 + KOH ® NH4OH + KNO3.
Составьте уравнения электронного баланса, расставьте коэффициенты.
166. Какие из приведенных реакций являются внутримолекулярными? Расставьте коэффициенты в уравнениях реакций. Укажите восстановитель, окислитель.
а) KNO3 ® KNO2 + O2;
б) Pb(NO3)2 ® PbO2 + NO + O2;
в) KClO3 ® KCl + O2.
167. Какие ОВР относятся к реакциям диспропорционирования? Расставьте коэффициенты в реакциях:
а) KMnO4 ® K2MnO4 + MnO2 + O2;
б) KClO3 ®kat KCl + KClO4 .
168. Какие соединения и простые вещества могут проявлять только окислительные свойства? Выберите такие вещества из предложенного перечня: NH3, CO2, SO2, KMnO4, F2, HNO3. Составьте уравнение электронного баланса, расставьте коэффициенты в уравнении реакции:
HNO3 + H2S ® H2SO4 + NO + H2O.
169. Расставьте коэффициенты в уравнениях реакций. Укажите окислитель, восстановитель.
а) HClO3+ H2SO3 ® HCl + H2SO4;
б) H2S + H2SO3 ® S + H2O.
170. Определите, к какому виду ОВР относятся следующие реакции:
а) Cl2 + KOH ® KCl + KClO3 + H2O;
б) K2Cr2O7 + HCl ® CrCl3 + Cl2 + H2O + KCl;
в) S + H2SO4 (конц.) ® SO2 + H2O.
С помощью метода электронного баланса расставьте коэффициенты в этих уравнениях.
171. Определите, к какому типу ОВР относятся процессы, протекающие по схемам:
а) Na2SO3 + HCl ® NaCl + SO2 + H2O;
б) H2S + KMnO4 + H2SO4 ® S + K2SO4 + MnSO4 + H2O;
в) Fe3O4 + H2 ® Fe + H2O.
Расставьте коэффициенты в уравнениях реакций. Укажите окислитель, восстановитель.
172. Составьте электронные уравнения, укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях:
a) S-2 ® S+4; б) Zn0 ® Zn+2; в) N-3 ® N+5.
Используя метод электронно-ионного баланса, расставьте коэффициенты в уравнении реакции, идущей по схеме:
NaCrO2 + Br2 + NaOH ® Na2CrO4 + NaBr + H2O.
Укажите окислитель, восстановитель.
173. Исходя из степени окисления хрома, укажите, какие из соединений проявляют только окислительные свойства: Cr, Cr2O3, СrO3, K2Cr2O7 . Почему? Расставьте коэффициенты в уравнении реакции, идущей по схеме:
KNO2 + K2Cr2O7 + H2SO4 ® KNO3 + Cr2(SO4)3 + H2O.
Укажите окислитель и восстановитель.
174. Составьте электронные уравнения для реакций, протекающих по схемам:
а) SnO + KMnO4 + HCl ® SnCl4 + MnCl2 + KCl + H2O;
б) Si + NaOH + H2O ® Na2SiO3 + H2;
в) Al + H2O ® Al(OH)3 + H2.
К какому виду ОВР относятся эти реакции? Расставьте коэффициенты, укажите окислитель и восстановитель.
175. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление - происходит при следующих превращениях:
а) Cl- ® Cl+7; б) Mn+6 ® Mn+2; в) K0 ® K+1.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
H2S + HNO3 ® H2SO4 + NO + H2O.
176. Какие соединения и простые вещества могут проявлять как окислительные, так и восстановительные свойства: H2O2 , H2S, S, Cl2, KNO3 ? Почему?
С помощью метода электронного баланса расставьте коэффициенты в уравнении реакции:
Al + HNO3 (конц.) ® Al(NO3)3 + NO2 + H2O.
177. Определите, к какому виду ОВР относятся следующие реакции:
а) НJ + H2 SO4 ® J2 + H2S + H2O;
б) KMnO4 + H2O + Na2S ® S + MnO2 + KOH +NaOH;
в) HNO3 ® NO2 + H2O +O2
С помощью метода электронного баланса подберите коэффициенты в этих уравнениях.
178. Реакции выражаются схемами:
а) P + KClO3 ® P2O5 + KCl;
б) MnO2 + HCl ® Cl2 + MnCl 2 + H2O;
в) H2S + O2 ® SO2 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты. Укажите окислитель, восстановитель.
179. Определите степени окисления всех элементов, входящих в соединения: F2, Cu, HCl, H2S, KCl, KNO2. Какие из перечисленных веществ проявляют только восстановительные свойства? Расставьте коэффициенты в уравнении реакции, укажите окислитель, восстановитель.
KBr + KBrO3 + H2SO4 ® Br2 + K2SO4 + H2O.
180. Определите, к какому типу ОВР относятся процессы, протекающие по схемам:
а) H2S + KMnO4 + H2SO4 ® S + K2SO4 + MnSO4 + H2O;
б) KJ + Cl2 ® KCl + J2;
в) Сu + H2SO4 (конц.) ® СuSO4 + SO2 + H2O
Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите окислитель, восстановитель.

V.XII ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
И НЕМЕТАЛЛОВ
Примеры решения задач
Пример 1. Будут ли происходить изменения в водном растворе гидроксида калия, если опустить в них кусочки двухвалентных s-металлов: а) бериллия, б) кальция? Составьте уравнения возможных реакций в молекулярной и электронной формах.
Решение. Оба металла являются элементами IIА – подгруппы, однако лишь кальций проявляет типично металлические свойства.
а) Поскольку бериллий – это амфотерный металл, то он растворим в водно-щелочной среде:
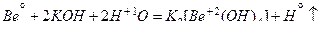


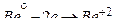 2 1 ; восст-ль, окисляется
2 1 ; восст-ль, окисляется
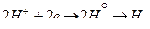 2 1 ; окислитель, вос-ся
2 1 ; окислитель, вос-ся
В итоге образуется водорастворимое комплексное соединение – тетрагидроксобериллат калия. Координационное число катиона бериллия, являющегося комплексообразователем, равно четырём. Акцепторные свойства 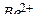 обусловлены наличием четырёх вакантных атомных орбиталей на его внешнем уровне: одной 2 s-АО и трёх 2 p-АО.
обусловлены наличием четырёх вакантных атомных орбиталей на его внешнем уровне: одной 2 s-АО и трёх 2 p-АО.
б) Кальций не реагирует с гидроксидом калия, являющимся типичным основанием. Однако этот металл взаимодействует с растворителем – водой:
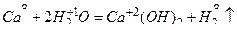


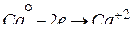 2 1; вос-ль, окис-ся
2 1; вос-ль, окис-ся
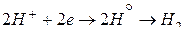 2 1; окис-ль, вос-ся
2 1; окис-ль, вос-ся
В ходе реакции образуется другая щёлочь – гидроксид калия (или гашёная известь).
Пример 2. Сравните между собой электронное строение атомов металлов цезия, бария и лантана, а также их поведение по отношению к кислороду и воде.
Решение. Рассматриваемые элементы соседствуют в шестом периоде таблицы Менделеева; они расположены соответственно в IA, IIA и IIIB – подгруппах. В той же последовательности ослабляются металлические свойства. Цезий (Cs,…  ) – щелочной s-металл с минимальной электроотрицательностью 0,65
) – щелочной s-металл с минимальной электроотрицательностью 0,65 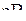 (см. табл. 5 Приложений). Поэтому он наиболее «металличен» и очень энергично взаимодействует как с кислородом (до
(см. табл. 5 Приложений). Поэтому он наиболее «металличен» и очень энергично взаимодействует как с кислородом (до 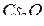 ), так и с водой (до
), так и с водой (до 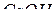 ). Барий (
). Барий ( 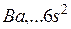 ) – щелочноземельный s-металл с ЭО, равной 0.9
) – щелочноземельный s-металл с ЭО, равной 0.9 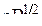 . Он также энергично взаимодействует с
. Он также энергично взаимодействует с 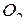 (до BaO) и с
(до BaO) и с 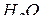 (до
(до 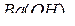 ), но более слабо, чем Cs. Лантан (La,…
), но более слабо, чем Cs. Лантан (La,… 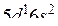 ) – редкоземельный d-металл с ЭО, равной 1,1
) – редкоземельный d-металл с ЭО, равной 1,1 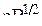 . Он также взаимодействует как с
. Он также взаимодействует как с 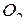 (до
(до 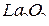 ), так и с
), так и с 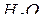 (до
(до 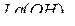 ), но ещё слабее, чем Cs и Ba.
), но ещё слабее, чем Cs и Ba.
Контрольные задания
181. Какая связь существует между восстановительной способностью металлов и их положением в периодической системе? Объясните, почему в водных растворах восстановительную способность можно оценить, используя ряд напряжений металлов, по величине стандартного электродного потенциала. Укажите примеры любых четырёх металлов, вытесняющих кобальт из растворов его солей. Назовите причину этого явления и приведите уравнение электронного баланса одной из соответствующих реакций.
182. Какие периодические характеристики химических элементов могут служить в качестве меры проявления их металлических свойств? У каких элементов из сравниваемых ниже пар металлические свойства выражены более заметно : а) Be и Mg , б) Mg и Al? Из указанных трех металлов выберите те, которые растворимы не только в кислотах, но и в сильных основаниях (щёлочах). Ответ аргументируйте, а также проиллюстрируйте его уравнениями соответствующих реакций в молекулярной и ионной формах.
183. Как зависит сила оснований от «металличности» образующих их элементов? Приведите примеры сильных и слабых оснований, а также оснований средней силы; выделите среди них амфотерные основания и назовите причину проявлений амфотерности. Составьте уравнения реакций между произвольно выбранным амфотерным гидроксидом металла и сильным основанием (щёлочью) в молекулярной и ионной формах.
184. В каком из растворов – NaOH или NH4OH – можно растворить осадок AgCl? Напишите уравнение соответствующей реакции в молекулярной и ионной формах.
185. Объясните различия восстановительной способности атомов в ряду металлов IA-подгруппы, исходя из значений энергии ионизации и электроотрицательности . Какой из щелочных металлов наиболее энергично взаимодействует с водой, галогенами, амфотерными металлами? Составьте уравнения реакций этого металла и H2 O в молекулярной и электронной формах.
186. Опишите наблюдаемые особенности поведения металлов при взаимодействии их с разбавленной и концентрированной серной кислотой. Какие металлы и почему окисляются концентрированной H2 SO4? Как различаются продукты окисления в зависимости от активности реагирующего металла? Приведите молекулярные и электронные уравнения реакций магния с разбавленной и концентрированной серной кислотой. Назовите также металлы, которые с ней не реагируют.
187. Сплав серебра с медью (биллон) подвергали последовательному воздействию азотной и соляной кислот. В каком из растворов – едкого натра или нашатырного спирта - можно растворить выпавший осадок? Составьте уравнения осуществимых реакций в молекулярной и ионной формах.
188. Как ведут себя различные металлы в отношении разбавленной и концентрированной азотной кислоты? В каких случаях, как и почему результат этого воздействия зависит от активности металла? Приведите примеры реакций одного из металлов с разбавленной и концентрированной HNO3; составьте соответствующие уравнения электронного баланса. Назовите те металлы, которые не реагируют с этой кислотой.
189. Осуществите следующие превращения: Hg  HgSO4
HgSO4  HgO
HgO  HgCl2
HgCl2  HgO. Для окислительно-восстановительных реакций приведите уравнения электронного баланса, реакции ионного обмена запишите в молекулярной и ионной формах.
HgO. Для окислительно-восстановительных реакций приведите уравнения электронного баланса, реакции ионного обмена запишите в молекулярной и ионной формах.
190. Осуществите следующие превращения: Pb  Pb2+
Pb2+  [ Pb( OH4)]2-; составьте уравнения соответствующих реакций. Учтя электронную формулу иона Pb2+, покажите, какие его вакантные орбитали участвуют в образовании донорно-акцепторных связей в комплексном катионе.
[ Pb( OH4)]2-; составьте уравнения соответствующих реакций. Учтя электронную формулу иона Pb2+, покажите, какие его вакантные орбитали участвуют в образовании донорно-акцепторных связей в комплексном катионе.
191. Будет ли вытесняться водород из воды при контакте ее с медью? Составьте уравнения возможных реакций:
а) Cu + HCl; в) Cu + HCl (конц.);
б) Cu + HNO3 (конц.); г) Cu + HCl + O2.
Составьте для них уравнения электронного баланса. Объясните причину невозможности протекания остальных реакций.
192. Сравните отношение серебра и меди к разбавленным и концентрированным кислотам: а) HCl; б) H2 SO4; в) HNO3. Укажите схемы соответствующих превращений, дополните их уравнениями электронного баланса.
193. Предложите способ очистки сточных вод, в которых присутствуют токсичные примеси ионов ртути, кадмия, цинка, свинца, олова. Укажите уравнения соответствующих реакций в молекулярной и ионно-электронной формах.
194. Осуществите следующие превращения:
Sn  Sn(NO3)2
Sn(NO3)2  Sn(OH)2
Sn(OH)2  SnCl2
SnCl2  SnCl4
SnCl4  Sn.
Sn.
Для окислительно-восстановительных реакций приведите уравнения электронного баланса; реакции ионного обмена запишите в молекулярной и ионной формах.
195. Ржавая окраска на поверхности водосливных раковин и других резервуаров обусловлена отложением нерастворимого в воде гидроксида железа (III). Предложите химический способ очистки от ржавчины; составьте соответствующие уравнения реакций.
196. Объясните, как будут реагировать с избытком NaOH растворы следующих солей: а) BeCl2; б) MgCl2; в) ZnCl2; г) NaHCO3; д) CuOHCl. Укажите уравнения протекающих реакций в молекулярной и ионной формах.
197. Написать уравнения реакция взаимодействия амфотерных гидроксидов Al(OH)3 и Zn(OH)2 с кислотами и щелочами. Назвать продукты реакции.
198. Закончить уравнения реакций между следующими веществами и назвать продукты реакций:
а) Fe2O3 + SO2 ------>
б) Na2O + ZnO ------>
в) K2O + Al2O3 ------->
г) Al2(SO4)3 + Ba(NO3)2 ------->
д) NaH2PO4 + NaOH ------->
е) Ba(HCO3)2 + Ba(OH)2 ------->
ж) Ca(HCO3)2 + Na2CO3 ------->
з) MgCl2 + Mg(OH)2 ------>
199. Написать уравнения реакций образования средних и кислых солей при взаимодействии следующих веществ, назвать продукты реакций:
а) H2SO4 + NaOH ------>
б) H2SO4 + Ca(OH)2 ------>
в) Na2CO3 + HCl ------->
200. Написать уравнения реакций образования средних и основных солей при взаимодействии следующих веществ:
а) H2SO4 + Al(OH)3 ------>
б) Н3РО4 + Са(ОН)2 ------>
Дата: 2018-11-18, просмотров: 1765.