Растворы играют большую роль в жизни и практической деятельности человека и животных. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости: кровь, лимфа, желудочный сок и т.д.
У растворов имеется ряд свойств, названных коллигативными, которые не зависят от природы растворенного вещества, а только от числа растворенных частиц в определенном количестве данного растворителя. Такими свойствами являются осмотическое давление, понижение давления насыщенного пара над раствором, повышение температуры кипения и понижение температуры замерзания раствора.
Давление пара растворов
При данной температуре давление насыщенного пара над каждой жидкостью – величина постоянная. При растворении в жидкости какого-либо вещества давление насыщенного пара этой жидкости понижается.
Таким образом, давление пара над раствором нелетучего вещества в растворителе всегда ниже давления пара над чистым растворителем при той же температуре. Согласно закону Рауля относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и выражается соотношением:
pо - р n
――― ═ ――― ,
po N + n
где po – давление пара над чистым растворителем;
р – давление пара растворителя над раствором;
n - количество растворенного вещества, моль
N – количество растворителя, моль.
Замерзание и кипение растворов
Индивидуальные вещества характеризуются строго определенными температурами переходов из одного агрегатного состояния в другое. Так, вода при нормальном атмосферном давлении (101,3 кПа) кристаллизуется при 00С и кипит при 1000С. Иначе обстоит дело с растворами. Присутствие растворенного вещества повышает температуру кипения и понижает температуру замерзания растворителя.
Рауль установил, что для разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорциональны концентрации раствора:
Δtкип. ═ Е∙С m, Δtзам. ═ К∙С m
где Δtкип. – повышение температуры кипения раствора, т.е. разность между температурами кипения раствора и чистого растворителя; Сm – моляльная концентрация раствора (моль/кг), Е – эбуллиоскопическая константа растворителя. Она численно равна повышению температуры кипения раствора, содержащего 1 моль растворенного вещества в 1 кг растворителя;
Δtзам. ─ понижение температуры замерзания раствора в сравнении с температурой замерзания чистого растворителя, К – криоскопическая константа растворителя. Она численно равна понижению температуры замерзания раствора, содержащего 1 моль растворенного вещества в 1 кг растворителя.
Е и К зависят только от природы растворителя, но не зависят от природы растворенного вещества.
Осмос
В гомогенном растворе частицы растворенного вещества и растворителя равномерно распределяются по всему объему раствора. Если поместить в цилиндр концентрированный раствор сахара, а поверх него осторожно налить чистую воду, то вначале сахар и вода будут распределены в объеме раствора не равномерно. Через некоторое время вследствие теплового движения – диффузии сахар и вода равномерно распределятся по всему объему жидкости.
Вместо цилиндра используем U ─ образную трубку, снабженную внизу мембраной (полупроницаемой перегородкой), через которую могут проникать только молекулы воды (растворителя), но не молекулы (ионы) растворенного вещества. Заполним правое колено водой (чистым растворителем), а левое – раствором сахарозы в воде так, чтобы уровни жидкости в обоих коленах были одинаковыми. Выравнивание концентраций осуществляется в одностороннем порядке, только за счет перехода части молекул воды из правой части прибора в левую, где концентрация сахарозы выше. В итоге уровень жидкости в правом колене начнет снижаться, а в левом возрастать, пока не установится некоторая разность столбов, отвечающая давлению, при котором односторонняя диффузия прекратится.
 |
Процесс самопроизвольного перехода (диффузии) растворителя через полупроницаемую перегородку из той части системы, где концентрация растворенного вещества ниже, в другую, где она выше, называется осмосом. Давление, которое нужно приложить к раствору, чтобы прекратить осмос, т.е. проникновение в него через полупроницаемую перегородку чистого растворителя, называется осмотическим давлением ( рис. 10)
Рис.10
Для растворов неэлектролитов зависимость осмотического давления от концентрации и температуры раствора выражается законом Вант-Гоффа:
Осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объём, равный объёму раствора.
Математическое выражение осмотического закона Вант-Гоффа:
Р = См∙ R∙Т,
где Р – осмотическое давление, Па; См– молярная концентрация, моль/л;
R − универсальная газовая постоянная, равная 8,314 Дж/моль∙К;
Т – абсолютная температура раствора, К
или Р = (n·R Т) / V,
где n – количество растворенного вещества, моль; n = m/M, m – масса растворенного вещества, г; а М – его молярная масса, г/моль; V – объем раствора, л.
Осмос лежит в основе целого ряда физиологических процессов, происходящих в организме человека и животных. Посредством осмоса осуществляется усвоение пищи, распределение питательных веществ, переносимых с кровью, и жидкостный обмен в тканях.
Примеры решения задач
Пример 1. Для определения относительной молекулярной массы вещества, являющегося неэлектролитом, его навеска массой 1,764 г была растворена в воде и объем раствора доведен до 100 мл. Измеренное осмотическое давление раствора оказалось равным 2,38∙102 КПа при 20оС. Рассчитайте молярную массу указанного вещества.
Решение. В растворе объемом 1 м3 (103л) масса вещества составляет 17640 г. Из уравнения Вант-Гоффа, подставляя в это выражение экспериментальные данные, получим:
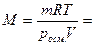
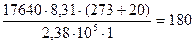 г/моль
г/моль
Пример 2. Навеска вещества массой 12,42 г растворена в воде объемом 500 мл. Давление пара полученного раствора при 25 0С равно 3297,8 Па. Как по этим данным найти молярную массу растворенного вещества?
Решение. Для определения молярной массы растворенного вещества М1 надо вычислить количество молей растворенного вещества ν1, пользуясь законом Рауля:
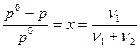 ,
,
где : р - давление пара над раствором;
р0 – давление пара над чистой водой, его значение при 250С согласно табл 14 равно 3306 Па;
ν2 = 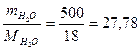 моль, после подстановки в закон Рауля получим:
моль, после подстановки в закон Рауля получим:
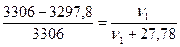 ;
;
отсюда ν1 = ν(вещества) = 0,069 моль;
М1 = 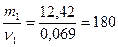 г/моль
г/моль
Пример 3. Раствор, содержащий 0,85 г хлорида цинка ZnС12 в 125 г воды, замерзает при -0,23 °С. Определите кажущуюся степень диссоциации хлорида цинка в этом растворе.
Решение. Выразим прежде всего моляльную концентрацию раствора в молях на 1000 г воды. Так как молярная масса хлористого цинка равна 136 г/моль, то
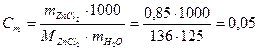 моль/кг
моль/кг
Для растворов электролитов величина понижения точки замерзания рассчитывается по формуле
∆tзам. = i∙ К∙Ст
Криоскопическая постоянная К для воды из табл. равна 1,86 оС следовательно, изотонический коэффициент данного раствора составит:
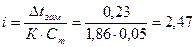
Степень диссоциации связана с величиной изотонического коэффициента соотношением:
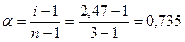 или 73,5%
или 73,5%
Здесь п – количество ионов, образующихся при диссоциации молекулы ZnCl2.
Контрольные задания
91. Давление пара воды при 10° С составляет 1227,8 Па. Сколько граммов метилового спирта СН3ОН следует растворить в 388 г воды , чтобы понизить давление пара до 1200 Па? Ответ: 16 г.
92. Раствор 1,15 г глицерина в 50 мл ацетона кипит при 56,6оС. Используя табличные данные по температуре кипения чистого ацетона и его плотности, вычислите эбуллиоскопическую константу ацетона. Ответ: 1,56.
93. В каких объемных отношениях надо взять воду и этиленгликоль, чтобы приготовленный из них антифриз замерзал примерно при -20оС? Ответ: 5 : 3
.
94. Какое осмотическое давление имеет 17%-ный водный раствор сахарозы С12Н22О11 при 20оС, если плотность данного раствора составляет 1,067 г/мл?
Ответ: 1,29∙106 Па.
95. Раствор анилина С6Н5NH2 в диэтиловом эфире при 25оС имеет давление пара 67319 Па. Рассчитайте процентную концентрацию данного раствора.
Ответ: 7,2%.
96. Раствор, содержащий неэлектролит массой 55,4 г в 2,5 л воды, кипит при 100,16оС. Чему равна молярная масса данного неэлектролита? Ответ: 72 г/моль.
97. В каком количестве воды надо растворить 6,84 г глюкозы С6Н12О6, чтобы давление пара воды, равное при 65оС 250 гПа, снизилось до 248 гПа? Ответ: 84,8 г.
98. Найдите относительную молярную массу неэлектролита, если его 10%-ный раствор замерзает при -1,15оС.
Ответ: 180 г/моль.
99. Сколько воды надо прибавить к 5 л раствора сахара, чтобы понизить его осмотическое давление в 4 раза?
Ответ: 15 л.
100. Растворением 39,7 г мочевины (NH2)2CO в воде было получено 3 л раствора. Какое осмотическое давление имеет данный раствор при 5оС и до какой температуры его надо нагреть, чтобы повысить осмотическое давление на 25 кПа? Ответ: 5,1∙105 Па; 292 К.
Дата: 2018-11-18, просмотров: 882.