Вода – слабый амфотерный электролит. В незначительной степени подвергается электролитической диссоциации по схеме (без учёта гидратации ионов Н+):
Н2О 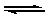 Н+ + ОН–
Н+ + ОН–
Применяя закон действующих масс можно записать выражение константы диссоциации:
КД = [H+]·[OH–] / [H2O].
Из экспериментальных данных при 250С КД = 1,86∙10–16. Так как концентрация ионов воды очень мала, концентрацию недиссоциированной части молекул воды можно считать постоянной величиной равной:
[H2O] = 1000/18 = 55,56 моль/л, где 18 – молярная масса воды, т.е. в 1л (массой 1000г) содержится 55,56 молей воды. Подставив эту величину в выражение КД, получим, так называемое, ионное произведение КW :
КW = Кд·[H2O] = [H+]·[OH–] = 1,86·10–16·55,56 = 1·10–14
Произведение концентраций ионов водорода и гидроксид-ионов называется ионным произведением воды КW = [ H+]·[ OH–].
KW – величина постоянная, и при температуре 25оС КW = 10–14. С повышением температуры ионное произведение воды возрастает, т.к. процесс диссоциации воды эндотермический (например, при 100оС КW = 74·10–14). Ионное произведение воды даёт возможность вычислить концентрацию гидроксид-ионов для любого водного раствора, если известна концентрация ионов водорода, и наоборот.
Из уравнения электролитической диссоциации воды видно, что концентрации водородных и гидроксильных ионов в чистой воде равны: [H+] = [OH–] = 10–7 моль/л – среда нейтральная; если [H+] > 10–7 – среда кислая и при [H+] < 10–7 – среда щелочная.
Водородным показателем рН называется отрицательный десятичный логарифм концентрации ионов водорода: pH = – lg [ H+].
Например, если [H+] = 10–3 моль/л, то рН = 3, среда раствора – кислая; если [H+] = 10–12 моль/л, то рН = 12, среда раствора – щелочная.
 |
|
Качественно реакцию среды и рН водных растворов электролитов определяют с помощью индикаторов – веществ, которые изменяют свой цвет в зависимости от среды растворов, т.е. рН раствора.
На практике применяют индикаторы: лакмус, метиловый оранжевый, фенолфталеин и универсальный. Они изменяют свою окраску в малом интервале рН: лакмус – в интервале от 5,0 до 8,0; метилоранж – от 3,1 до 4,4 и фенолфталеин – от 8,2 до 10,0; универсальный индикатор можно использовать для качественного определения рН в широком интервале от 0 до 14.
РЕАКЦИИ ИОНОГО ОБМЕНА
Примеры решения задач
Пример 1. ПР(РbSО4) = 2,2.10-8. Чему равна концентрация ионов Рb2+ и SО42- в насыщенном растворе сульфата свинца и его растворимость, выраженная молярной и массовой концентрациями?
Решение.
В насыщенном растворе сульфата свинца существует гетерогенное равновесие: РbSО4 (т)↔ Рb2+(р-р) + SО42-(р-р)
х х х
ПР(РbSО4)= 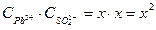
Растворимость бинарного электролита равна молярной концентрации каждого из его ионов:
s=х = 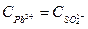 =
= 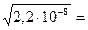 1,5 10-4 моль/л.
1,5 10-4 моль/л.
Растворимость соли, выраженная массовой концентрацией, равна : s∙М= 1,5 ·10-4 моль/л ·303 г/моль = 0,0455 г/л.
Пример 2. Составьте уравнения реакций, протекающих в водных растворах, в молекулярной, ионной и сокращенной ионной формах: 1) между сульфидом натрия и сульфатом меди (II), 2) между гидроксидом железа (III) и соляной кислотой.
Решение.
Решение задачи разобьем на этапы:
а) составляем уравнение реакции в молекулярной форме: Na2S + CuSO4 = CuS↓ + Na2SO4
б) составляем уравнение реакции в ионной форме, изобразив формулы растворимых сильных электролитов в виде ионов, на которые они диссоциируют практически полностью, а формулы остальных веществ (например, выпадающих в осадок или слабых электролитов) оставим без изменения:
2 Na+ +S2- + Cu2+ + SO42- = CuS↓ + 2Na+ + SO42-
в) исключаем из правой и левой частей одинаковые количества одноименных ионов (они подчеркнуты);
г) записываем уравнение в сокращенной ионной форме:
S2- + Cu2+ = CuS↓
2. а) составляем уравнение реакции в молекулярной форме:
Fe(OH)3 + 3 HCl = FeCl3 + 3H2O
б) составляем уравнение реакции в ионной форме, оставляя в виде молекул труднорастворимый гидроксид железа и воду, являющуюся слабым электролитом:
Fe(OH)3 ↓ + 3 H+ + 3 Cl- = Fe3+ + 3 Cl- + 3H2O
в) исключаем из правой и левой частей одинаковые количества одноименных ионов (они подчеркнуты);
г) записываем уравнение в сокращенной ионной форме:
Fe(OH)3 ↓ + 3 H+ + = Fe3+ + 3H2O
Пример 3. Вычислите концентрацию ионов СН3СОО- в растворе, 1 л которого содержит 0,1 моль СН3СООН и 0,2 моль НCl, считая диссоциацию HCl полной.
Решение.
1. Напишем уравнение диссоциации уксусной кислоты:
СН3СООН↔СН3СОО- + Н+
2. Напишем выражение константы диссоциации уксусной кислоты:
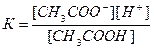
3. Соляная кислота является сильной и диссоциирует полностью, поэтому [H+]=0,2
HCl↔H+ + Cl-
4. Подставим все значения в выражение константы диссоциации уксусной кислоты:

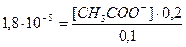
[CH3COO-] = 9.10-6
Пример 4. Вычислите рН 1%-ного раствора уксусной кислоты. Плотность раствора принять равной 1.
Решение.
Вычислим молярную концентрацию уксусной кислоты, учитывая, что плотность раствора равна 1, тогда объем раствора равен массе и равен 100 мл:

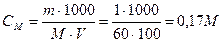
Напишем уравнение диссоциации уксусной кислоты:
х х
СН3СООН↔СН3СОО- + Н+
1 моль 1 моль
Напишем выражение константы диссоциации уксусной кислоты:
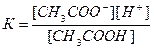
Подставим все значения в выражение константы диссоциации уксусной кислоты:
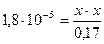
х = [ H + ] = 1,7.10-3
Вычислим значение рН:
рН = -lg[H+] = - lg 1,7.10-3= - (lg1,7 + lg10-3) = 2,8
Контрольные задания
101. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) CdCl2 и K2S;
б) КНSiО3 и НСl.
102. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Cu2+ + CO32- = CuCO3↓;
б) 2Н+ + 2NO2- = NO↑ + NO2↑ + H2O.
103. Какое из веществ (KHCO3, CdSO4 или K3PO4) будет взаимодействовать с KOH? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
104. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) KHCO3 и H2SO4;
б) MgSO4 и Na3PO4.
105. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) 3Bа2+ + 2РО43- = Bа3(РО4)2↓;
б) NH4+ + OH- = NH4OH.
106. Какое из веществ: Zn(ОН)2, CuSO4 или K2CrO4 будет взаимодействовать с КОН? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
107. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) K3BO3 и HNO3;
б) K3PO4 и CaCl2.
108. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) SO32- + 2H+ = H2O + SO2↑;
б) Hg2+ + 4Br- = [HgBr4]2-.
109. Какое из веществ: KHCO3, Cu(NO3)2 или Ca(OH)2 будет взаимодействовать с HCl? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
110. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) AgNO3 и ВаСl2;
б) MnCl2 и NH4OH.
111. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Cd2+ + 4NH4OH = [Cd(NH3)4]2+ + 4 H2O;
б) СО32- + 2H+ = CO2↑ + H2O.
112. Какое из веществ: Na2CO3, BaCl2 или Cu(NO3)2 будет взаимодействовать с H2SO4? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
113. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) ZnCl2 и Na2CO3;
б) NaNO2 и H2SO4.
114. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а)Pb2+ + 2IO3- = PbIO3↓;
б) NH4OH + H+ = NH4+ + H2O.
115. Какое вещество: ZnSO4, ZnCl2 или К2СrO4 будет взаимодействовать с Pb(NO3)2? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
116. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) CH3COOLi и H2SO4;
б) Na2S и CoSO4.
117. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Mg2+ + 2OH- = Mg(OH)2↓;
б) Н+ + НСОО- = НСООН.
118. Какое вещество: H2SO4, Mg(NO3)2 или Na2CO3 будет взаимодействовать с K2SiO3? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
119. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) HCOONa и H2SO4;
б) Bi(NO3)3 и K3PO4.
120. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Сr3+ + 4OH- = [Cr(OH)4]-;
б) 2Ag+ + CO32- = Ag2CO3↓.
V. IX ГИДРОЛИЗ СОЛЕЙ
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды – кислую, щелочную или нейтральную.
Например, водный раствор нитрата алюминия Al(NO3)3 имеет кислую среду (рН < 7), раствор карбоната натрия Na2CO3 – щелочную среду (рН > 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 – нейтральную среду (рН = 7). Эти соли не содержат в своем составе ионы водорода Н+ или гидроксид-ионы ОН¯, которые определяют среду раствора. Изменение рН объясняется тем, что в водных растворах соли подвергаются гидролизу.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Например, раствор ацетата натрия CH3COONa имеет щелочную реакцию среды. Эта соль, как сильный электролит, при растворении в воде полностью диссоциирует на ионы Na+ и СН3СОО–, которые взаимодействуют с Н+ и ОН– – ионами воды. При этом ионы Na+ не могут связывать ионы ОН– в молекулы, т.к. NaOH является сильным электролитом и существует в растворе только в виде ионов. В то же время ацетат-ионы связывают ионы Н+ с образованием молекул слабого электролита – уксусной кислоты, в результате чего новые молекулы Н2О диссоциируют на Н+ и ОН– – ионы. Эти процессы протекают до тех пор, пока не установится равновесие:
СН3СОО– + Н+ 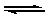 СН3СООН ,
СН3СООН ,
Н2О 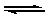 Н+ + ОН–
Н+ + ОН–
Суммарное уравнение одновременно протекающих процессов имеет вид СН3СОО– + Н2О 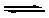 СН3СООН + ОН–
СН3СООН + ОН–
Это уравнение показывает, что в результате образования слабого электролита (уксусной кислоты) смещается ионное равновесие диссоциации воды и создается избыток ОН– – ионов, а раствор приобретает щелочную реакцию. Применив к данному обратимому процессу закон действующих масс получим:
К = [CH3COOH]∙[OH–] / [CH3COO–]∙[H2O]
Концентрация воды в растворе соли постоянна, поэтому [Н2О] объединяем с К :
К∙[Н2О] = [СН3СООН]∙[ОН–] / [СН3СОО–] = КГ ,
где КГ – константа гидролиза. Чем больше КГ, тем сильнее соль подвергается гидролизу.
Гидролиз – процесс обратимый для многих солей. В состоянии равновесия только часть молекул соли гидролизуется. Количественно гидролиз характеризуется степенью гидролиза (h), выраженной в процентах.
Степень гидролиза равна отношению числа гидролизованных молекул соли к общему числу растворенных молекул:
h = (n / N)·100% ,
где: n – число молекул, подвергшихся гидролизу; N – общее число растворенных молекул соли.
Степень гидролиза можно выразить через ионное произведение воды КW, концентрацию раствора См, константу диссоциации образующегося слабого электролита КЭ:
_____________
h ≈ √ КW/См·КЭ.
Из этой зависимости видно, что степень гидролиза может увеличиться при:
1) увеличении КW, т.е. с повышением температуры; 2) уменьшении концентрации См (при разбавлении раствора); 3) уменьшении КЭ, т.е., чем слабее образующаяся при гидролизе кислота или основание, тем выше степень гидролиза.
Таким образом, степень гидролиза зависит от природы соли, концентрации раствора, температуры.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Гидролизу подвергаются только те соли, в состав которых входят или ионы слабой кислоты, или ионы слабого основания. Если ионы растворённой соли не взаимодействуют с ионами воды, не смещают равновесия диссоциации её, то гидролизу соль не подвергается, при этом среда остается нейтральной.
Гидролизу не подвергаются соли, образованные сильными основаниями и сильными кислотами (NaCl, КNO3, Na2SO4, KMnO4 и др.).
Например, NaCl + HOH 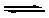 NaOH + HCl.
NaOH + HCl.
В ионной форме это уравнение будет иметь вид:
Na+ + Cl– + HOH 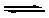 Na+ + OH– + H+ + Cl–
Na+ + OH– + H+ + Cl–
или сокращенно НОН 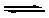 Н+ + ОН–
Н+ + ОН–
рН = 7.
Гидролизу подвергаются следующие типы солей:
1. Соли, образованные сильным основанием и слабой кислотой. Гидролиз идет по аниону и обусловлен связыванием ионов водорода воды в слабодиссоциируемую кислоту или анион кислой соли:
NaCN + HOH 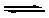 HCN + NaOH
HCN + NaOH
в ионном виде
Na+ + CN– + HOH  HCN + Na+ + OH–
HCN + Na+ + OH–
CN– + HOH  HCN + OH– pH > 7.
HCN + OH– pH > 7.
Соли, образованные сильным основанием и слабой многоосновной кислотой? гидролизуются ступенчато, при этом получаются кислые соли. Например,
Na2CO3 + HOH  NaHCO3 + NaOH
NaHCO3 + NaOH
CO32– + HOH  HCO3– + OH– pH > 7
HCO3– + OH– pH > 7
Гидролиз по второй ступени протекает незначительно:
NaHCO3 + HOH  H2CO3 + NaOH
H2CO3 + NaOH
HCO3– + HOH  H2CO3 + OH–
H2CO3 + OH–
2. Соли, образованные слабым основанием и сильной кислотой. Гидролиз идет по катиону и обусловлен связыванием гидроксид-ионов воды в малодиссоциируемое основание или катион основной соли. В растворе накапливаются ионы водорода, среда становится кислой. Например:
NH4Cl + HOH  NH4OH + HCl
NH4OH + HCl
в ионном виде
NH4+ + Cl– + HOH  NH4OH + H+ + Cl–
NH4OH + H+ + Cl–
NH4++HOH  NH4OH + H+ pH < 7
NH4OH + H+ pH < 7
Гидролиз солей с многозарядным катионом протекает ступенчато с образованием, как правило, основных солей, а не оснований. Например:
Al(NO3)3 + HOH  AlOH(NO3)2 + HNO3 (1-я ступень)
AlOH(NO3)2 + HNO3 (1-я ступень)
в ионном виде
Al3+ + HOH  AlOH2+ + H+ pH < 7
AlOH2+ + H+ pH < 7
AlOH(NO3)2 + HOH  Al(OH)2NO3 + HNO3 (2-я ступень)
Al(OH)2NO3 + HNO3 (2-я ступень)
AlOH2+ + HOH  Al(OH)2+ + H+
Al(OH)2+ + H+
Гидролиз по третьей ступени практически не протекает.
3. Соли, образованные слабым основанием и слабой кислотой. Гидролиз протекает сильнее, т.к. их ионы – катион и анион одновременно связывают водородные Н+ и гидроксильные ОН– ионы воды, сдвигая равновесие диссоциации её.
При гидролизе таких солей в зависимости от зарядности катиона и аниона могут быть получены следующие вещества:
а) слабое основание и слабая кислота (катион и анион однозарядные) –
CH3COONH4 + HOH  CH3COOH + NH4OH pH ≈ 7
CH3COOH + NH4OH pH ≈ 7
в ионной форме
CH3COO– + NH4+ + HOH  CH3COOH + NH4OH
CH3COOH + NH4OH
б) слабая кислота и основная соль (катион многозарядный) –
Al(CH3COO)3 + HOH  AlOH(CH3COO)2 + CH3COOH
AlOH(CH3COO)2 + CH3COOH
Al3+ + CH3COO– + HOH  AlOH2+ + CH3COOH
AlOH2+ + CH3COOH
в) слабое основание и кислая соль (анион многозарядный) –
(NH4)2S + HOH  NH4HS + NH4OH
NH4HS + NH4OH
NH4+ + S2– + HOH  HS– + NH4OH.
HS– + NH4OH.
При гидролизе солей, образованных слабым основанием и слабой кислотой, реакция среды может быть нейтральной, если образующиеся кислота и основание одинаковы по силе, – слабокислой, если кислота сильнее основания, – слабощелочной, если основание сильнее кислоты.
В большинстве случаев гидролиз является обратимым процессом. Однако некоторые соли подвергаются необратимому (полному) гидролизу. К таким солям относятся соли, образованные слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах. К ним относятся: Al2S3 , Cr2S3 , Fe2(CO3)3 , (NH4)2SiO3 , Al(CN)3 и др. Например, гидролиз сульфида алюминия Al2S3 протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S:
Al2S3 + 6 HOH → 2 Al(OH)3 ↓ + 3 H2S ↑
Здесь продукты гидролиза уходят из сферы реакции в виде осадка Al(OH)3 и в виде газа H2S; равновесие полностью смещается слева направо.
Примеры решения задач
Пример 1. Записать уравнение гидролиза солей: KCl, Na2CO3, Mn(NO3)2, CH3COONH4.
Какое значение рН ( >7, < 7 или ≈7) имеют растворы этих солей?
Решение.
1. Хлорид калия KCl – соль, образованная сильным основанием KOH и сильной кислотой HCl .Такие соли гидролизу не подвергаются, рН водного раствора =7.
2. Карбонат натрия Na2CO3 - соль, образованная сильным основанием NaOH и слабой кислотой H2CO3. Такие соли подвергаются гидролизу по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
СО32- + Н2О ↔ НСО3- + ОН-
Поскольку при гидролизе в свободном виде образуются ионы гидроксила, водный раствор данной соли имеет щелочную среду (рН>7).
Для записи полной ионной формы уравнения следует добавить в правую и левую части уравнения ионы Na+ , которые присутствуют в реакционной смеси, но участия в гидролизе не принимают:
2 Na+ + СО32- + Н2О ↔ НСО3- + ОН- + 2Na+
Объединив ионы в молекулы, получим молекулярную форму уравнения гидролиза:
Na2СО3 + Н2О ↔ NaНСО3 + NaОН
В результате гидролиза образуется кислая соль NaНСО3.
3. Нитрат марганца Mn(NO3)2 - соль, образованная слабым основанием Mn(OH)2 и сильной кислотой HNO3. Такие соли подвергаются гидролизу по катиону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Mn2+ + H2O ↔MnOH+ + H+
Поскольку при гидролизе в свободном виде образуются ионы водорода, водный раствор данной соли имеет кислую среду (рН< 7).
Для записи полной ионной формы уравнения следует добавить в правую и левую части уравнения ионы NО3- , которые присутствуют в реакционной смеси, но участия в гидролизе не принимают:
2NО3- + Mn2+ + H2O ↔MnOH+ + H+ + 2NО3-
Объединив ионы в молекулы, получим молекулярную форму уравнения гидролиза:
Mn(NO3)2 + H2O ↔MnOHNО3 + HNО3
В результате гидролиза образуется основная соль MnOHNО3, гидроксонитрат марганца.
4. Ацетат аммония CH3COONH4 - соль, образованная слабым основанием NН4OH и слабой уксусной кислотой CH3COOH. Такие соли подвергаются гидролизу одновременно по катиону и по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
NH4+ + CH3COO- + H2O ↔ NH4OH + CH3COOH
Поскольку при гидролизе в свободном виде не образуются ни ионы водорода, ни ионы гидроксила водный раствор данной соли имеет близкую к нейтральной среду (рН≈7).
Уравнение гидролиза в молекулярной форме имеет вид:
CH3COONH4 + H2O ↔ NH4OH + CH3COOH
Контрольные задания
121. Составьте молекулярные и ионные уравнения гидролиза солей Li3PO4, KCl, CoSO4. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
122. Составьте молекулярные и ионные уравнения гидролиза солей CuCl2, KCN, Na2 SO4. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
123. Составьте молекулярные и ионные уравнения гидролиза солей (NH4)2СO3, МоSO4, LiNO3. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
124. При смешивании растворов солей Cr2(SO4)3 и Na2SiO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза.
125. Составьте молекулярные и ионные уравнения гидролиза солей NaCN, Pb(NO3)2, K2SO4. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
126. Составьте молекулярные и ионные уравнения гидролиза солей Cr(NO3)3, NaNO3, K2SO3. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
127. При смешивании растворов солей Al(NO3)3 и K2CO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза.
128. Составьте молекулярные и ионные уравнения гидролиза солей ZnSO4, Na3PO4, CsBr. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
129. Составьте молекулярные и ионные уравнения гидролиза солей Bi(NO3)3, BaCl2, Na2SO3. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
130. При смешивании растворов солей AlCl3 и Na2SO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза.
131. Составьте молекулярные и ионные уравнения гидролиза солей Al2(SO4)3, KF, KI. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
132. Составьте молекулярные и ионные уравнения гидролиза солей MnSO4, KNO3, NaF. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
133. Составьте молекулярные и ионные уравнения гидролиза солей Сd(NO3)2, NaCl, KBrO. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
134. При смешивании растворов солей Al2(SO4)3 и K2CO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза.
135. Составьте молекулярные и ионные уравнения гидролиза солей NiCl2, Na3PO4, NaCl. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
136. Составьте молекулярные и ионные уравнения гидролиза солей Mn(NO3)2, K2SiO3, SrSO4. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
137. Составьте молекулярные и ионные уравнения гидролиза солей MgSO4, Na2CO3, Ca(NO3)2. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
138. Напишите молекулярные и ионно-молекулярные уравнения совместного гидролиза Hg(NO3)2 и K2CO3 .
139. Составьте молекулярные и ионные уравнения гидролиза солей NiSO4, Na2S, K3AsO4. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
140. Составьте молекулярные и ионные уравнения гидролиза солей СdBr2, K3PO4, LiI. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
Дата: 2018-11-18, просмотров: 749.