При составлении названия комплексного соединения вначале следует определить характер электрического заряда комплексного иона.
Катионные комплексные соединения называют следующим образом:
1. Указывают анион внешней сферы.
2. Называют число лигандов на греческом языке: 2-ди, 3-три, 4-тетра, 5-пента, 6-гекса, 7-гепта, 8-окта.
3. Называют лиганд, причем аммиак называют аммин, воду – аква.
4. Если лигандов несколько, то в первую очередь называют аммиак, затем – воду. Следующими называют лиганды-ионы, добавляя к ним окончание «о». Например, хлоро (Cl−), гидроксо (ОН−), оксо (О2−), родано (CNS−).
5. Называют комплексообразователь, используя его русское название, в скобках указывается его степень окисления. Например,
[Cr(H2O)6]Cl3 хлорид гексааквахрома (III)
[Ag(NH3)2]NO3 нитрат диамминсеребра.
Анионные комплексные соединения называют следующим образом:
1. Указывают число лигандов на греческом языке.
2. Называют лиганд.
3. Называют комплексообразователь, используя латинское название элемента с добавлением окончания -ат.
4. Называют катион внешней сферы в родительном падеже. Например,
K2[PtCl4] - тетрахлороплатинат (II) калия
K3[Fe(CN)6] - гексацианоферрат (III) калия.
Название нейтральных комплексов составляется из названий лигандов с указанием их количества и русского названия комплексообразователя в именительном падеже. Например,
[Pt(NH3)2Cl2] - дихлородиаммин платина
[Co(NH3)3Br3] - трибромотриаммин кобальт.
Количественно способность комплексного соединения к диссоциации в растворе характеризуется величиной константы нестойкости. Её можно получить, прилагая закон действующих масс к равновесию диссоциации комплексного иона или нейтрального комплекса. Например:
[Co3+ (NH3)60]3+  Co3+ + 6 NH3 0
Co3+ + 6 NH3 0
Константа нестойкости в этом случае приобретает вид:
[Co3+]∙[NH3]6
Kнест. ═ ―――――――――― = 4,07∙10 -3 ;
[[Co3+(NH3)60]3+]
1
Kнест. ═ ――
Kуст.
Константа нестойкости характеризует устойчивость комплекса, которая зависит от прочности связи между центральным атомом и лигандами. Чем ниже значение константы нестойкости комплекса, тем он более прочен и устойчив.
Примеры решений задач
Пример 1. Вычислите заряды комплексных ионов , образованных платиной (IV):
1) [ 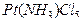 ]; 2) [
]; 2) [ 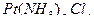 ]; 3) [
]; 3) [ 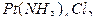 ]. Назовите эти соединения.
]. Назовите эти соединения.
Решение. Степень окисления атома платины (комплексообразователя) равна +4, заряд молекулы аммиака (лиганда) равен нулю, а заряд хлорид-аниона (другого лиганда) равен -1; в итоге в соединении 1) - пентахлорамминплатине (IV) ([ 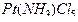 ]
] 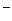 ) - суммарный заряд составляет +4 + (-5) = -1.
) - суммарный заряд составляет +4 + (-5) = -1.
Аналогичным образом находим заряды других комплексов:
2) в тетрахлордиамминплатине (IV)
([ 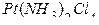 ]) +4 + (-4) = 0,
]) +4 + (-4) = 0,
3) в дихлортетраамминплатине (IV)
([ 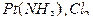 ]
] 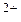 ) +4 + (-2) = +2.
) +4 + (-2) = +2.
В первом случае внешняя сфера содержит катионы, во втором – соединение является неэлектролитом, а в третьем – внешнюю сферу содержит анионы.
Пример 2. В результате приливания раствора 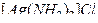 к раствору тиосульфата калия
к раствору тиосульфата калия 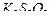 образуется комплексная соль
образуется комплексная соль 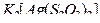 . Составьте уравнение реакции и укажите причину её протекания.
. Составьте уравнение реакции и укажите причину её протекания.
Решение: Учтём, что прочность аммиачных комплексов значительно ниже, чем тиосульфатных: это видно из сравнения соответствующих констант нестойкости (см. табл. 3 Приложения). Реакция всегда протекает в направлении образования более прочного комплексного иона. В рассматриваемом случае уравнение реакции в молекулярной форме имеет следующий вид:
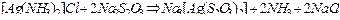 ,
,
Принимая во внимание, что ионы 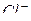 и
и 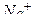 практически не изменяют своей концентрации в растворе, окончательно имеем:
практически не изменяют своей концентрации в растворе, окончательно имеем: 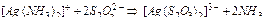 .
.
Пример 3. Константа нестойкости иона 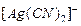 составляет
составляет 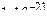 . Вычислить концентрацию ионов серебра в 0,05 M растворе
. Вычислить концентрацию ионов серебра в 0,05 M растворе 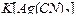 , содержащем, кроме того, 0,01 моль/л
, содержащем, кроме того, 0,01 моль/л 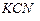 .
.
Решение. Вторичная диссоциация комплексного иона протекает по уравнению:
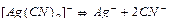 .
.
В присутствии избытка ионов 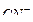 , создаваемого в результате диссоциации
, создаваемого в результате диссоциации 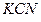 (которую можно считать полной), это равновесие смещено влево настолько, что количеством ионов
(которую можно считать полной), это равновесие смещено влево настолько, что количеством ионов 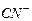 , образующихся при вторичной диссоциации, можно пренебречь. Тогда
, образующихся при вторичной диссоциации, можно пренебречь. Тогда 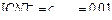 моль/л. По той же причине равновесная концентрация ионов
моль/л. По той же причине равновесная концентрация ионов 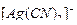 может быть приравнена к общей концентрации комплексной соли (0,05 моль/л).
может быть приравнена к общей концентрации комплексной соли (0,05 моль/л).
По условию задачи:
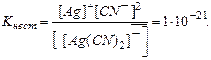
В итоге определим концентрацию ионов 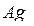 :
:
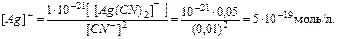
Контрольные задания
141. Составьте уравнения диссоциации на ионы перечисленных ниже комплексных солей: Na3[ Co( NO2)6]; [ Cr( H2 O)4 Cl2] Cl; Назовите комплексные соли, укажите валентность и координационное число их комплексообразователей, запишите выражения для константы нестойкости.
142. Составьте уравнение реакции в молекулярной и ионной формах, которые соответствуют следующим схемам:
а) K2[ HgCl4] 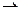 K2[ HgI4];
K2[ HgI4];
б) K[Ag(NO2)2] 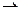 [Ag(NH3)2]NO2.
[Ag(NH3)2]NO2.
Укажите, какие комплексные ионы в указанных схемах, исходные или конечные, характеризуются меньшими по величине константами нестойкости. Почему?
143. На комплексные соединения CoCl2·6 NH3 и CoCl2·5 NH3 подействовали раствором AgNO3. На полмоля одного соединения для осаждения хлора пошло полтора моля , а на полмоля второго – 1 моль AgNO3. Укажите координационные формулы этих соединений и определите заряды комплексных ионов.
144. Составьте молекулярное уравнение реакции, протекающей по схеме:
[Fe(CN)6]4- + MnO4- + 8 H+ 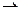 [Fe(CN)6]3- + Mn2+ + 4H2O.
[Fe(CN)6]3- + Mn2+ + 4H2O.
Определите степени окисления комплексообразователей и напишите выражения констант нестойкости комплексных анионов.
145. Из сочетаний частиц Zn2+, NH3, CN- и Na+ можно составить 5 координационных формул комплексных соединений цинка. Укажите формулы данных соединений, если координационное число цинка равно четырем. Назовите эти соединения и запишите уравнения их диссоциации на ионы.
146. Составьте уравнения диссоциации на ионы комплексных солей: Cr( NH3)5С l3; Cr( NH3)4( H2 O) Cl3; Co( NH3)5( NO2)3; KС o( NH3)2( NO2)4, заключив формулы комплексных ионов в квадратные скобки и имея в виду, что координационное число как хрома, так и кобальта равно шести.
147. Укажите возможные продукты следующих реакций, уравненных в левой части приведенных схем:
а) [ Cr( H2 O)6] Cl3 + 6 KNС S 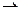
б) [ Ni( H2 O)6]2+ + 2 C2 O42- 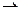
в) Zn( CN)2 + 2 KCN 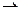
г) [ Fe( H2 O)6] 2+ + 2 NH3 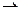
148. Напишите формулы следующих комплексных соединений: дибромотетраамминкобальта (III) нитрата, тетрааквамеди (II) сульфата, тринитритоамминкобальта (III), калия октацианомолибдата (1V), диамминсеребра (I) гидрофосфата, напишите выражения констант нестойкости для комплексных ионов.
149. Укажите координационное число и степень окисления центрального атома металла в каждом из следующих координационных соединений : а) K2[ FeCl4]; б) K3[ FeCl6]; в) Na3[ Cr( C2 O4)3]; г) [ Pt( NH3)4 Cl2] Cl2; д) [ Cr( H2 O)5 Cl] Cl2. Напишите соответствующие им выражения констант нестойкости комплексных ионов.
150. Укажите названия соединений, определите степень окисления комплексообразователя: а) [ Cr( NH3)6] Cl3; б) [ Cu( NH3)4] SO4; в) K4[ Fe( CN)6]; г) Na2[ Be( OH)4];д) [ Co( NH3)3 Cl3]; е) K[ Pt( NH3) Cl3]. Составьте уравнения электролитической диссоциации перечисленных веществ и запишите соответствующие им выражения констант нестойкости комплексных ионов.
151. Напишите формулы комплексных соединений по указанным названиям: а) гидроксид тетрааммин меди (II), б) хлорид хлородиаммин цинка (II), в) бромид бис (этилендиамин) никеля (II), г) трис (этилендиамин) кобальта (III). Составьте уравнение реакции между растворами KNO2 и Pt( NO2)2 в молекулярной и ионно-молекулярной формах. Назовите образуемое комплексное соединение.
152. Приведите схемы диссоциации и выражения констант нестойкости следующих комплексных ионов: а) [ Fe( CN)6]3-; б) [ Fe( CN)6]4-; в) [ Ag( NH3)2]+; г)[ Ag( NH3)( H2 O)]+;д) [ Cr( H2 O)6]3+. Определите степени окисления указанных комплексообразователей.
153.Эмпирическая формула соли CrCl3×5 H2 O. Исходя из того, что координационное число хрома равно шести, определите, какой объем 1 н. раствора AgNO3 понадобится для осаждения внешнесферно связанного хлора, содержащегося в 300мл 0,1 М раствора комплексной соли. При вычислениях считать, что вся вода, входящая в состав соли, связана внутрисферно. Ответ: 60 мл.
154. При взаимодействии раствора [ Cu( NH3)4] Cl2 c раствором KCN образуется соль K2[ Cu( CN)4]. Составьте уравнение реакции и объясните причину её протекания.
155. Определите величину и знак заряда перечисленных ниже комплексных ионов:
[Cr(H2O)4Cl2]; [Pt(NH3)3Cl3]; [Ag(CN)2]; [Co(NO2)6]; [Cr(NH3)5Cl]; [PtCl6],
имея в виду, что комплексообразователями являются катионы Cr,3+ Pt,4+ Ag+, Co3+. Приведите названия комплексных соединений.
156. Бромид кобальта образует с аммиаком следующие соединения:
CoBr3 × 6NH3; CoBr3 × 5NH3 × H2O; CoBr3 × 5NH3; CoBr3 × 4NH3.
Действие раствора AgNO3 приводит к практически полному осаждению всего брома из первых двух соединений, около 2/3 брома из третьего соединения и около 1/3 брома из четвертого. Определите координационное число атома кобальта. Изобразите строение указанных комплексных соединений и составьте уравнения реакций их с нитратом серебра в молекулярной и ионной формах.
157.Определите степень окисления центральных атомов в следующих комплексных соединениях и назовите эти соединения: [Co(NH3)5Br]SO4, [Co(NH3)4Cl2]2SO4, K2[HgI4], [Ni(CO)4], [Zn(NH3)4](NO3)2, [Pt(NH3)2Cl2I2].
158. Определите заряд комплексных ионов в следующих комплексных соединениях и назовите эти соединения: K2[SiF6]; Na2[PtCl4]; Mg[Pt(CN)6]; [Cr(H2O)5Cl]Cl2; [Pt(NH3)4Br2]Cl2; [Fe(CO)5]; K2[Ru(CN)5NO].
159. Найдите заряд (х) комплексных ионов: [Co3+(NH3)5Cl]x; [Co3+(NH3)4Cl2]x; [Cu2+(H2O)4]x; [Co3+(NH3)3(NO2)3]x; [Pt4+(NH3)3Cl3]x; [Fe2+(CN)6]x. Hапишите формулы комплексных соединений, подобрав соответствующие ионы внешней сферы. Назовите полученные соединения.
160. Напишите формулы следующих комплексных соединений: натрия гексанитритокобальтата (III), гексаамминникеля (II) хлорида, пентакарбонил железа (0), дибромотетрамминкобальта (III) нитрата, тетрааквамеди (II) сульфата, тринитритоамминкобальта (III), калия октацианомолибдата (1V), диамминсеребра (I) гидрофосфата.
Дата: 2018-11-18, просмотров: 1243.