Математически оно может быть выражено уравнением:
Vt2 = Vt1∙ γ Δt /10
где Vt1, Vt2 –скорости реакции при температурах t1 (начальная) и t2 (конечная),
Δt = t2 - t1.;
γ – температурный коэффициент Вант-Гоффа.
С повышением температуры скорость реакции увеличивается не столько за счёт увеличения числа соударений, сколько из-за роста числа частиц с достаточно высокой энергией, так называемых активных частиц.
Переходное состояние называется активированным комплексом и число молекул, составляющих его, определяет молекулярность реакции.
Молекулярностью реакции называют число молекул, одновременным взаимодействием которых осуществляется элементарный акт химического превращения; она может характеризоваться только целыми числами.
Если в элементарном акте реакции принимает участие одна молекула, превращающаяся в одну или несколько молекул других веществ, то такая реакция называется мономолекулярной. Примером таких реакций может служить термический распад гидрокарбоната кальция
Са(НСО3)2 → СаСО3 + Н2О + СО2.
Единовременным участием в элементарном акте химической реакции двух молекул характеризуются бимолекулярные реакции, примерами которых могут быть взаимодействие монооксида углерода и хлора с образованием фосгена и взаимодействие йода и водорода с образованием йодоводорода:
СО + Cl2 = COCl2
I2 + H2 =2HI
Реакции, элементарный акт которых сводится к одновременному столкновению трех молекул, называют тримолекулярными. Статистически этот акт мало вероятен. Реакции с молекулярностью выше трех в химической практике неизвестны.
Таким образом, уравнения химических реакций типа
4HCl + O2 = 2Cl2 + 2H2O
нельзя назвать пятимолекулярной реакцией. Это уравнение рассматривается лишь как запись суммарных процессов, каждый из которых в действительности может включать довольно длинную цепочку последовательно протекающих моно-, би- или тримолекулярных реакций.
В химической кинетике пользуются также понятием порядок реакции – это число, равное сумме показателей степеней концентраций реагирующих веществ в кинетическом уравнении реакции: V = k∙[A]a∙[B]b , где
а – порядок реакции по веществу А;
b – порядок реакции по веществу В;
n = a + b − есть общий порядок реакции.
Например, для реакции
2Н2(г) + О2(г) = 2Н2О(пар)
V = k∙[Н2]2∙[О2],
порядок реакции по водороду равен 2, а по кислороду – 1. Общий порядок реакции n = 2+1 = 3.
Катализ – явление ускорения скорости реакции под воздействием специфических веществ, количество которых в ходе реакции не изменяется. Эти вещества называются катализаторами. Действие катализатора сводится к снижению энергии активации за счёт образования промежуточных нестойких соединений, которые в дальнейшем распадаются на продукты реакции с выделением катализатора в химически неизменном виде (рис.7). Согласно этой теории катализатор (К) сначала образует с одним из веществ промежуточное соединение (АК). Затем последнее реагирует с другим исходным веществом с восстановлением катализатора. Схематически это можно представить так:
А + В = АВ (протекает медленно)
Катализатор разбивает процесс на две стадии:
1) А + К = АК (протекает быстро)
2) АК + В = АВ + К (протекает быстро)
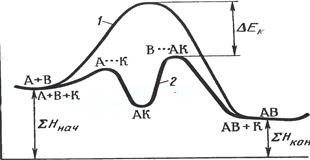 |
Освободившийся катализатор образует промежуточные соединения с новыми количествами одного из реагирующих веществ и т.д.
|
|
Различают гомогенный (однородный) и гетерогенный (неоднородный) катализ. При гомогенном катализе реагирующие вещества и катализатор образуют однофазную систему – газовую или жидкую. В этом случае между катализатором и реагирующими веществами отсутствует поверхность раздела фаз.
Примеры решения задач
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе
2NО (г) +О2 (г) ↔ 2NО2 (г), если объем газовой смеси уменьшить в три раза?
Решение. Обозначим концентрации реагирующих веществ: 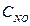 =а,
=а, 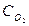 =b,
=b, 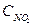 =с.
=с.
Согласно закону действия масс скорости (v) прямой и обратной реакции до изменения объема
vпр.= kпр.а2 b; vобр. = kобр. c2;
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: 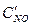 =За,
=За, 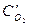 =3b,
=3b, 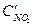 =3с. При новых концентрациях скорости (v’) прямой и обратной реакции:
=3с. При новых концентрациях скорости (v’) прямой и обратной реакции:
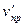 = kпр. (За)2 (3 b) = 27 kпр.а2 b;
= kпр. (За)2 (3 b) = 27 kпр.а2 b;
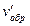 = kобр. (3с)2 = 9 kобр. c2.
= kобр. (3с)2 = 9 kобр. c2.
Отсюда 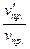 =
= 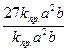 = 27;
= 27;
 =
= 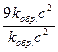 = 9.
= 9.
Следовательно, скорость прямой реакции увеличилась,. в 27 раз
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 50 до 70°С, если температурный коэффициент реакции равен 3.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
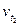 =
= 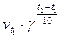 ;
;
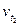 =
= 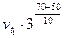 =
= 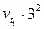 = 9
= 9 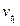 .
.
Следовательно, скорость реакции ( 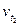 ), протекающей при температуре 70°С, увеличилась по сравнению со скоростью реакции (
), протекающей при температуре 70°С, увеличилась по сравнению со скоростью реакции ( 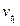 ), протекающей при температуре 50°С, в 9 раз.
), протекающей при температуре 50°С, в 9 раз.
Контрольные задания
61. При увеличении температуры в системе на 45о скорость гомогенной реакции возросла в 65 раз. Вычислите температурный коэффициент скорости реакции. Как изменится скорость данной реакции при охлаждении реакционной смеси с 80 до 50оС? Ответ: 2,5; в 15,625 раз.
62. Начальная концентрация исходных веществ в системе 4HI(г) +O2(г) →2I2(г) + 2H2О(г)
была равна 0,7 и 0,3 моль/л. Как изменится скорость реакции к тому моменту, когда концентрация I2 станет равна 0,2 моль/л? Ответ: 44,4 раза
63. Как изменится скорость реакции, протекающей в системе: MnO2(к) + 4HCl(г) → MnCl2(к) + Cl2(г)
при изменении давления в ней в 3 раза?
Ответ: 81 раз.
64. Как следует изменить давление в системе
2 NО(г) + Cl2(г) →2 NОCl(г);
чтобы скорость реакции возросла в 125 раз?
Ответ: 5 раз.
65. Константа скорости реакции омыления уксусноэтилового эфира:
СН3СООС2Н5(р-р) + КОН(р-р)→СН3СООК (р-р) +С2Н5ОН(р-р)
равна 0,1 л/моль∙мин. Начальная концентрация уксусноэтилового эфира была равна 0,01 моль/л, а щелочи – 0,05 моль/л. Вычислите начальную скорость реакции и в тот момент, когда концентрация эфира станет равной 0,008 моль/л.
Ответ: 5,0∙10 -5 и 3,84∙10-5 моль/л∙мин.
66. При повышении температуры с 55 до 85оС скорость гомогенной реакции возросла в 80 раз. Рассчитайте температурный коэффициент реакции. Ответ: 4,3;
67. Как изменится скорость реакции
2H2S(г) +3O2(г) →2SO2(г) + 2H2О(г)
Если: а)уменьшить объем реакционной смеси в 2 раза?
б)увеличить концентрацию сероводорода в 3 раза?
Ответ: 32 раза; 9 раз.
68. Начальные концентрация исходных веществ в системе N2(г) +3H2(г) ↔ 2NH3(г)
составили: азота – 2 моль/л, водорода – 4 моль/л. Как изменится скорость данной реакции при снижении концентрации водорода в результате реакции до 2,8 моль/л?
Ответ: 3,6 раза.
69. При повышении температуры с 40 до 75оС скорость гомогенной реакции возросла в 120 раз. Как изменится скорость данной реакции при повышении температуры с 75 до 100оС? Ответ: 30,6 раз
70. Как следует изменить объем реакционной смеси системы: 8NH3(г) + 3Br2(ж)→6NH4Br(к) + N2(г),
чтобы скорость реакции увеличилась в 25 раз?
Ответ: 1,5 раз
V.VI Химическое равновесие
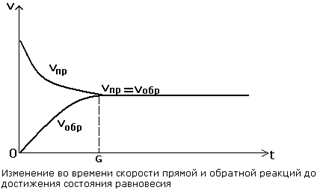 |
Реакции, протекающие одновременно в прямом и обратном направлениях, называются обратимыми. Состояние системы, когда в ней протекают два противоположно направленных химических процесса с одинаковой скоростью, называется состоянием химического равновесия (рис.8).
Рис. 8
Например,
V1
N2 + 3H2 ----> 2NH3 − ∆H (Q > 0)
V1 = k1 [N2]∙[H2]3
V2
2NH3 ----> N2 + 3H2 + ∆H (Q < 0)
V2 = k2 [NH3]2
-----------------------------------------------
N2(г) + 3H2(г)  2NH3(г)
2NH3(г)
в момент равновесия :
V1 = V2 и k1 [N2]∙ [H2]3 = k2 [NH3]2
[NH3]2
Kp = ――――-
[N2]∙ [H2]3
Кр ─ константа равновесия.
Если обратимую реакцию записать в общем виде
k1
aA + bB  cC + dD ,
cC + dD ,
k2
то в состоянии равновесия: V1 = V2 , т.е.
k1∙[A]a∙[B]b = k2∙[C]c∙[D]d ,
где [A] , [B] , [C] , [D] – равновесные концентрации веществ А, В, С, D.
Откуда можно записать выражение константы равновесия:
[ C] c ∙[ D] d
Kp = ―――――
[ A] a ∙[ B] b
Константа равновесия зависит от природы реагирующих веществ и температуры, но не зависит от концентрации и катализатора.
Дата: 2018-11-18, просмотров: 870.