 |
Квантовые числа. Квантовые ячейки
Современная теория строения атома основана на законах, описывающих движение микрочастиц. В 20-е годы XX в. возник раздел физики, описывающий движение и взаимодействие микрочастиц, – квантовая (или волновая) механика. Она основывается на представлении о квантовании энергии, волновом характере движения микрочастиц и вероятностном методе описания микрообъектов.
Основной характеристикой, определяющей состояние электрона в поле ядра атома, в квантовой механике является энергия. Энергия электрона принимает не любые, а лишь определенные дискретные (квантующиеся) значения. Для полной характеристики энергетического состояния каждого электрона в атоме разработана система четырех параметров, называемых квантовыми числами.
Главное квантовое число, n, с точки зрения волновых представлений об электроне определяет, насколько удалено данное электронное облако от ядра. Чем больше значение n, тем слабее связан электрон с ядром, тем на более высоком энергетическом уровне он находится и тем большей энергией он обладает. Главное квантовое число может принимать значения целых чисел от 1 до ∞ , но для электронов в невозбужденных атомах, открытых до сих пор элементов, оно изменяется реально от 1 до 7. Энергетические уровни, для которых n=1,2,3,4,5,6,7, называются, соответственно, K, L, M, N, O, P, .Q – уровнями, и характеризуют, практически, номер слоя электронов.
Орбитальное, или побочное, квантовое число, ℓ, характеризует различное энергетическое состояние электронов в пределах данного энергетического уровня, его значение определяет распределение электронов по подуровням данного уровня. С точки зрения волновых представлений орбитальное квантовое число ℓ характеризует форму электронного облака, пространственную область его наиболее вероятного нахождения. Для электронов, находящихся на энергетическом уровне с главным квантовым числом n, орбитальные квантовые числа ℓ могут принимать значения 0, 1, 2, 3…до (n-1). Для s-электронов (ℓ=0) характерна форма шара, для р-электронов(l=1) – форма гантели, для d-электронов(l=2) – четырехлопастного винта, для f-электронов, (l=3) эта форма еще сложнее: (рис.1) Электроны, которым отвечают значения побочного квантового числа
ℓ= 0,1,2 и 3, называются, соответственно, s-, p-, d- и f- электронами.
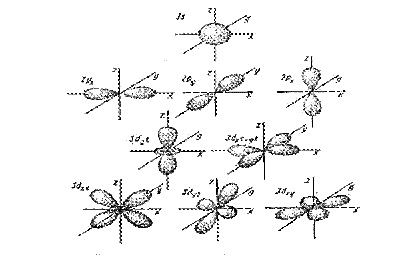 |
рисунок 1. Формы орбиталей
Электронное облако, форма которого определяется значением побочного квантового числа ℓ, а общий запас энергии – значением главного квантового числа n, называется атомной орбиталью (АО).
Табл.2
| Главное квантвое число, n | Орбитальное квантовое число, ℓ | Обозначение орбитали (электронного облака) |
| 1 | 0 | 1s |
| 2 | 0, 1 | 2s, 2p |
| 3 | 0, 1, 2 | 3s, 3p, 3d |
| 4 | 0, 1, 2, 3 | 4s, 4p, 4d, 4f |
Магнитное квантовое число mℓ характеризует пространственное расположение орбиталей. Оно определяет ориентацию электронного облака относительно взаимно перпендикулярных осей x, y, z или относительно внешнего магнитного поля. Магнитное квантовое число принимает целочисленные значения от − ℓ до + ℓ, включая и нуль, т.е. всего (2ℓ+1) значений, которым отвечают (2ℓ+1) энергетических состояний, возможных для электронов данного подуровня. Например, для f-электрона ℓ=3, mℓ может иметь (2∙3+1) значений, а именно mℓ=-3,-2,-1,0,+1,+2,+3.
Спиновое квантовое число ms характеризует внутреннее движение электрона, приводящее к возникновению у последнего собственного магнитного поля. Спиновое квантовое число может принимать только 2 значения: + ½ и -½ в зависимости от того, параллельно или антипараллельно ориентируется собственное магнитное поле электрона относительно магнитного поля, обусловленного вращением электрона вокруг ядра.
Два электрона с одинаковыми значениями n, ℓ, mℓ , но с различными значениями ms называют спаренными или неподелённой парой электронов (↑↓).
Распределение электронов в атомах элементов определяется тремя основными положениями: принципом наименьшей энергии, принципом запрета Паули, а также правилом Гунда.
Согласно принципу наименьшей энергии:
Размещение электронов должно отвечать наибольшей связи их с ядром, т.е. электрон прежде всего занимает такие положения, при которых он будет обладать наименьшим запасом энергии.
Так как энергия электрона, в основном, определяется значением главного квантового числа n и, в меньшей степени, значением побочного числа ℓ, согласно правилам В.М.Клечковского:
1. По мере увеличения заряда ядра атома заполнение подуровней осуществляется в таком порядке, при котором электрон в первую очередь поступает на подуровень, для которого значение суммы ( n+ℓ) оказывается меньшим.
2. Если сумма ( n+ℓ) оказывается одинаковой для двух или трех подуровней, то электрон в первую очередь поступает на подуровень с меньшим значением главного квантового числа.
Например, энергия электрона на подуровне 4s (n+ℓ=4+0=4) меньше, чем на 3d (n+ℓ=3+2=5). На подуровне 5s (n+ℓ=5+0=5) энергия меньше, чем на 4d (n+ℓ=4+2=6); на 5p (n+ℓ=5+1=6) энергия меньше, чем на 4f (n+ℓ=4+3=7).
Согласно принципу запрета Паули (1925):
В атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Паули установил, что максимальное количество электронов, которое может находиться на n-ном уровне, определяется по формуле x=2 n2. Так, на первом уровне может находиться не более двух электронов, на втором-8, на третьем-18, на четвертом-32, на пятом-50.
Третье теоретическое положение, которым руководствуются для выяснения электронной конфигурации атома – правило Гунда:
Электроны в пределах данного подуровня ( s-, p-, d- или f-) располагаются так, чтобы алгебраическая сумма значений спиновых квантовых чисел была максимальной.
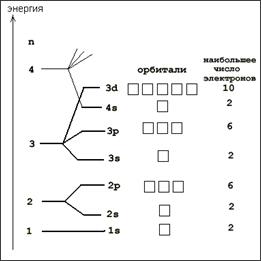 Заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел n + l, а при равной сумме – в порядке возрастания числа n. Соответственно по этому правилу последовательность заполнения энергетических уровней и подуровней следующая:
Заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел n + l, а при равной сумме – в порядке возрастания числа n. Соответственно по этому правилу последовательность заполнения энергетических уровней и подуровней следующая:
1s2 < 2s2 < 2p6 < 3s2 < 3p6 < 4s2 < 3d10 < 4p6 < 5s2 < 4d10 < 5p6 < 6s2 < 5d1 < 4f14 < 5d9 < 6p6 < 7s2 < 6d1 < 5f14 < 6d9 < 7p6 < 8s2……
Примеры решения задач
Пример 1. Напишите электронную формулу атома серы. К какому электронному семейству относится сера? Укажите валентные электроны, распределите их по энергетическим ячейкам в нормальном и возбужденных состояниях.
Решение. У атома серы порядковый номер 16 в таблице Д.И. Менделеева, поэтому – 16 электронов и последовательность заполнения энергетических уровней и подуровней совпадает с электронной формулой (что характерно для элементов с порядковыми номерами от 1 до 20):
16S – 1s2 2s2 2p6 3s2 3p4
Последним заполняется p-подуровень, поэтому сера принадлежит к p-электронному семейству; содержит 6 валентных электронов – 3s2 3p4. Представим схему размещения валентных электронов в квантовых (энергетических) ячейках:












 3s 3p 3d
3s 3p 3d
 16S - ...
16S - ...
 Валентность серы в нормальном состоянии равна 2, например, в соединениях H2S, Na2S, CaS.
Валентность серы в нормальном состоянии равна 2, например, в соединениях H2S, Na2S, CaS.
У атома серы на 3d-подуровне имеются вакантные орбитали. При возбуждении атома происходит разъединение пар электронов и переход их на свободные орбитали.
Представим электронные конфигурации атома серы в возбужденных состояниях:
3s 3р 3d
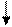

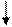

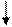


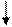

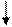




 а) 16S* - … ,
а) 16S* - … ,
16S* - … 3s23p33d1
Валентность серы равна 4, например, в соединениях SO2, H2SO3
3s 3p 3d














 б) 16S*- …
б) 16S*- …
S* - … 3s1 3p3 3d2
Валентность серы равна 6, например, в соединениях: SO3, H2SO4.
Вывод: валентность серы в соединениях 2, 4, 6.
Пример 2. Составьте электронную формулу атома титана и ионов титана Ti2+ и Ti4+. К какому электронному семейству относится титан? Приведите электронные аналоги титана.
Решение. Порядок заполнения энергетических уровней и подуровней следующий:
22Ti – 1s2 2s2 2p6 3s2 3p6 4s2 3d2
Титан принадлежит к d-электронному семейству.
Электронная формула титана имеет вид:
22Ti – 1s2 2s2 2p6 3s2 3p6 3 d2 4 s2
Подчеркнуты валентные электроны.
Электронно-графические формулы валентных электронов атома титана в нормальном и возбужденном состояниях:
3d 4s 4p 4d 4f…















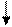
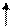

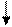
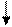



 22 Ti -…
22 Ti -…
Валентность титана в нормальном состоянии равна 2, например, в соединениях: TiO, TiCl2. Такая валентность обусловлена двумя неспаренными электронами, но вакантные орбитали на 4p-подуровне вносят дополнительный вклад в валентность и титан в некоторых соединениях проявляет валентность, равную 3, например, в соединении TiCl3.
При возбуждении атома титана происходит распаривание 4s-электронов и переход их на 4p-подуровень, валентность титана в этом состоянии равна 4 (TiO2, TiCl4):
3d 4s 4p 4d 4f..
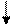
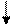





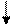

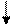









 22Ti*-…
22Ti*-…
22 Ti* - … 3d2 4s1 4p1 4d0 4f0
Сокращенная электронная формула атома титана:
22 Ti - … 3d2 4s2
Электронные аналоги титана:
40 Zr - … 4d2 5s2; 72 Hf - …5d2 6s2
Электронные формулы ионов титана Ti2+ и Ti4+ соответственно:
22Ti2+ - … 3d2 4s0; 22Ti4+ - … 3d0 4s0.
Контрольные задания
1. Структуры валентных электронных слоев выражаются формулами: а) 4s24p2; б) 5d46s2; в) 4s1. Составьте полные электронные формулы, определите порядковые номера, приведите названия элементов, определите принадлежность к электронным семействам.
2. Напишите электронные формулы атома кальция и иона Ca2+. Укажите валентность кальция в нормальном и возбужденном состояниях. Какие значения принимают кантовые числа для внешних электронов атома кальция?
3. Напишите электронные формулы атома ,бария и иона Ba2+. Укажите валентность бария в нормальном и возбужденном состояниях. Какие значения принимают кантовые числа для внешних электронов атома бария?
4. Напишите электронные формулы атома Te и иона Te2-. Докажите, что валентность теллура в соединениях 2, 4, 6.
5. Напишите электронные формулы атома железа, ионов Fe2+ и Fe3+. Докажите с помощью электронно-графической схемы, что максимальная валентность железа в соединениях равна 6.
6. Что такое изотопы? Приведите примеры изотопов какого-либо элемента, напишите электронную формулу изотопов этого элемента. Почему изотопы элемента имеют сходные химические свойства?
7. Определите по правилу Клечковского последовательность заполнения электронами энергетических подуровней, если n+l=7. Какой элемент имеет валентные электроны 7s2?
8. Напишите электронные формулы атома стронция и иона Sr2+. Укажите валентность стронция в нормальном и возбужденном состояниях. Какие значения принимают кантовые числа для внешних электронов атома стронция?
9. Напишите значения всех четырех квантовых чисел для трех любых электронов на 4p-подуровне. Значениями какого квантового числа различаются три электрона указанного подуровня? Почему максимальное число электронов на p-подуровне равно 6?
10. По какому признаку элементы подразделяются на электронные семейства? Напишите электронные формулы атомов любых двух элементов пятого периода, принадлежащих к разным электронным семействам. Какие электроны этих элементов являются валентными? Какой подуровень заполняется раньше: 5s или 4d? Почему?
11. Какое состояние атома называется основным и какое – возбужденным? Чем ион отличается от нейтрального атома? Ответы на вопросы подтвердите написанием электронных формул атома брома и бромид-иона. Изобразите электронно-графические схемы атома брома в нормальном и возбужденных состояниях.
12. Напишите электронные формулы атома водорода и ионов Н+, Н-. Какие элементарные частицы входят в состав атома водорода и ионов? Вычислите энергию связи электрона в электрон-Вольтах (эВ) на первой и пятой стационарных орбиталях атома водорода и сравните (<, >) их величины.
13. Структуры валентных электронных слоёв атомов элементов выражаются формулами:
а) 5s25p4; б) 3d54s1; в) 7s2. Определите порядковые номера, приведите названия элементов, а также укажите принадлежность к электронным семействам.
14. Составьте электронные формулы и электронно-графические схемы атомов элементов с порядковыми номерами 23 и 33 в нормальном и возбужденных состояниях. Приведите валентные электроны этих элементов и их электронных аналогов.
15. На примерах галлия и марганца докажите, что имеется взаимосвязь строения атомов элементов с положением их в периодической системе химических элементов Д.И. Менделеева.
16. Напишите электронные формулы и электронно-графические схемы атомов фосфора и ванадия в нормальном и возбужденном состояниях. К какому электронному семейству относится каждый из этих элементов?
17. На каком основании иттрий (Z=39) и индий (Z=49) помещены в одну группу периодической системы элементов Д.И. Менделеева? Почему они в разных подгруппах? Приведите валентные электроны этих элементов и их электронных аналогов.
18. Напишите электронные формулы атома Ba и иона Ba2+. Какую валентность проявляет барий в нормальном и возбужденном состояниях? Структуру какого инертного газа имеет ион Ba2+?
19. Напишите электронную формулу атома технеция. Укажите валентные электроны. Распределите валентные электроны по энергетическим ячейкам в нормальном и возбужденном состояниях. Определите суммарный спин электронов в возбужденном состоянии.
20. Напишите электронную формулу атома меди; учтите, что у меди происходит провал одного 4s электрона на 3d-подуровень. Приведите электронные формулы двух последних уровней электронных аналогов меди.
Дата: 2018-11-18, просмотров: 966.