Существует более 400 вариантов изображения периодической системы Д.И.Менделеева. Наиболее распространены клеточные варианты, из них: восьми (короткий) –, восемнадцати (полудлинный) – и тридцатидвухклеточный (длинный), соответствующие электронным слоям из 8, 18, и 32 электронов.
Периодическое изменение свойств элементов при увеличении порядкового номера объясняется тем, что периодически повторяется строение внешнего электронного слоя в атоме.
В периодической таблице можно выделить горизонтальные и вертикальные ряды – периоды и группы.
Период− это последовательность элементов, атомы которых имеют одинаковое число электронных слоев (энергетических уровней), это число равно номеру периода.
В пределах одного периода у s- и p-элементов идет заполнение внешнего слоя, у d-элементов – предвнешнего, у f-элементов – третьего снаружи. Поэтому наиболее сильно отличаются по свойствам соседние s-(p-)элементы. У d-и f-элементов отличия в свойствах проявляются незначительно. d- и f-Элементы одного периода объединяются в семейства по 10 и 14 элементов, соответственно. Семейство 4f-элементов называют лантаноидами, семейство 5f-элементов называют актиноидами.
Группа – вертикальный ряд элементов, состоящий из двух подгрупп.
Положение в группах s-и p-элементов определяется общим числом электронов внешнего слоя. Эти элементы составляют главную подгруппу (подгруппа А).
Положение в группах d–элементов определяется общим числом s –электронов внешнего и d – электронов предвнешнего слоев. d-Элементы образуют побочную, или подгруппу В.
Поведение простых веществ и химических соединений в различных реакциях зависит от размеров (радиусов) их атомов. Радиус атома – это расстояние от ядра атома до области наибольшей электронной плотности внешнего слоя.
Атомные радиусы в подгруппах периодической системы возрастают с увеличением порядкового номера элемента, поскольку увеличивается число электронных уровней (оболочек), а с ним и эффективный радиус атома, эта закономерность сохраняется и для d – элементов. В периодах с увеличением порядкового номера радиусы атомов, как правило, уменьшаются. Объясняется это тем, что в пределах одного периода число электронных уровней не изменяется, в то время как заряд ядра увеличивается, и облака внешних электронов все с возрастающей силой притягиваются к ядру.
У переходных элементов, лантаноидов и актиноидов (т.е. у всех d- и f- элементов) радиус атома в пределах периода изменяется мало. Объясняется это тем, что нарастание заряда у атомов этих элементов в значительной степени компенсируется соответствующим увеличением отрицательного заряда в предвнешнем слое электронов и внешние электроны не испытывают притяжения со стороны ядра по мере усложнения структуры атома.
От размера атома или образованного им иона в неменьшей степени, чем от заряда ядра, зависит лёгкость, с которой этот атом или ион теряет или приобретает электроны. Критерием этой лёгкости являются энергия (потенциал) ионизации, сродство к электрону и электроотрицательность.
Энергией ионизации ( I ) называется количество энергии, необходимое для отрыва электрона от невозбужденного атома и превращения его в ион Э+:
Э0 + I = Э+ + ē
Энергия ионизации атома сильно зависит от его электронной конфигурации. Завершенные слои проявляют повышенную устойчивость. Наименьшими значениями энергий ионизации обладают s-элементы первой группы (Li, Na, K). Энергии ионизации в пределах главных подгрупп с увеличением порядкового номера уменьшаются, а восстановительная способность (металличность) нейтральных атомов увеличивается. В периодах значение энергии ионизации, с возрастанием порядкового номера, увеличивается, а восстановительная способность нейтральных атомов уменьшается. Таким образом, среди s- и p- элементов наиболее сильные восстановители находятся слева внизу (лучший из них – франций), а наиболее слабые – справа вверху (особенно фтор, окислить который вообще не удается). В пределах декад переходных элементов (d- элементов), а также у лантаноидов и актиноидов (f- элементов) значение энергии ионизации с возрастанием порядкового номера постепенно увеличиваются, но незначительно, поскольку с возрастанием порядкового номера мало изменяются радиусы атома.
Сродством к электрону ( F) называется энергия, которая выделяется при присоединения электрона к нейтральному атому Э0 с превращением его в отрицательный ион Э−
Э0 + ē = Э− + F
Чем больше сродство к электрону, тем выше окислительная способность (неметалличность) данного атома. Наибольшим сродством к электрону обладают р-элементы VII группы. Наименьшее сродство к электрону имеют атомы с конфигурацией …s2 (Be, Mg, Zn) и …s2p6 (Ne, Ar, Kr). Это служит доказательством повышенной устойчивости указанных электронных конфигураций.
Понятие электроотрицательности (ЭО) позволяет оценить способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения. Эта способность связана с энергией ионизации и сродства к электрону. Мерой электроотрицательности является полусумма его энергии ионизации и сродства к электрону (табл.3),:
ЭО = ½ ( I + F).
Чем выше значение ЭО для данного элемента, тем более выражены его неметаллические свойства, тем больше способность его атомов притягивать облака связевых электронов и приобретать отрицательный эффективный заряд.
Из вышесказанного следует, что в периоде, вследствие увеличения заряда ядра, усиливается притяжение электронов ядром, что приводит к (см.таблицу 2)
- уменьшению радиуса атома,
- увеличению энергии ионизации,
- увеличению сродства к электрону,
- увеличению электроотрицательности,
- уменьшению металличности,
- увеличению неметалличности.
Таблица 3
| Эл-ты | 3Li | 4Be | 5B | 6C | 7N | 8O | 9F | 10Ne |
| r, нм | 0,155 | 0,113 | 0,091 | 0,077 | 0,071 | 0,060 | 0,072 | 0,160 |
| I, эВ | 5,39 | 9,32 | 8,30 | 11,26 | 14,53 | 13,62 | 17,42 | 21,56 |
| F, эВ | 0,59 | -0,19 | 0.30 | 1,27 | -0,21 | 1,47 | 3,45 | -0,57 |
| ЭО**) | 1,0 | 1,53 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | - |
**) шкала электроотрицательности по Полингу.
В группе (сверху вниз) увеличение заряда ядра и увеличение количества электронных слоев приводит к увеличению атомного радиуса и ослаблению силы притяжения ядром электронов, что приводит к (см. таблицу 4):
- уменьшению энергии ионизации,
- уменьшению сродства к электрону,
- уменьшению электротрицательности,
- увеличению металличности,
- уменьшению неметалличности.
Таблица 4
| Эл-ты | r, нм | I, эВ | F, эВ | ЭО |
| 3Li | 0,155 | 5,39 | 0,59 | 1,0 |
| 11Na | 0,189 | 5,14 | 0,34 | 0,91 |
| 19K | 0,236 | 4,34 | 0,50 | 0,81 |
| 37Rb | 0,248 | 4,18 | 0,60 | 0,80 |
| 55Cs | 0,268 | 3,89 | 0,39 | 0,72 |
| 87Fr | 0,280 | 3,98 | - | - |
Примеры решения задач
Пример 1. Какой элемент 4 периода – марганец или бром проявляет металлические свойства?
Решение. Полные электронные формулы элементов:
25Mn – 1s22s22p6 3s23p63d54s2
35Br – 1s22s22p6 3s23p6 3d10 4s24p5
Марганец является d-элементом VIIB подгруппы, а бром – p-элемент VIIA подгруппы. На внешнем энергетическом уровне у атома марганца два электрона, а у атома брома – семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а, следовательно, способны терять электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов.
Элементы, атомы которых на внешнем энергетическом уровне содержат более трех электронов, обладают в основном сродством к электрону, а, следовательно, приобретают отрицательную степень окисления и образуют элементарные отрицательные ионы.
Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома более свойственна окислительная функция. Общей закономерностью для всех групп, относящихся к d-электронному семейству, является преобладание металлических свойств. Следовательно, металлические свойства проявляет марганец.
Пример 2. Как зависят кислотно-основные свойства оксидов и гидроксидов от степени окисления образующих из атомов? Какие гидроксиды называются амфотерными (амфолитами)?
Решение. Если элемент проявляет переменную степень окисления и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства их изменяются от основных к амфотерным и кислотным. Например: оксиды и гидроксиды хрома, марганца, ванадия и др. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э-О и О-Н может протекать по двум направлениям:
основному - ЭОН D Э+ + ОН- или
кислотному - ЭОН D ЭО - + Н+
Полярность связей, в свою очередь, определяется разностью электроотрицательностей и эффективными зарядами атомов. Приводим пример диссоциации амфотерных гидроксидов (амфолитов):
Эn+ + nОН- D Э(ОН)n ; НnЭОn D nН+ + ЭОn-
основной тип кислотный тип
диссоциации диссоциации
В кислой среде амфолит проявляет основной, а в щелочной среде – кислотный характер.
Рассмотрим амфотерные свойства оксидов и гидроксидов хрома.
Приводим сокращенную электронную формулу атомов хрома: 24Cr - … 3d54s1.
Хром образует оксиды: Cr+2O, Cr2+3O3, Cr+6O3, которым соответствуют следующие гидроксиды:
Cr+2 (OH)2, Cr+3 (OH)3, H2Cr+6 O4 и H2Cr+62 O7.
Для CrO и Cr(OH)2 характерны основные свойства, для Сr2O3 и Cr(OH)3 – амфотерные свойства, для CrO3, H2CrO4 и H2Cr2O7 – кислотные свойства.
Докажем амфотерные свойства тригидроксида хрома:
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6];
Cr(OH)3 + 3OH- = [Cr(OH)6]3-.
В данной реакции Cr(OH)3 проявляет кислотные свойства.
Cr(OH)3 + 3HCl = CrCl3 + 3H2О,
Cr(OH)3 + 3H+ = Cr3+ + 3H2O.
В данной реакции Cr(OH)3 проявляет основные свойства.
Контрольные задания
21. Составьте формулы оксидов и гидроксидов марганца. Как изменяется кислотно-основной и окислительно-восстановительный характер этих соединений? Подчиняются ли эти соединения общей закономерности изменения свойств оксидов и гидроксидов?
22. Исходя из положения хрома, селена, углерода и серы в периодической системе, определите, какая из кислот является более сильным окислителем: а) H2CrO4 или H2SeO4, б) H2CO3 или H2SO3.
23. У какого элемента наибольшая энергия ионизации: а) Sr или Cd; б) Rb или Ag? У какого элемента наибольшая электроотрицательность: а) As или Sb; б) As или Br?
24. Какую высшую и низшую степени окисления проявляют вольфрам, теллур, серебро в соединениях? Почему? Составьте формулы соединений, отвечающих этим степеням окисления и изобразите их структурные формулы.
25. Приведите современную формулировку периодического закона. Объясните, почему в периодической системе элементов аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, йодом и протактинием, хотя имеют бóльшую атомную массу. Как называются пары таких элементов?
26. Исходя из положения металлов в периодической системе, определите, какой из двух гидроксидов является более сильным основанием: а) KOH или Mn(OH)2; б) Zn(OH)2 или Сa(OH)2; в) Mg(OH)2 или Be(OH)2.
27. Исходя из положения технеция, селена, цезия в периодической системе, составьте формулы следующих соединений: технециевой кислоты, оксида селена, гидрокарбоната цезия, отвечающих их высшей степени окисления. Изобразите структурные формулы соединений.
28. Исходя из положения серы, фосфора и хлора в периодической системе, определите, как изменяются окислительные свойства кислот: H2SO4, H3PO4, HClO4?
29. В ряду кислородных кислот хлора: HClO – HСlO2 – HСlO3 - HClO4 определите, какая из кислот наиболее сильный окислитель, какая из кислот наиболее сильный электролит.
30. На основании строения атомов лития и бериллия поясните, почему первый потенциал ионизации у лития меньше, чем у бериллия, а второй потенциал ионизации лития больше, чем у бериллия?
31. Какие элементы принадлежат к f–электронному семейству? На примерах строения атомов двух любых лантаноидов (или актиноидов) докажите, что химические свойства в группах лантаноидов (или актиноидов) близки друг к другу.
32. Как изменяются кислотно-основные свойства оксидов и гидроксидов в периодах с увеличением порядковых номеров элементов? Ответ мотивируйте строением атомов элементов и величин их важнейших характеристик: радиусов атомов и электроотрицательностей.
33. Составьте формулы оксидов и гидроксидов ванадия. Как изменяется кислотно-основной и окислительно-восстановительный характер этих соединений?
34. Исходя из строения атомов элементов, определите, какое основание более сильное:
а) Sr(OH)2 или Fe(OH)2; б) Cu(OH)2 или KOH; какая кислота более сильная: а) H3AsO4 или H2SeO4; б) HClO4 или HMnO4.
35. Какую высшую и низшую степени окисления проявляют молибден, йод и цирконий? Почему? Составьте формулы соединений, отвечающих этим степеням окисления и изобразите их структурные формулы.
36. Как изменяется прочность связи между атомами в молекулах галогенов Cl2 – Br2 – J2? Почему молекула F2 выпадает из общей закономерности?
37. Как изменяются металлические свойства в VВ подгруппе периодической системы? Ответ мотивируйте, исходя из строения атомов элементов и величин важнейших их характеристик: радиусов атомов и энергий ионизации.
38. Исходя из положения галогенов в периодической системе, поясните, как изменяются восстановительные свойства в ряду HCl – HBr – HJ. Почему HF входит в исключение?
39. Как изменяются неметаллические свойства в VIА подгруппе периодической системы? Ответ мотивируйте, исходя из строения атомов элементов и величин важнейших их характеристик: радиусов атомов и электроотрицательностей.
40. В какой степени окисления галогены и элементы подгруппы марганца проявляют наибольшее сходство в свойствах? Приведите примеры сходных соединений.
V. III ХИМИЧЕСКАЯ СВЯЗЬ
Под химической связью понимают явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением энергии системы, а уменьшение энергии системы приводит к увеличению её устойчивости.
Условия образования химической связи :
1. Энергетический выигрыш.
2. Антипараллельные спины электронов в связывающей молекулярной орбитали.
3. Перекрывание электронных облаков связывающихся частиц.
Важными характеристиками химической связи являются прочность и длина.
Энергия связи (Есвязи; кДж/моль) – мера её прочности, определяется работой, необходимой для разрыва связей или тепловым эффектом при образовании молекулы.
H + H → H2 + 435 кДж/моль
или
H2 → H + H – 435 кДж/моль
Под длиной связи (ℓ; нм, Ǻ ) понимают расстояние между центрами ядер атома в молекуле или кристалле. Угол между воображаемыми линиями, проходящими через ядра химически связанных атомов, называется валентным.
Например, в молекуле воды длина связи О – Н составляет 0,096 нм, а валентный угол – 104,50 .
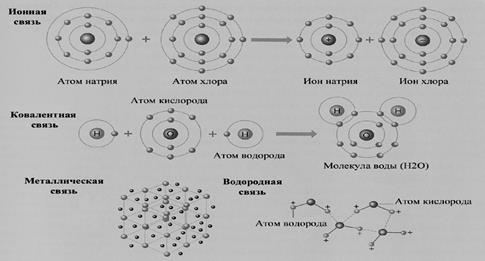 |
Химическая связь образуется в том случае, когда электроны оказываются вблизи двух или нескольких ядер, благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов. Процесс этого взаимодействия может протекать различным образом. Поэтому в настоящее время различают три основных типа химических связей: ковалентную, ионную и металлическую.
Химическая связь, осуществляемая общими электронными парами, называется ковалентной. Ковалентная связь двухэлектронная и двухцентровая (удерживает два ядра). Различают две ее разновидности: неполярную и полярную.
В случае ковалентной неполярной связи электронное облако, образованное общей электронной парой, распределяется в пространстве симметрично относительно ядер обоих атомов (например, в молекулах Н2, О2 , Cl2, N2, F2 ).
H∙ + ∙H → H : H ( H + H → H-H)
:Cl∙ + ∙Cl: → :Cl : Cl: ( Cl + Cl → Cl−Cl )
В случае ковалентной полярной связи электронное облако смещено к атому с большей электроотрицательностью (∆Э O < 1,7). Например, в молекулах HCl, CO, SO2, электронная пара связи смещается в сторону более электроотрицательного атома, у которого возникает частичный отрицательный заряд (δ-). У менее электроотрицательного атома возникает частичный положительный заряд (δ+). Между центрами зарядов в молекуле возникает некоторое расстояние. Такие молекулы называют дипольными или диполями, а смещение электронов связи называется поляризацией связи.
H∙+ ∙Cl → H : Cl
∆Э O = Э O(Cl) − Э O(Н) = 3,0 − 2,1 = 0,9
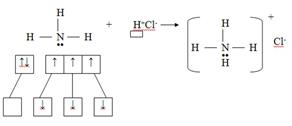
Способ образования ковалентной связи, когда каждый из взаимодействующих атомов предоставляет электроны для образования общих электронных пар, называется обменным. Механизм образования ковалентной связи за счёт неподелённой электронной пары донора и свободной орбитали акцептора называется донорно-акцепторным. Например, при образовании катиона аммония атом азота (донор) предоставляет готовую (неподелённую) электронную пару, а атом водорода (акцептор) – свободную орбиталь.
Ковалентная связь характеризуется направленностью и насыщаемостью.
Насыщаемость обусловлена тем, что число перекрываний электронных облаков ограничено числом неспаренных электронов. Поскольку электронные облака направлены в пространстве (кроме s-), то и химические связи, образованные с их участием, пространственно направлены.
Электронные облака имеют различную форму, их взаимное перекрывание может осуществляться разными способами. Различают σ(сигма)- и π(пи)- связи.
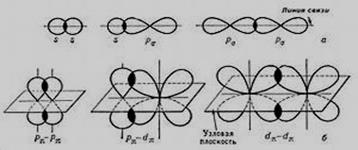 |
σ−связь осуществляется при перекрывании атомных орбиталей вдоль линии соединения атомов. π-связь осуществляется при перекрывании атомных орбиталей по обе стороны от линии соединения центров атомов (рис. 3).
Рис.3
Степень перекрывания π-связи значительно меньше, чем σ-связи, и, следовательно, π-связь менее прочная, чем σ-связь. Одинарные связи образуются только за счет σ-связей, а кратные связи могут иметь и π-связи. Кратные связи – это ковалентные связи, образованные более чем одной парой электронов. Увеличение кратности связи приводит к упрочению межатомной связи и к уменьшению длины связи
Н3С-СН3 Есвязи(С_С) = 85 кДж/моль; l(С_С) = 1,543 Ǻ
Н2С=СН2 Есвязи(С=С) = 145 кДж/моль; l(С=С) = 1,353 Ǻ
НС≡СН Есвязи(С≡С) = 198 кДж/моль; l(С≡ С) = 1,205 Ǻ
Для объяснения пространственного строения молекул используется представление о гибридизации валентных орбиталей в атоме в процессе образования им химических связей.
Под гибридизацией понимают процесс перестройки неравноценных по форме и энергии электронных облаков, приводящий к образованию гибридных облаков, одинаковых по форме и энергии. При этом число гибридных орбиталей равно числу исходных.
При гибридизации электронная энергия атома увеличивается (энергетически невыгодный процесс), но затрата энергии компенсируется с избытком по следующим причинам:
1. Гибридные орбитали из-за своей большей вытянутости в направлении связей полнее и глубже перекрываются с орбиталями связываемого атома, поэтому связи получаются более прочными и достигается бóльший выигрыш в энергии.
2. При возбуждении один из спаренных валентных электронов переходит на другую гибридную орбиталь, то есть увеличивается ковалентность атома (количество неспаренных электронов) и, следовательно, количество химических связей (энергетически выгодный процесс).
В зависимости от числа участвующих в гибридизации орбиталей различают следующие типы:
· sp-гибридизация – «смешение» одной s-орбитали и одной p-орбитали с образованием двух sp-гибридных орбиталей, расположенных под углом 180о друг к другу.
· sp2-гибридизация - «смешение» одной s-орбитали и двух p-орбиталей с образованием трех sp-гибридных орбиталей, расположенных под углом 120о друг к другу.
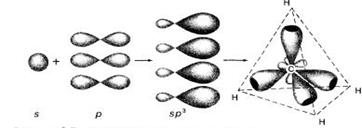
· sp3-гибридизация - «смешение» одной s-орбитали и трех p-орбиталей с образованием четырех sp-гибридных орбиталей, расположенных под углом 109o28’ друг к другу(рис.4).
Рис.4
 |
Ионная связь – химическая связь между атомами, резко отличающимися по электроотрицательности (∆Э O > 1,7). Взаимодействие сопровождается переносом электрона от менее электроотрицательного атома к более электро-отрицательному атому.
Na∙ + ∙Cl → Nа :Cl ( Na+Cl− )
∆ЭО = ЭО(Cl) − ЭО(Na) = 3,0 – 0,9 = 2,1
Атом, присоединивший электрон, становится отрицательно заряженным ионом (Cl−) − анионом; атом, отдавший электрон, становится положительно заряженным ионом (Na+) – катионом. Между ионами возникает электростатическое взаимодействие с образованием нейтральных молекул. Ион является точечным электрическим зарядом, у которого, по закону Фарадея, электрическое поле по всем направлениям одинаково. Поэтому ионная связь обладает ненаправленностью и ненасыщаемостью, в отличие от ковалентной связи.
Металлическая связь – химическая связь между атомами или ионами металла и относительно свободными общими валентными электронами («электронным газом»). В кристалле металла постоянно происходит обмен электронами потому, что у атомов много свободных валентных орбиталей и электроны слабо притягиваются ядрами атомов. Эти орбитали отдельных атомов перекрываются друг с другом, обеспечивая электронам способность свободно перемещаться между ядрами во всем объёме металла. В кристаллической решетке металлов электроны обобществлены. Они непрерывно перемещаются между положительно заряженными ионами, которые расположены в узлах кристаллической решетки. При этом сравнительно небольшое число обобществленных электронов связывает большое число ионов.
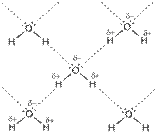 Водородная связь – химическая связь между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом с неподеленной электронной парой (F, O, N) другой молекулы. Эта связь является разновидностью донорно-акцепторного взаимодействия, которая обуславливает её направленность. Процесс образования водородной связи при взаимодействии молекул воды можно представить схемой:
Водородная связь – химическая связь между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом с неподеленной электронной парой (F, O, N) другой молекулы. Эта связь является разновидностью донорно-акцепторного взаимодействия, которая обуславливает её направленность. Процесс образования водородной связи при взаимодействии молекул воды можно представить схемой:
Энергия водородной связи составляет 8-40 кДж/моль, т.е. на порядок меньше энергии ковалентной связи, но этой энергии достаточно для ассоциации молекул.
Примеры решения задач
Пример 1. Объясните механизм образования молекулы SiF6 и иона [SiF6]2-
Решение. Приводим электронную формулу атома кремния: 14Si-1s2 2s2 2p6 3s2 3p2
Приводим графическую схему распределения электронов по энергетическим ячейкам в:
а) невозбужденном состоянии
3s 3p … 3d







 14Si -…
14Si -…
…….


3s 3p 3d







 б) при возбуждении 14Si* ……
б) при возбуждении 14Si* ……
Четыре неспаренных электрона возбужденного атома кремния могут участвовать в образовании четырех ковалентных связей с атомами фтора (9F – 1s2 2s2 2p5), имеющему по одному неспаренному электрону с образованием молекулы.
Для образования иона [SiF6]4- к молекуле SiF4 присоединяются два иона F- (1s2 2s2 2p6), все валентные электроны которых спарены. Связь осуществляется по донорно-акцепторному механизму за счет пары электронов каждого из фторид-ионов и двух валентных 3d-орбиталей атома кремния.
Контрольные задания
41. Что называется кратностью связи? Приведите примеры соединений, содержащих ординарные, двойные и тройные связи. Отметьте s- и p-связи в структурных формулах приведенных молекул.
42. Охарактеризуйте типы кристаллических структур по природе частиц узлов решеток. Какие кристаллические структуры имеют: CO2, CH3COOH, алмаз, графит, NaCl, Zn?
43. Почему существует молекула PCl5, но не существует молекула NCl5, хотя азот и фосфор находятся в одной и той же подгруппе VA периодической системы? Какой тип связи между атомами фосфора и хлора? Укажите тип гибридизации атома фосфора в молекуле PCl5.
44. Какая химическая связь называется ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите примеры молекул с типично ионными связями и укажите тип кристаллической решетки. Составьте изоэлектронный ряд ксенона.
45. Какая связь называется s- и какая - p-связью? Какая из них менее прочная и более реакционноспособная? Изобразите структурные формулы этана C2H6, этилена C2H4 и ацетилена C2H2. Отметьте s- и p-связи на структурных схемах углеводородов.
46. Какой тип гибридизации в молекулах CCl4, H2O, NH3 ? Изобразите в виде схем взаимное расположение гибридных облаков и углы между ними.
47. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа ABn, если связь в них образуется за счет sp-, sp2-, sp3- гибридизации орбиталей атома A ? Приведите примеры молекул с указанными типами гибридизации.
48. На основании строения атомов в нормальном и возбужденном состояниях определите ковалетность бериллия и углерода в молекулах BeCl2, (BeCl2)n, CO и CO2. Изобразите структурные формулы молекул.
49. На основании строения атомов в нормальном и возбужденном состояниях определите ковалентность лития и бора в соединениях: Li2Cl2, LiF, [BF4]-, BF3.
50. Какая химическая связь называется водородной? Приведите три примера соединений с водородной связью. Изобразите структурные формулы приведенных ассоциатов. Как влияет образование водородной связи на свойства веществ (вязкость, температуры кипения и плавления, теплоты плавления и парообразования, диэлектрическую постоянную)?
V. IV ЭНЕРГЕТИКА ХИМИЧЕСКИХ
ПРОЦЕССОВ
Науку о взаимных превращениях различных видов энергии называют термодинамикой.
При химических реакциях происходят глубокие качественные и количественные изменения в системах: рвутся связи в исходных веществах, возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота.
Раздел термодинамики, изучающий тепловые эффекты химических реакций, называют термохимией. Реакции, которые сопровождаются выделением теплоты, называют экзотермическими, а поглощением теплоты - эндотермическими.
При любом процессе соблюдается закон сохранения энергии, как проявление более общего закона природы – закона сохранения материи. Согласно первому закону химической термодинамики теплота Q, поглощённая системой, идет на изменения ее внутренней энергии Δ U и на совершение работы A:
Q = ΔU + A
Энтальпия системы H – это величина, равная сумме внутренней энергии U произведения объёма на давление:
H = U + pV
QP, T – тепловой эффект реакции в изобарно-изотермическом процессе равен изменению энтальпии системы ΔН (если единственным видом работы является работа расширения):
Qp,Т = ΔН
Энтальпия, как и внутренняя энергия, является функцией состояния: ее изменение ΔН определяется только начальным и конечным состояниями системы и не зависит от пути перехода.
Теплота химического процесса в изобарно-изотермических условиях называется тепловым эффектам химической реакции.
Термохимические расчеты основаны на законе
Г.И. Гесса (1840 г.):
Дата: 2018-11-18, просмотров: 947.