Принцип Ле Шателье
Состояние химического равновесия зависит от температуры, давления, концентрации реагентов. Изменение даже одного фактора приводит к смещению равновесия. Влияние этих факторов описывается
принципом смещения равновесия Ле Шателье:
при всяком внешнем воздействии на систему, находящуюся в состоянии химического равновесия, равновесие смещается в таком направлении, которое приводит к ослаблению этого воздействия.
Основные выводы из принципа Ле Шателье:
1. Равновесие смещается вправо при увеличении концентраций исходных веществ и уменьшении концентраций продуктов реакции. Равновесие смещается влево при уменьшении концентрации исходных веществ и увеличении концентрации продуктов реакции.
2. При повышении температуры равновесие смещается в сторону эндотермической реакции, а при понижении – в сторону экзотермической реакции.
3. При увеличении давления равновесие смещается в сторону уменьшения объёма, т.е. уменьшения числа молей газа, а при уменьшении давления – в сторону увеличения числа молей газа.
Для примера рассмотрим равновесную газовую систему:
N2(г) + 3H2(г)  2NH3(г).
2NH3(г).
Согласно закону смещения, уменьшение концентрации одного из компонентов вызовет сдвиг химического равновесия в сторону образования компонента.
Уменьшение концентрации азота или водорода вызовет смещение равновесия в сторону разложения аммиака.
Уменьшение концентрации N2 или H2
<――――――――――――――――――
N2 + 3H2  2NH3
2NH3
――――――――――――――――――>
Увеличение концентрации N2 или H2
При повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении – в сторону экзотермической реакции.
экзотермический процесс (понижение температуры)
――――――――――――――――>
N2 + 3H2  2NH3 <―――――――――――――――
2NH3 <―――――――――――――――
эндотермический процесс (повышение температуры)
При увеличении давления равновесие смещается в сторону реакции, приводящей к образованию меньшего числа молекул, при уменьшении давления – наоборот.
Увеличение давления (уменьшение общего числа молекул в равновесной системе)
―――――――――――――――――>
N2(г) + 3H2(г)  2NH3(г)
2NH3(г)
<―――――――――――――――――
уменьшение давления (увеличение общего числа молекул в равновесной системе)
Если в процессе обратимой реакции общее число молекул не меняется, изменение давления не влияет на состояние химического равновесия газовой системы. Например, реакция, протекающая по уравнению
H2(г) + I2(пар)  2HI
2HI
не сопровождается изменением общего числа молекул газа в системе.
Примеры решения задач
Пример 1. Константа равновесия гомогенной системы
СО (г)+Н2О (г) ↔СО2 (г)+Н2 (г)
при 850°С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: ( 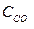 )исх.=З моль/л, (
)исх.=З моль/л, ( 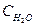 )исх.=2 моль/л.
)исх.=2 моль/л.
Решение. При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей называется константой равновесия данной системы и выражается через равновесные концентрации участников реакции следующим образом:
Кравн. = 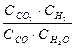
В условии задачи даны исходные концентрации тогда как в выражение Кравн. входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации ( 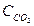 )равн.== х моль/л. Согласно уравнению реакции:
)равн.== х моль/л. Согласно уравнению реакции:
х моль х моль х моль х моль
СО (г)+Н2О (г) ↔ СО2 (г)+Н2 (г)
1моль 1моль 1моль 1моль
число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ будут:
( 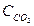 )равн. = (
)равн. = ( 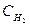 )равн. = х моль/л;
)равн. = х моль/л;
( 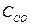 )равн. = (З — х) моль/л;
)равн. = (З — х) моль/л;
( 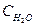 )равн. = (2 — х) моль/л.
)равн. = (2 — х) моль/л.
Зная константу равновесия, находим значение х, а затем и исходные концентрации всех веществ:
1 = 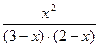 ,
,
Отсюда х = 1,2 моль/л. Таким образом, равновесные концентрации участников реакции:
( 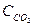 )равн. = (
)равн. = ( 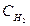 )равн. =1,2 моль/л; (
)равн. =1,2 моль/л; ( 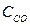 )равн. = (З — 1,2) = 1,8 моль/л;
)равн. = (З — 1,2) = 1,8 моль/л;
( 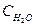 )равн. = (2 — 1,2) = 0,8 моль/л.
)равн. = (2 — 1,2) = 0,8 моль/л.
Пример 2. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
РСl5 (г) ↔РСl3 (г) + С12 (г);∆Hх.р. = + 92,59 кдж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения РСl5?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье:
а) так как реакция разложения РСl5 эндотермическая (∆Нх.р.>0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение РСl5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление;
в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РСl5 так и уменьшением концентрации РСl3 или С12.
Пример 3. Равновесие в системе H2(г)+ I2(г)↔ 2HI(г) установилось при следующих концентрациях участников реакции: HI – 0,05 моль/л, водорода и иода – по 0,01моль/л. Как изменятся концентрации водорода и иода при повышении концентрации HI до 0,08моль/л?
Решение. Зная равновесные концентрации участников реакции, можно рассчитать константу равновесия данной реакции:
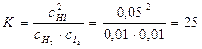 ;
;
При повышении концентрации HI до 0,08моль/л равновесие сместится в обратном направлении, т.е.более интенсивно начнет протекать обратная реакция
хмоль хмоль 2хмоль
H2(г)+ I2(г) ↔ 2HI(г)
1моль 1моль 2моль
Если убыль HI к моменту достижения нового состояния равновесия принять равной 2х моль, то прирост концентраций Н2 и I2 к этому моменту составит х моль; подставив новые равновесные концентрации в выражение для константы равновесия, получим:
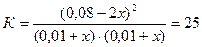 , откуда х = 0,004,
, откуда х = 0,004,
и новые равновесные концентрации Н2 и I2 составят (0,01+0,004) = 0,014 моль/л.
Контрольные задания
71. В каком направлении сместится равновесие системы
СО(г) + 3 Н2(г) ↔ СН4(г) + Н2О(г); ΔНо298<0
а) при повышении температуры; б) введении катализатора; в)понижении давления? Напишите выражение константы равновесия данной реакции.
72. Исходные концентрации монооксида углерода и водяного пара в системе:
СО + Н2О ↔ СО2 + Н2
составляли соответственно 0,09 и 0,03 моль/л. К моменту равновесия прореагировало 22% СО. Найдите равновесные концентрации остальных участников реакции и константу равновесия. Ответ:0,02моль/л;0,07моль/л;0,01моль/л;0,57.
73. Восстановление Fe2O3 водородом протекает по уравнению
Fe2O3(к) + 3 H2(г) ↔ 2 Fe(к) + 3 H2O(г) ; ΔНо298 = +98,6 кДж
В каком направлении сместится равновесие системы а) при уменьшении температуры;
б) увеличении концентрации водорода; в)понижении давления? Напишите выражение константы равновесия данной реакции.
74. При 494оС константа равновесия реакции 2NО (г) +О2 (г) ↔ 2NО2 (г) равна 2,2. Равновесные концентрации NО и О2 соответственно равны 0,020 и 0,030 моль/л. Вычислите их исходные концентрации. Ответ: 0,025 моль/л; 0,0325 моль/л.
75. Как повлияет на выход SO2 в системе:
SO3(г) + C(к) ↔ SO2(г) + CO(г)
а) уменьшение общего объема смеси; б) уменьшение концентрации SO3; в) введение катализатора?
76. Исходная концентрация метана СН4 в системе СН4(г) ↔ С(к) + 2 Н2(г) составила 0,035 моль/л. К моменту равновесия прореагировало 80 % метана. Рассчитайте значение константы равновесия. Ответ: 0,112.
77. В каком направлении будет смещаться равновесие системы 2 СО2(г) ↔ 2 СО (г) + О2 (г) ; ΔНо298 = + 566 кДж
при: а) увеличении давления в системе; б) увеличении концентрации СO; в) введении катализатора; г) уменьшении температуры? Напишите выражение константы равновесия данной реакции.
78. При каких условиях равновесие реакции
MnO2(к) + 4HCl(г) ↔ MnCl2(к) + Cl2(г)
будет смещаться в сторону образования Cl2? Напишите выражение константы равновесия данной реакции.
79. Напишите выражение для константы равновесия гомогенной системы
СН4(г) + СО2(г) ↔ 2 СО(г) + 2 Н2(г) ΔНо298>0;
Как следует изменить температуру и давление, чтобы увеличить выход водорода? Как повлияет на величину выхода водорода увеличение концентрации СО?
80. Константа равновесия системы СCl4(г) ↔ 2Cl2 (г) +C (к) при температуре 700 К составляет 0,77. Начальная концентрация СCl4 равна 3,2 моль/л. Рассчитайте равновесные концентрации участников реакции. Ответ:2,5 моль/л; 1,4 моль/л.
V. VII РАСТВОРЫ
Дата: 2018-11-18, просмотров: 693.