Министерство сельского хозяйства Российской Федерации
федеральное государственное бюджетное образовательное
учреждение высшего профессионального образования
«Казанская государственная академия
ветеринарной медицины имени Н.Э. Баумана»
Кафедра биологической и неорганической химии
Неорганическая химия
Методические указания и контрольные задания
для студентов заочной формы обучения
( направления подготовки 111100 «зоотехния», 110900 «технология производства и переработки сельскохозяйственной продукции», 221700 «стандартизация и метрология» , (квалификация «бакалавр»), по специальности 111801 «ветеринария», (квалификация «специалист»).
Казань 2013
ББК 24 (Я 7)
УДК 54 (072)
Печатается по решению Ученого совета факультета биотехнологии и стандартизации ФГБОУ ВПО «Казанская государственная академия ветеринарной медицины имени Н.Э. Баумана» от 21 июня 2013 года, протокол № 6
Рецензенты:
старший преподаватель кафедры общей и органической химии КГМУ, к.х.н. И.В. Федюнина;
доцент кафедры патологической физиологии КГАВМ, к.в.н. Ф.А. Медетханов.
Алимов, А.М.
Неорганическая химия. Методические указания и контрольные задания для студентов заочной формы обучения (направления подготовки 111100 «зоотехния», 110900 «технология производства и переработки сельскохозяйственной продукции», 221700 «стандартизация и метрология», (квалификация «бакалавр»), по специальности 111801 «ветеринария», (квалификация «специалист») /А.М. Алимов, Р.Н. Зиятдинов, Е.Ю. Микрюкова. –Казань: ФГБОУ ВПО КГАВМ, 2013. – 145 с.
Методические указания содержат задания по 13-ти разделам курса общей и неорганической химии и весь необходимый материал для выполнения контрольных работ студентами-заочниками.
Подготовлено на кафедре биологической и неорганической химии ФГБОУ ВПО КГАВМ.
УДК 54 (072)
ББК 24 (Я 7)
ã Алимов А.М., Зиятдинов Р.Н., МикрюковаЕ.Ю.
ã федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Казанская государственная академия ветеринарной
медицины Н.Э. Баумана», 2013
I. ОБЩИЕ ПОЛОЖЕНИЯ
ПО ВЫПОЛНЕНИЮ КОНТРОЛЬНЫХ РАБОТ
В соответствии с Государственным стандартом высшего профессионального образования и рабочими программами по специальностям основными целями обучения студентов – заочников по дисциплине «Химия» являются, прежде всего, приобретение навыков решения задач, относящихся к теоретическому курсу или лабораторно - практическим работам. Выполнение студентами контрольных работ является необходимым условием допуска к зачёту или экзамену.
В одной контрольной работе содержится 20 заданий по всем разделам курса неорганической химии. Номер варианта контрольной работы соответствует двум последним цифра номера зачётной книжки, например, 6100 – вариант 00; 6102 – вариант 02.
Студенты, получившие допуск к собеседованию, должны устранить все указанные рецензентом недоработки. Работы, выполненные неудовлетворительно, возвращаются на доработку. При этом преподаватель в рецензии отмечает те вопросы, которые нуждаются в доработке. До предэкзаменационного собеседования студент должен в конце своей работы письменно провести работу над ошибками с указанием номера задания. Собеседование по выполненным контрольным работам может проводиться как до, так и непосредственно в ходе предусмотренных расписанием консультацией, зачётом и / или экзаменом. После прохождения собеседования преподаватель на титульном листе (или обложке) контрольного задания проставляет отметку «зачтено после собеседования» с указанием своей подписи и даты.
II. ОФОРМЛЕНИЕ КОНТРОЛЬНЫХ РАБОТ
Первым листом контрольной работы является титульный лист, на котором вверху приводится аббревиатура вуза, а ниже указываются номера работ, фамилия и инициалы студента, номер его зачётной книжки, курс и обозначение специальности, а также фамилия и инициалы преподавателя, проверяющего работу. В нижней части титульного листа проставляются город и год выполнения работы.
Содержание контрольной работы включает номера, условия заданий, их решения. Последние, в случае количественного характера задачи, включают необходимые пояснения и исходные выражения с указанием проверки размерностей в полученном результате. В заданиях количественного характера должна в сжатом виде содержаться информация с исчерпывающим ответом на поставленные вопросы. При изложении решений и ответов на вопросы заданий рекомендуется пользоваться общепринятыми в учебной химической литературе терминологией и символикой, а также данными из таблиц, указанных в Приложениях в конце методических указаний. Рекомендуется использовать также литературу, указанную в библиографическом списке. Список использованной литературы, включающий настоящую методичку, приводится после выполненных заданий, где указываются также подпись исполнителя и дата.
III. ПРОГРАММА ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ПО ХИМИИ
Основные химические понятия: моль, атомная масса, молярная масса. Основные химические законы, закон Авогадро, уравнение состояния идеального газа Менделеева-Клапейрона. Эквивалент, закон эквивалентов. Основные классы неорганических соединений. Расчет эквивалентных масс простых веществ и сложных соединений.
Периодический закон Д.И. Менделеева. Строение атома. Состав атома. Электронные оболочки атомов. Квантовые числа. Порядок заполнения электронных оболочек : принцип Паули, правило Гунда, правила Клечковского. Электронные семейства элементов. Периодическая система элементов Менделеева. Энергия ионизации, сродство к электрону, электроотрицательность, степень окисления элементов. Изменение радиусов, металлических, кислотно-основных и окислительно-восстановительных свойств элементов.
Химическая связь. Основные характеристики связи: энергия, длина, угол связи. Метод валентных связей. Основные характеристики ковалентной связи: направленность, кратность, полярность, насыщаемость. Дипольный момент молекул. Возбужденное состояние атома и гибридизация атомных орбиталей. Донорно-акцепторный механизм образования ковалентной связи. Понятие о методе молекулярных орбиталей. Ионная связь, ее отличие от ковалентной связи.
Химическая термодинамика. Основной закон термодинамики. Основные понятия. Внутренняя энергия и энтальпия. Термохимические законы: закон Гесса, следствие из него. Стандартная теплота образования. Понятие об энтропии. Изменение энтропии в химических процессах и фазовых переходах. Энергия Гиббса. Направленность химических процессов. Расчет изменения энтропии и энергии Гиббса в химических реакциях.
Химическая кинетика. Скорость гомогенных химических реакций и ее зависимость от концентрации реагирующих веществ (закон действующих масс), от температуры (правило Вант-Гоффа, уравнение Аррениуса), энергия активации. Колебательные реакции. Скорость гетерогенных химических реакций. Химическое равновесие. Константа равновесия и ее связь с энергией Гиббса. Правило смещения химического равновесия Ле Шателье.
Растворы. Способы выражения концентраций растворов. Термодинамика растворения. Основные законы растворов неэлектролитов. Основные законы для растворов электролитов. Изотонический коэффициент. Электролитическая диссоциация, основные положения теории диссоциации. Степень диссоциации, константа диссоциации. Закон разведения Оствальда. Реакции в растворах электролитов. Правила записи уравнений реакций ионного обмена. Слабые электролиты. Электролитическая диссоциация воды, ионное произведение воды, водородный показатель. Труднорастворимые соединения, произведение растворимости. Комплексные соединения, константа нестойкости комплексных соединений. Гидролиз солей. Виды гидролиза. Константа гидролиза. Условия смещения равновесия гидролиза.
Окислительно-восстановительные реакции. Правила определения степени окисления. Классификация окислителей и восстановителей. Методы электронного и электронно-ионного баланса. Классификация окислительно-восстановительных реакций. Направленность окислительно-восстановительных реакций.
Основы аналитической химии. Количественный и качественный анализ.
IV. СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Основная учебная литература:
1. Алексашин, А.Ю. Общая химия/ А.Ю. Алексашин, Н.Е. Шпак– М.:Дашков и К, 2010.-256с.
2. Ардашников, Е.И. Сборник задач по неорганической химии. – М.:Академия, 2008.- 208 с.
3. Ахметов, Н.Р. «Общая и неорганическая химия» - М: Высшая школа, 2006. – 743с.
4. Васильев, В.П. Аналитическая химия. В 2-х книгах. – М: Дрофа, 2007. – кн. I, 368 с., кн. II 384 с.
5. Глинка, Н.Л. Общая химия. – М.: Юрайт, 2010. – 88 с.
6. Глинка, Н.Л. Задачи и упражнения по общей химии. – М.: Интегралл-пресс, 2009.- 240 с
7. Егоров, В.В. Теоретические основы неорганической химии. – СПБ.: Лань, 2005. – 192 с.
8. Коровин ,В.Н. Общая химия . - М.: Высшая школа,2009.-377 с.
9. Лидин, Р.А. Текстовые задания по общей и неорганической химии с решениями и ответами. – М.: Бином, 2010.-230 с.
10. Общая и неорганическая химия./ под ред. А.Ф. Воробьева, т.2 Химические свойства неорганических веществ. – М.:ИКЦ «Академкнига», 2007.- 544 с.
11. Общая химия. Биофизическая химия. Химия биогенных элементов. /Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. – М.: Высшая школа, 2009 – 560 с.
12. Павлов, Н.Н., Сборник задач и упражнений по общей и неорганической химии/. В.И. Фролов , Н.Н.Павлов– М.: Дрофа, 2005 – 240с.
13. Хомченко, Г.П., Неорганическая химия./ Г.П. Хомченко, И.К. Цитович –СПб: ИТК ГРАНИТ, 2009.–464 с.
14. Цитович, И.К. Курс аналитической химии. – СПб.: Лань, 2004. – 460 с.
V. ОСНОВНАЯ ЧАСТЬ
V. I СТРОЕНИЕ АТОМА
Атом – это электронейтральная микросистема, состоящая из положительно заряженного ядра и электронной оболочки, заряженной отрицательно.
Носителем положительного заряда ядра являются протоны - p. Их число определяет величину заряда ядра ( Z) и совпадает с порядковым номером химического элемента, т.е. Z = P.
Основные характеристики элементарных частиц, образующих атом – протона, нейтрона и электрона, приведены в таблице 1.
Таблица 1.
|
Частица |
Символ | Масса покоя |
Заряд | |
| Кг | Относительная масса | |||
| протон | р+ | 1,673 10−27 | 1 | +1 |
| нейтрон | n0 | 1,675 10−27 | 1 | 0 |
| электрон | ē | 9,109 10−31 | 0 | -1 |
Масса электрона почти в 1840 раз меньше массы протона и нейтрона. Поэтому масса атома практически равна массе ядра – сумме масс протонов и нейтронов (нуклонов).
Важной характеристикой ядра является массовое число A, которое равно общему числу нуклонов – сумме протонов (P) и нейтронов (N), входящих в состав ядра:
A = P + N
Разновидности одного и того же химического элемента, отличающиеся массой атомов, называются изотопами. Ядра атомов изотопов различаются числом нейтронов.
Так, изотопами водорода являются атомы с массовыми числами соответственно 1,2 и 3:
1H (2H) 2D (3H) 3T
p+ (ē) ( p+ + n0 ) ē ( p+ + 2n0 ) ē
протий дейтерий тритий
Протий и дейтерий – стабильные изотопы, тритий – радиоактивен.
Превращение химических элементов осуществляется в результате ядерных реакций. Состав ядра в результате химической реакции не изменяется.
Примеры решения задач
Пример 1. Напишите электронную формулу атома серы. К какому электронному семейству относится сера? Укажите валентные электроны, распределите их по энергетическим ячейкам в нормальном и возбужденных состояниях.
Решение. У атома серы порядковый номер 16 в таблице Д.И. Менделеева, поэтому – 16 электронов и последовательность заполнения энергетических уровней и подуровней совпадает с электронной формулой (что характерно для элементов с порядковыми номерами от 1 до 20):
16S – 1s2 2s2 2p6 3s2 3p4
Последним заполняется p-подуровень, поэтому сера принадлежит к p-электронному семейству; содержит 6 валентных электронов – 3s2 3p4. Представим схему размещения валентных электронов в квантовых (энергетических) ячейках:







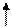


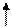



 3s 3p 3d
3s 3p 3d
 16S - ...
16S - ...
 Валентность серы в нормальном состоянии равна 2, например, в соединениях H2S, Na2S, CaS.
Валентность серы в нормальном состоянии равна 2, например, в соединениях H2S, Na2S, CaS.
У атома серы на 3d-подуровне имеются вакантные орбитали. При возбуждении атома происходит разъединение пар электронов и переход их на свободные орбитали.
Представим электронные конфигурации атома серы в возбужденных состояниях:
3s 3р 3d
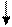

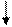

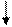


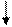

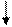




 а) 16S* - … ,
а) 16S* - … ,
16S* - … 3s23p33d1
Валентность серы равна 4, например, в соединениях SO2, H2SO3
3s 3p 3d














 б) 16S*- …
б) 16S*- …
S* - … 3s1 3p3 3d2
Валентность серы равна 6, например, в соединениях: SO3, H2SO4.
Вывод: валентность серы в соединениях 2, 4, 6.
Пример 2. Составьте электронную формулу атома титана и ионов титана Ti2+ и Ti4+. К какому электронному семейству относится титан? Приведите электронные аналоги титана.
Решение. Порядок заполнения энергетических уровней и подуровней следующий:
22Ti – 1s2 2s2 2p6 3s2 3p6 4s2 3d2
Титан принадлежит к d-электронному семейству.
Электронная формула титана имеет вид:
22Ti – 1s2 2s2 2p6 3s2 3p6 3 d2 4 s2
Подчеркнуты валентные электроны.
Электронно-графические формулы валентных электронов атома титана в нормальном и возбужденном состояниях:
3d 4s 4p 4d 4f…















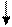
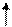

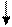
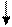



 22 Ti -…
22 Ti -…
Валентность титана в нормальном состоянии равна 2, например, в соединениях: TiO, TiCl2. Такая валентность обусловлена двумя неспаренными электронами, но вакантные орбитали на 4p-подуровне вносят дополнительный вклад в валентность и титан в некоторых соединениях проявляет валентность, равную 3, например, в соединении TiCl3.
При возбуждении атома титана происходит распаривание 4s-электронов и переход их на 4p-подуровень, валентность титана в этом состоянии равна 4 (TiO2, TiCl4):
3d 4s 4p 4d 4f..
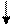
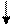





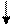

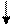









 22Ti*-…
22Ti*-…
22 Ti* - … 3d2 4s1 4p1 4d0 4f0
Сокращенная электронная формула атома титана:
22 Ti - … 3d2 4s2
Электронные аналоги титана:
40 Zr - … 4d2 5s2; 72 Hf - …5d2 6s2
Электронные формулы ионов титана Ti2+ и Ti4+ соответственно:
22Ti2+ - … 3d2 4s0; 22Ti4+ - … 3d0 4s0.
Контрольные задания
1. Структуры валентных электронных слоев выражаются формулами: а) 4s24p2; б) 5d46s2; в) 4s1. Составьте полные электронные формулы, определите порядковые номера, приведите названия элементов, определите принадлежность к электронным семействам.
2. Напишите электронные формулы атома кальция и иона Ca2+. Укажите валентность кальция в нормальном и возбужденном состояниях. Какие значения принимают кантовые числа для внешних электронов атома кальция?
3. Напишите электронные формулы атома ,бария и иона Ba2+. Укажите валентность бария в нормальном и возбужденном состояниях. Какие значения принимают кантовые числа для внешних электронов атома бария?
4. Напишите электронные формулы атома Te и иона Te2-. Докажите, что валентность теллура в соединениях 2, 4, 6.
5. Напишите электронные формулы атома железа, ионов Fe2+ и Fe3+. Докажите с помощью электронно-графической схемы, что максимальная валентность железа в соединениях равна 6.
6. Что такое изотопы? Приведите примеры изотопов какого-либо элемента, напишите электронную формулу изотопов этого элемента. Почему изотопы элемента имеют сходные химические свойства?
7. Определите по правилу Клечковского последовательность заполнения электронами энергетических подуровней, если n+l=7. Какой элемент имеет валентные электроны 7s2?
8. Напишите электронные формулы атома стронция и иона Sr2+. Укажите валентность стронция в нормальном и возбужденном состояниях. Какие значения принимают кантовые числа для внешних электронов атома стронция?
9. Напишите значения всех четырех квантовых чисел для трех любых электронов на 4p-подуровне. Значениями какого квантового числа различаются три электрона указанного подуровня? Почему максимальное число электронов на p-подуровне равно 6?
10. По какому признаку элементы подразделяются на электронные семейства? Напишите электронные формулы атомов любых двух элементов пятого периода, принадлежащих к разным электронным семействам. Какие электроны этих элементов являются валентными? Какой подуровень заполняется раньше: 5s или 4d? Почему?
11. Какое состояние атома называется основным и какое – возбужденным? Чем ион отличается от нейтрального атома? Ответы на вопросы подтвердите написанием электронных формул атома брома и бромид-иона. Изобразите электронно-графические схемы атома брома в нормальном и возбужденных состояниях.
12. Напишите электронные формулы атома водорода и ионов Н+, Н-. Какие элементарные частицы входят в состав атома водорода и ионов? Вычислите энергию связи электрона в электрон-Вольтах (эВ) на первой и пятой стационарных орбиталях атома водорода и сравните (<, >) их величины.
13. Структуры валентных электронных слоёв атомов элементов выражаются формулами:
а) 5s25p4; б) 3d54s1; в) 7s2. Определите порядковые номера, приведите названия элементов, а также укажите принадлежность к электронным семействам.
14. Составьте электронные формулы и электронно-графические схемы атомов элементов с порядковыми номерами 23 и 33 в нормальном и возбужденных состояниях. Приведите валентные электроны этих элементов и их электронных аналогов.
15. На примерах галлия и марганца докажите, что имеется взаимосвязь строения атомов элементов с положением их в периодической системе химических элементов Д.И. Менделеева.
16. Напишите электронные формулы и электронно-графические схемы атомов фосфора и ванадия в нормальном и возбужденном состояниях. К какому электронному семейству относится каждый из этих элементов?
17. На каком основании иттрий (Z=39) и индий (Z=49) помещены в одну группу периодической системы элементов Д.И. Менделеева? Почему они в разных подгруппах? Приведите валентные электроны этих элементов и их электронных аналогов.
18. Напишите электронные формулы атома Ba и иона Ba2+. Какую валентность проявляет барий в нормальном и возбужденном состояниях? Структуру какого инертного газа имеет ион Ba2+?
19. Напишите электронную формулу атома технеция. Укажите валентные электроны. Распределите валентные электроны по энергетическим ячейкам в нормальном и возбужденном состояниях. Определите суммарный спин электронов в возбужденном состоянии.
20. Напишите электронную формулу атома меди; учтите, что у меди происходит провал одного 4s электрона на 3d-подуровень. Приведите электронные формулы двух последних уровней электронных аналогов меди.
Примеры решения задач
Пример 1. Какой элемент 4 периода – марганец или бром проявляет металлические свойства?
Решение. Полные электронные формулы элементов:
25Mn – 1s22s22p6 3s23p63d54s2
35Br – 1s22s22p6 3s23p6 3d10 4s24p5
Марганец является d-элементом VIIB подгруппы, а бром – p-элемент VIIA подгруппы. На внешнем энергетическом уровне у атома марганца два электрона, а у атома брома – семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а, следовательно, способны терять электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов.
Элементы, атомы которых на внешнем энергетическом уровне содержат более трех электронов, обладают в основном сродством к электрону, а, следовательно, приобретают отрицательную степень окисления и образуют элементарные отрицательные ионы.
Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома более свойственна окислительная функция. Общей закономерностью для всех групп, относящихся к d-электронному семейству, является преобладание металлических свойств. Следовательно, металлические свойства проявляет марганец.
Пример 2. Как зависят кислотно-основные свойства оксидов и гидроксидов от степени окисления образующих из атомов? Какие гидроксиды называются амфотерными (амфолитами)?
Решение. Если элемент проявляет переменную степень окисления и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства их изменяются от основных к амфотерным и кислотным. Например: оксиды и гидроксиды хрома, марганца, ванадия и др. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э-О и О-Н может протекать по двум направлениям:
основному - ЭОН D Э+ + ОН- или
кислотному - ЭОН D ЭО - + Н+
Полярность связей, в свою очередь, определяется разностью электроотрицательностей и эффективными зарядами атомов. Приводим пример диссоциации амфотерных гидроксидов (амфолитов):
Эn+ + nОН- D Э(ОН)n ; НnЭОn D nН+ + ЭОn-
основной тип кислотный тип
диссоциации диссоциации
В кислой среде амфолит проявляет основной, а в щелочной среде – кислотный характер.
Рассмотрим амфотерные свойства оксидов и гидроксидов хрома.
Приводим сокращенную электронную формулу атомов хрома: 24Cr - … 3d54s1.
Хром образует оксиды: Cr+2O, Cr2+3O3, Cr+6O3, которым соответствуют следующие гидроксиды:
Cr+2 (OH)2, Cr+3 (OH)3, H2Cr+6 O4 и H2Cr+62 O7.
Для CrO и Cr(OH)2 характерны основные свойства, для Сr2O3 и Cr(OH)3 – амфотерные свойства, для CrO3, H2CrO4 и H2Cr2O7 – кислотные свойства.
Докажем амфотерные свойства тригидроксида хрома:
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6];
Cr(OH)3 + 3OH- = [Cr(OH)6]3-.
В данной реакции Cr(OH)3 проявляет кислотные свойства.
Cr(OH)3 + 3HCl = CrCl3 + 3H2О,
Cr(OH)3 + 3H+ = Cr3+ + 3H2O.
В данной реакции Cr(OH)3 проявляет основные свойства.
Контрольные задания
21. Составьте формулы оксидов и гидроксидов марганца. Как изменяется кислотно-основной и окислительно-восстановительный характер этих соединений? Подчиняются ли эти соединения общей закономерности изменения свойств оксидов и гидроксидов?
22. Исходя из положения хрома, селена, углерода и серы в периодической системе, определите, какая из кислот является более сильным окислителем: а) H2CrO4 или H2SeO4, б) H2CO3 или H2SO3.
23. У какого элемента наибольшая энергия ионизации: а) Sr или Cd; б) Rb или Ag? У какого элемента наибольшая электроотрицательность: а) As или Sb; б) As или Br?
24. Какую высшую и низшую степени окисления проявляют вольфрам, теллур, серебро в соединениях? Почему? Составьте формулы соединений, отвечающих этим степеням окисления и изобразите их структурные формулы.
25. Приведите современную формулировку периодического закона. Объясните, почему в периодической системе элементов аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, йодом и протактинием, хотя имеют бóльшую атомную массу. Как называются пары таких элементов?
26. Исходя из положения металлов в периодической системе, определите, какой из двух гидроксидов является более сильным основанием: а) KOH или Mn(OH)2; б) Zn(OH)2 или Сa(OH)2; в) Mg(OH)2 или Be(OH)2.
27. Исходя из положения технеция, селена, цезия в периодической системе, составьте формулы следующих соединений: технециевой кислоты, оксида селена, гидрокарбоната цезия, отвечающих их высшей степени окисления. Изобразите структурные формулы соединений.
28. Исходя из положения серы, фосфора и хлора в периодической системе, определите, как изменяются окислительные свойства кислот: H2SO4, H3PO4, HClO4?
29. В ряду кислородных кислот хлора: HClO – HСlO2 – HСlO3 - HClO4 определите, какая из кислот наиболее сильный окислитель, какая из кислот наиболее сильный электролит.
30. На основании строения атомов лития и бериллия поясните, почему первый потенциал ионизации у лития меньше, чем у бериллия, а второй потенциал ионизации лития больше, чем у бериллия?
31. Какие элементы принадлежат к f–электронному семейству? На примерах строения атомов двух любых лантаноидов (или актиноидов) докажите, что химические свойства в группах лантаноидов (или актиноидов) близки друг к другу.
32. Как изменяются кислотно-основные свойства оксидов и гидроксидов в периодах с увеличением порядковых номеров элементов? Ответ мотивируйте строением атомов элементов и величин их важнейших характеристик: радиусов атомов и электроотрицательностей.
33. Составьте формулы оксидов и гидроксидов ванадия. Как изменяется кислотно-основной и окислительно-восстановительный характер этих соединений?
34. Исходя из строения атомов элементов, определите, какое основание более сильное:
а) Sr(OH)2 или Fe(OH)2; б) Cu(OH)2 или KOH; какая кислота более сильная: а) H3AsO4 или H2SeO4; б) HClO4 или HMnO4.
35. Какую высшую и низшую степени окисления проявляют молибден, йод и цирконий? Почему? Составьте формулы соединений, отвечающих этим степеням окисления и изобразите их структурные формулы.
36. Как изменяется прочность связи между атомами в молекулах галогенов Cl2 – Br2 – J2? Почему молекула F2 выпадает из общей закономерности?
37. Как изменяются металлические свойства в VВ подгруппе периодической системы? Ответ мотивируйте, исходя из строения атомов элементов и величин важнейших их характеристик: радиусов атомов и энергий ионизации.
38. Исходя из положения галогенов в периодической системе, поясните, как изменяются восстановительные свойства в ряду HCl – HBr – HJ. Почему HF входит в исключение?
39. Как изменяются неметаллические свойства в VIА подгруппе периодической системы? Ответ мотивируйте, исходя из строения атомов элементов и величин важнейших их характеристик: радиусов атомов и электроотрицательностей.
40. В какой степени окисления галогены и элементы подгруппы марганца проявляют наибольшее сходство в свойствах? Приведите примеры сходных соединений.
V. III ХИМИЧЕСКАЯ СВЯЗЬ
Под химической связью понимают явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением энергии системы, а уменьшение энергии системы приводит к увеличению её устойчивости.
Условия образования химической связи :
1. Энергетический выигрыш.
2. Антипараллельные спины электронов в связывающей молекулярной орбитали.
3. Перекрывание электронных облаков связывающихся частиц.
Важными характеристиками химической связи являются прочность и длина.
Энергия связи (Есвязи; кДж/моль) – мера её прочности, определяется работой, необходимой для разрыва связей или тепловым эффектом при образовании молекулы.
H + H → H2 + 435 кДж/моль
или
H2 → H + H – 435 кДж/моль
Под длиной связи (ℓ; нм, Ǻ ) понимают расстояние между центрами ядер атома в молекуле или кристалле. Угол между воображаемыми линиями, проходящими через ядра химически связанных атомов, называется валентным.
Например, в молекуле воды длина связи О – Н составляет 0,096 нм, а валентный угол – 104,50 .
 |
Химическая связь образуется в том случае, когда электроны оказываются вблизи двух или нескольких ядер, благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов. Процесс этого взаимодействия может протекать различным образом. Поэтому в настоящее время различают три основных типа химических связей: ковалентную, ионную и металлическую.
Химическая связь, осуществляемая общими электронными парами, называется ковалентной. Ковалентная связь двухэлектронная и двухцентровая (удерживает два ядра). Различают две ее разновидности: неполярную и полярную.
В случае ковалентной неполярной связи электронное облако, образованное общей электронной парой, распределяется в пространстве симметрично относительно ядер обоих атомов (например, в молекулах Н2, О2 , Cl2, N2, F2 ).
H∙ + ∙H → H : H ( H + H → H-H)
:Cl∙ + ∙Cl: → :Cl : Cl: ( Cl + Cl → Cl−Cl )
В случае ковалентной полярной связи электронное облако смещено к атому с большей электроотрицательностью (∆Э O < 1,7). Например, в молекулах HCl, CO, SO2, электронная пара связи смещается в сторону более электроотрицательного атома, у которого возникает частичный отрицательный заряд (δ-). У менее электроотрицательного атома возникает частичный положительный заряд (δ+). Между центрами зарядов в молекуле возникает некоторое расстояние. Такие молекулы называют дипольными или диполями, а смещение электронов связи называется поляризацией связи.
H∙+ ∙Cl → H : Cl
∆Э O = Э O(Cl) − Э O(Н) = 3,0 − 2,1 = 0,9
Способ образования ковалентной связи, когда каждый из взаимодействующих атомов предоставляет электроны для образования общих электронных пар, называется обменным. Механизм образования ковалентной связи за счёт неподелённой электронной пары донора и свободной орбитали акцептора называется донорно-акцепторным. Например, при образовании катиона аммония атом азота (донор) предоставляет готовую (неподелённую) электронную пару, а атом водорода (акцептор) – свободную орбиталь.
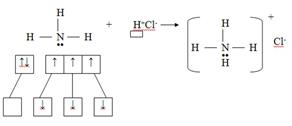
Ковалентная связь характеризуется направленностью и насыщаемостью.
Насыщаемость обусловлена тем, что число перекрываний электронных облаков ограничено числом неспаренных электронов. Поскольку электронные облака направлены в пространстве (кроме s-), то и химические связи, образованные с их участием, пространственно направлены.
Электронные облака имеют различную форму, их взаимное перекрывание может осуществляться разными способами. Различают σ(сигма)- и π(пи)- связи.
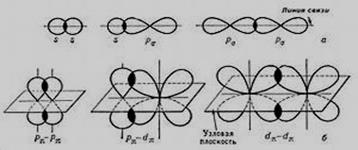 |
σ−связь осуществляется при перекрывании атомных орбиталей вдоль линии соединения атомов. π-связь осуществляется при перекрывании атомных орбиталей по обе стороны от линии соединения центров атомов (рис. 3).
Рис.3
Степень перекрывания π-связи значительно меньше, чем σ-связи, и, следовательно, π-связь менее прочная, чем σ-связь. Одинарные связи образуются только за счет σ-связей, а кратные связи могут иметь и π-связи. Кратные связи – это ковалентные связи, образованные более чем одной парой электронов. Увеличение кратности связи приводит к упрочению межатомной связи и к уменьшению длины связи
Н3С-СН3 Есвязи(С_С) = 85 кДж/моль; l(С_С) = 1,543 Ǻ
Н2С=СН2 Есвязи(С=С) = 145 кДж/моль; l(С=С) = 1,353 Ǻ
НС≡СН Есвязи(С≡С) = 198 кДж/моль; l(С≡ С) = 1,205 Ǻ
Для объяснения пространственного строения молекул используется представление о гибридизации валентных орбиталей в атоме в процессе образования им химических связей.
Под гибридизацией понимают процесс перестройки неравноценных по форме и энергии электронных облаков, приводящий к образованию гибридных облаков, одинаковых по форме и энергии. При этом число гибридных орбиталей равно числу исходных.
При гибридизации электронная энергия атома увеличивается (энергетически невыгодный процесс), но затрата энергии компенсируется с избытком по следующим причинам:
1. Гибридные орбитали из-за своей большей вытянутости в направлении связей полнее и глубже перекрываются с орбиталями связываемого атома, поэтому связи получаются более прочными и достигается бóльший выигрыш в энергии.
2. При возбуждении один из спаренных валентных электронов переходит на другую гибридную орбиталь, то есть увеличивается ковалентность атома (количество неспаренных электронов) и, следовательно, количество химических связей (энергетически выгодный процесс).
В зависимости от числа участвующих в гибридизации орбиталей различают следующие типы:
· sp-гибридизация – «смешение» одной s-орбитали и одной p-орбитали с образованием двух sp-гибридных орбиталей, расположенных под углом 180о друг к другу.
· sp2-гибридизация - «смешение» одной s-орбитали и двух p-орбиталей с образованием трех sp-гибридных орбиталей, расположенных под углом 120о друг к другу.
· sp3-гибридизация - «смешение» одной s-орбитали и трех p-орбиталей с образованием четырех sp-гибридных орбиталей, расположенных под углом 109o28’ друг к другу(рис.4).
Рис.4
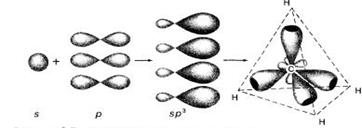 |
Ионная связь – химическая связь между атомами, резко отличающимися по электроотрицательности (∆Э O > 1,7). Взаимодействие сопровождается переносом электрона от менее электроотрицательного атома к более электро-отрицательному атому.
Na∙ + ∙Cl → Nа :Cl ( Na+Cl− )
∆ЭО = ЭО(Cl) − ЭО(Na) = 3,0 – 0,9 = 2,1
Атом, присоединивший электрон, становится отрицательно заряженным ионом (Cl−) − анионом; атом, отдавший электрон, становится положительно заряженным ионом (Na+) – катионом. Между ионами возникает электростатическое взаимодействие с образованием нейтральных молекул. Ион является точечным электрическим зарядом, у которого, по закону Фарадея, электрическое поле по всем направлениям одинаково. Поэтому ионная связь обладает ненаправленностью и ненасыщаемостью, в отличие от ковалентной связи.
Металлическая связь – химическая связь между атомами или ионами металла и относительно свободными общими валентными электронами («электронным газом»). В кристалле металла постоянно происходит обмен электронами потому, что у атомов много свободных валентных орбиталей и электроны слабо притягиваются ядрами атомов. Эти орбитали отдельных атомов перекрываются друг с другом, обеспечивая электронам способность свободно перемещаться между ядрами во всем объёме металла. В кристаллической решетке металлов электроны обобществлены. Они непрерывно перемещаются между положительно заряженными ионами, которые расположены в узлах кристаллической решетки. При этом сравнительно небольшое число обобществленных электронов связывает большое число ионов.
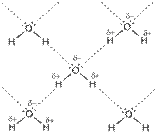 Водородная связь – химическая связь между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом с неподеленной электронной парой (F, O, N) другой молекулы. Эта связь является разновидностью донорно-акцепторного взаимодействия, которая обуславливает её направленность. Процесс образования водородной связи при взаимодействии молекул воды можно представить схемой:
Водородная связь – химическая связь между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом с неподеленной электронной парой (F, O, N) другой молекулы. Эта связь является разновидностью донорно-акцепторного взаимодействия, которая обуславливает её направленность. Процесс образования водородной связи при взаимодействии молекул воды можно представить схемой:
Энергия водородной связи составляет 8-40 кДж/моль, т.е. на порядок меньше энергии ковалентной связи, но этой энергии достаточно для ассоциации молекул.
Примеры решения задач
Пример 1. Объясните механизм образования молекулы SiF6 и иона [SiF6]2-
Решение. Приводим электронную формулу атома кремния: 14Si-1s2 2s2 2p6 3s2 3p2
Приводим графическую схему распределения электронов по энергетическим ячейкам в:
а) невозбужденном состоянии
3s 3p … 3d




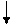


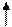

 14Si -…
14Si -…
…….


3s 3p 3d







 б) при возбуждении 14Si* ……
б) при возбуждении 14Si* ……
Четыре неспаренных электрона возбужденного атома кремния могут участвовать в образовании четырех ковалентных связей с атомами фтора (9F – 1s2 2s2 2p5), имеющему по одному неспаренному электрону с образованием молекулы.
Для образования иона [SiF6]4- к молекуле SiF4 присоединяются два иона F- (1s2 2s2 2p6), все валентные электроны которых спарены. Связь осуществляется по донорно-акцепторному механизму за счет пары электронов каждого из фторид-ионов и двух валентных 3d-орбиталей атома кремния.
Контрольные задания
41. Что называется кратностью связи? Приведите примеры соединений, содержащих ординарные, двойные и тройные связи. Отметьте s- и p-связи в структурных формулах приведенных молекул.
42. Охарактеризуйте типы кристаллических структур по природе частиц узлов решеток. Какие кристаллические структуры имеют: CO2, CH3COOH, алмаз, графит, NaCl, Zn?
43. Почему существует молекула PCl5, но не существует молекула NCl5, хотя азот и фосфор находятся в одной и той же подгруппе VA периодической системы? Какой тип связи между атомами фосфора и хлора? Укажите тип гибридизации атома фосфора в молекуле PCl5.
44. Какая химическая связь называется ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите примеры молекул с типично ионными связями и укажите тип кристаллической решетки. Составьте изоэлектронный ряд ксенона.
45. Какая связь называется s- и какая - p-связью? Какая из них менее прочная и более реакционноспособная? Изобразите структурные формулы этана C2H6, этилена C2H4 и ацетилена C2H2. Отметьте s- и p-связи на структурных схемах углеводородов.
46. Какой тип гибридизации в молекулах CCl4, H2O, NH3 ? Изобразите в виде схем взаимное расположение гибридных облаков и углы между ними.
47. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа ABn, если связь в них образуется за счет sp-, sp2-, sp3- гибридизации орбиталей атома A ? Приведите примеры молекул с указанными типами гибридизации.
48. На основании строения атомов в нормальном и возбужденном состояниях определите ковалетность бериллия и углерода в молекулах BeCl2, (BeCl2)n, CO и CO2. Изобразите структурные формулы молекул.
49. На основании строения атомов в нормальном и возбужденном состояниях определите ковалентность лития и бора в соединениях: Li2Cl2, LiF, [BF4]-, BF3.
50. Какая химическая связь называется водородной? Приведите три примера соединений с водородной связью. Изобразите структурные формулы приведенных ассоциатов. Как влияет образование водородной связи на свойства веществ (вязкость, температуры кипения и плавления, теплоты плавления и парообразования, диэлектрическую постоянную)?
V. IV ЭНЕРГЕТИКА ХИМИЧЕСКИХ
ПРОЦЕССОВ
Науку о взаимных превращениях различных видов энергии называют термодинамикой.
При химических реакциях происходят глубокие качественные и количественные изменения в системах: рвутся связи в исходных веществах, возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота.
Раздел термодинамики, изучающий тепловые эффекты химических реакций, называют термохимией. Реакции, которые сопровождаются выделением теплоты, называют экзотермическими, а поглощением теплоты - эндотермическими.
При любом процессе соблюдается закон сохранения энергии, как проявление более общего закона природы – закона сохранения материи. Согласно первому закону химической термодинамики теплота Q, поглощённая системой, идет на изменения ее внутренней энергии Δ U и на совершение работы A:
Q = ΔU + A
Энтальпия системы H – это величина, равная сумме внутренней энергии U произведения объёма на давление:
H = U + pV
QP, T – тепловой эффект реакции в изобарно-изотермическом процессе равен изменению энтальпии системы ΔН (если единственным видом работы является работа расширения):
Qp,Т = ΔН
Энтальпия, как и внутренняя энергия, является функцией состояния: ее изменение ΔН определяется только начальным и конечным состояниями системы и не зависит от пути перехода.
Теплота химического процесса в изобарно-изотермических условиях называется тепловым эффектам химической реакции.
Термохимические расчеты основаны на законе
Г.И. Гесса (1840 г.):
Примеры решения задач
Пример 1. Реакция горения жидкого этилового спирта выражается термохимическим уравнением:
C2H5OH(ж) + O2(г) = 2CO2(г) + 3H2O(ж); ΔH = ?
Вычислите тепловой эффект реакции, если известно, что мольная теплота парообразования C2H5OH(ж) равна +42,36 кДж, а теплоты образования C2H5OH(г), CO2(г) и H2O(ж) соответственно равны, кДж/моль: -235,31; -393,51 и -285,84.
Решение. Для определения ΔH реакции необходимо знать теплоту образования C2H5OH(ж), находим ее из данных:
C2H5OH(ж) D C2H5OH(г); ΔH = +42,36 кДж
Из фазового перехода определим теплоту образования жидкого C2H5OH (ж):
+42,36 = -235,31 – ΔH C2H5OH(ж);
ΔH C2H5OH(ж) = -235,31 – 42,36 = -277,67 кДж
Вычислим ΔH реакции, применяя следствие из закона Г.И. Гесса:
ΔHoх.р = 2 ΔHoCO2(г) + 3 ΔH oH2O(ж) – ΔHo C2H5OH(ж)
ΔHoх.р. = 2(-393,51) + 3(-285,84) - ( - 277,67) = -1366,87 кДж.
Вывод: реакция горения жидкого этилового спирта протекает с выделением большого количества тепла -1366,87 кДж.
Контрольные задания
Для решения задач нужно использовать справочный материал.
51. Определите тепловой эффект реакции разложения 1 моля бертолетовой соли КСlО3(к) , протекающей по уравнению:
2КСlО3(к) = 2КСl(к) + 3О2(г).
Напишите термохимическое уравнение. Определите, сколько тепла выделится при разложении 100 г бертолетовой соли. Какая из солей KCl или KClO3 более термически стойкая? Ответы: - 44,7 кДж, - 36,5 кДж
52. Вычислите тепловой эффект реакции спиртового брожения глюкозы (под действием ферментов), если известны теплоты образования C6H12O6 (к), C2H5OH (ж) соответственно, кДж /моль: - 1273,0; -277,6:
С6Н12О6(к) = 2 С2Н5ОН(ж) + 2СО2(г)
Напишите термохимическое уравнение. Сколько выделится тепла при брожении 1кг глюкозы?
Ответы: -69,22 кДж; -384,55 кДж.
53. Реакция горения аммиака выражается уравнением:
4 NН3 (г) + 5О2(г) = 4 NО (г) + 6Н2О(г).
Вычислите тепловой эффект реакции в пересчете на 1 моль NН3 (г). Напишите термохимическое уравнение горения аммиака. Ответ: -226,2 кДж
54. Рассчитайте энтальпию образования жидкого сероуглерода CS2 по следующим данным:
Sмонокл. + О2(г) = SО2(г); DН = -296,9 кДж;
СS2(ж) + 3О2(г) = СО2(г) + 2SО2(г); DН=-1076,4 кДж;
С(граф.) + О2(г) = СО2(г); DН = -393,5 кДж.
Ответ: +89,12 кДж · моль-1.
55. Определите тепловой эффект химической реакции Al2O3 (к) + SO3 (г) = Al2 (SO4)3 (к) ,
зная при стандартных условиях теплоты образования Al2O3 (к), SO3 (г) и Al2(SO4)3 (к) соответственно, кДж·моль-1: -1676,0; -395,8 и -3441,2. Сколько тепла выделится, если в реакции участвует 0,25 моль Al2O3 (к)?
Ответы: -1370 кДж; -342,5 кДж
56. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
FeO (к) + CO (г) = Fe (к) + CО2 (г); DH=-18,20кДж;
СO (г) + 1/2O2 (г) = СO2 (г) DН = -283,0 кДж;
H2 (г) + ½ O2 (г) = H2O (г) DН = -241,83 кДж.
Ответ: + 23 кДж
57. Реакция горения аммиака выражается термохимическим уравнением:
4NH3(г) + 3О2(г) = 2N2(г) + 6H2О(ж); DН=-1530,0кДж.
Вычислите теплоту образования аммиака NH3(г).Сколько тепла выделяется при сгорании 10 молей NH3(г)?
Ответы: -46,2 кДж · моль-1 ; – 3825 кДж.
58. Вычислите теплоту образования карбида кальция СаС2, исходя из теплового эффекта реакции:
СаО(т) + 3С(т) = СаС2(т) + СО(г) +462,2кДж
и стандартных энтальпий образования СаО и СО. Сколько нужно затратить тепла для получения 100 кг СаС2(т)?
Ответы: – 62,8 кДж · моль-1; +7,22 · 105кДж.
59. Используя энтальпии образования веществ, определите DН0 химической реакции:
2Mg(к) + СО2(г) = 2MgО(к) + Сграфит.
Сколько образуется графита, если в реакцию вступит 100 г Mg и сколько выделится тепла при этом?
Ответы: – 810,1 кДж; 25 г; - 1687,5 кДж.
60. Реакция окисления этилового спирта выражается уравнением:
С2Н5ОН(ж) + 3,0 О2(г) = 2СО2(г) + 3Н2О(ж) .
Определить теплоту образования С2Н5ОН(ж) , зная DН х.р. = - 1366,87 кДж. Напишите термохимическое уравнение. Определите мольную теплоту парообразования
С2Н5ОН(ж) ® С2Н5ОН(г), если известна теплота образования С2Н5ОН(г), равная –235,31 кДж · моль-1.
Ответы: - 277,67 кДж · моль-1 ; +42,36 кДж · моль-1
Примеры решения задач
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе
2NО (г) +О2 (г) ↔ 2NО2 (г), если объем газовой смеси уменьшить в три раза?
Решение. Обозначим концентрации реагирующих веществ: 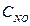 =а,
=а, 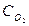 =b,
=b, 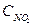 =с.
=с.
Согласно закону действия масс скорости (v) прямой и обратной реакции до изменения объема
vпр.= kпр.а2 b; vобр. = kобр. c2;
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: 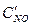 =За,
=За, 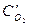 =3b,
=3b, 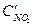 =3с. При новых концентрациях скорости (v’) прямой и обратной реакции:
=3с. При новых концентрациях скорости (v’) прямой и обратной реакции:
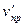 = kпр. (За)2 (3 b) = 27 kпр.а2 b;
= kпр. (За)2 (3 b) = 27 kпр.а2 b;
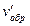 = kобр. (3с)2 = 9 kобр. c2.
= kобр. (3с)2 = 9 kобр. c2.
Отсюда 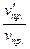 =
= 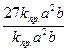 = 27;
= 27;
 =
= 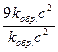 = 9.
= 9.
Следовательно, скорость прямой реакции увеличилась,. в 27 раз
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 50 до 70°С, если температурный коэффициент реакции равен 3.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
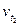 =
= 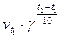 ;
;
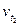 =
= 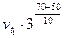 =
= 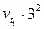 = 9
= 9 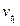 .
.
Следовательно, скорость реакции ( 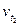 ), протекающей при температуре 70°С, увеличилась по сравнению со скоростью реакции (
), протекающей при температуре 70°С, увеличилась по сравнению со скоростью реакции ( 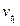 ), протекающей при температуре 50°С, в 9 раз.
), протекающей при температуре 50°С, в 9 раз.
Контрольные задания
61. При увеличении температуры в системе на 45о скорость гомогенной реакции возросла в 65 раз. Вычислите температурный коэффициент скорости реакции. Как изменится скорость данной реакции при охлаждении реакционной смеси с 80 до 50оС? Ответ: 2,5; в 15,625 раз.
62. Начальная концентрация исходных веществ в системе 4HI(г) +O2(г) →2I2(г) + 2H2О(г)
была равна 0,7 и 0,3 моль/л. Как изменится скорость реакции к тому моменту, когда концентрация I2 станет равна 0,2 моль/л? Ответ: 44,4 раза
63. Как изменится скорость реакции, протекающей в системе: MnO2(к) + 4HCl(г) → MnCl2(к) + Cl2(г)
при изменении давления в ней в 3 раза?
Ответ: 81 раз.
64. Как следует изменить давление в системе
2 NО(г) + Cl2(г) →2 NОCl(г);
чтобы скорость реакции возросла в 125 раз?
Ответ: 5 раз.
65. Константа скорости реакции омыления уксусноэтилового эфира:
СН3СООС2Н5(р-р) + КОН(р-р)→СН3СООК (р-р) +С2Н5ОН(р-р)
равна 0,1 л/моль∙мин. Начальная концентрация уксусноэтилового эфира была равна 0,01 моль/л, а щелочи – 0,05 моль/л. Вычислите начальную скорость реакции и в тот момент, когда концентрация эфира станет равной 0,008 моль/л.
Ответ: 5,0∙10 -5 и 3,84∙10-5 моль/л∙мин.
66. При повышении температуры с 55 до 85оС скорость гомогенной реакции возросла в 80 раз. Рассчитайте температурный коэффициент реакции. Ответ: 4,3;
67. Как изменится скорость реакции
2H2S(г) +3O2(г) →2SO2(г) + 2H2О(г)
Если: а)уменьшить объем реакционной смеси в 2 раза?
б)увеличить концентрацию сероводорода в 3 раза?
Ответ: 32 раза; 9 раз.
68. Начальные концентрация исходных веществ в системе N2(г) +3H2(г) ↔ 2NH3(г)
составили: азота – 2 моль/л, водорода – 4 моль/л. Как изменится скорость данной реакции при снижении концентрации водорода в результате реакции до 2,8 моль/л?
Ответ: 3,6 раза.
69. При повышении температуры с 40 до 75оС скорость гомогенной реакции возросла в 120 раз. Как изменится скорость данной реакции при повышении температуры с 75 до 100оС? Ответ: 30,6 раз
70. Как следует изменить объем реакционной смеси системы: 8NH3(г) + 3Br2(ж)→6NH4Br(к) + N2(г),
чтобы скорость реакции увеличилась в 25 раз?
Ответ: 1,5 раз
V.VI Химическое равновесие
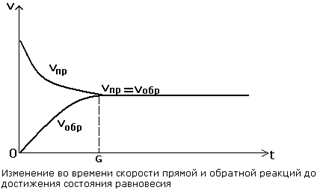 |
Реакции, протекающие одновременно в прямом и обратном направлениях, называются обратимыми. Состояние системы, когда в ней протекают два противоположно направленных химических процесса с одинаковой скоростью, называется состоянием химического равновесия (рис.8).
Рис. 8
Например,
V1
N2 + 3H2 ----> 2NH3 − ∆H (Q > 0)
V1 = k1 [N2]∙[H2]3
V2
2NH3 ----> N2 + 3H2 + ∆H (Q < 0)
V2 = k2 [NH3]2
-----------------------------------------------
N2(г) + 3H2(г)  2NH3(г)
2NH3(г)
в момент равновесия :
V1 = V2 и k1 [N2]∙ [H2]3 = k2 [NH3]2
[NH3]2
Kp = ――――-
[N2]∙ [H2]3
Кр ─ константа равновесия.
Если обратимую реакцию записать в общем виде
k1
aA + bB  cC + dD ,
cC + dD ,
k2
то в состоянии равновесия: V1 = V2 , т.е.
k1∙[A]a∙[B]b = k2∙[C]c∙[D]d ,
где [A] , [B] , [C] , [D] – равновесные концентрации веществ А, В, С, D.
Откуда можно записать выражение константы равновесия:
[ C] c ∙[ D] d
Kp = ―――――
[ A] a ∙[ B] b
Константа равновесия зависит от природы реагирующих веществ и температуры, но не зависит от концентрации и катализатора.
Принцип Ле Шателье
Состояние химического равновесия зависит от температуры, давления, концентрации реагентов. Изменение даже одного фактора приводит к смещению равновесия. Влияние этих факторов описывается
принципом смещения равновесия Ле Шателье:
при всяком внешнем воздействии на систему, находящуюся в состоянии химического равновесия, равновесие смещается в таком направлении, которое приводит к ослаблению этого воздействия.
Основные выводы из принципа Ле Шателье:
1. Равновесие смещается вправо при увеличении концентраций исходных веществ и уменьшении концентраций продуктов реакции. Равновесие смещается влево при уменьшении концентрации исходных веществ и увеличении концентрации продуктов реакции.
2. При повышении температуры равновесие смещается в сторону эндотермической реакции, а при понижении – в сторону экзотермической реакции.
3. При увеличении давления равновесие смещается в сторону уменьшения объёма, т.е. уменьшения числа молей газа, а при уменьшении давления – в сторону увеличения числа молей газа.
Для примера рассмотрим равновесную газовую систему:
N2(г) + 3H2(г)  2NH3(г).
2NH3(г).
Согласно закону смещения, уменьшение концентрации одного из компонентов вызовет сдвиг химического равновесия в сторону образования компонента.
Уменьшение концентрации азота или водорода вызовет смещение равновесия в сторону разложения аммиака.
Уменьшение концентрации N2 или H2
<――――――――――――――――――
N2 + 3H2  2NH3
2NH3
――――――――――――――――――>
Увеличение концентрации N2 или H2
При повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении – в сторону экзотермической реакции.
экзотермический процесс (понижение температуры)
――――――――――――――――>
N2 + 3H2  2NH3 <―――――――――――――――
2NH3 <―――――――――――――――
эндотермический процесс (повышение температуры)
При увеличении давления равновесие смещается в сторону реакции, приводящей к образованию меньшего числа молекул, при уменьшении давления – наоборот.
Увеличение давления (уменьшение общего числа молекул в равновесной системе)
―――――――――――――――――>
N2(г) + 3H2(г)  2NH3(г)
2NH3(г)
<―――――――――――――――――
уменьшение давления (увеличение общего числа молекул в равновесной системе)
Если в процессе обратимой реакции общее число молекул не меняется, изменение давления не влияет на состояние химического равновесия газовой системы. Например, реакция, протекающая по уравнению
H2(г) + I2(пар)  2HI
2HI
не сопровождается изменением общего числа молекул газа в системе.
Примеры решения задач
Пример 1. Константа равновесия гомогенной системы
СО (г)+Н2О (г) ↔СО2 (г)+Н2 (г)
при 850°С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: ( 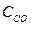 )исх.=З моль/л, (
)исх.=З моль/л, ( 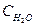 )исх.=2 моль/л.
)исх.=2 моль/л.
Решение. При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей называется константой равновесия данной системы и выражается через равновесные концентрации участников реакции следующим образом:
Кравн. = 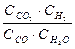
В условии задачи даны исходные концентрации тогда как в выражение Кравн. входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации ( 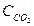 )равн.== х моль/л. Согласно уравнению реакции:
)равн.== х моль/л. Согласно уравнению реакции:
х моль х моль х моль х моль
СО (г)+Н2О (г) ↔ СО2 (г)+Н2 (г)
1моль 1моль 1моль 1моль
число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ будут:
( 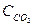 )равн. = (
)равн. = ( 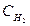 )равн. = х моль/л;
)равн. = х моль/л;
( 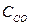 )равн. = (З — х) моль/л;
)равн. = (З — х) моль/л;
( 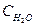 )равн. = (2 — х) моль/л.
)равн. = (2 — х) моль/л.
Зная константу равновесия, находим значение х, а затем и исходные концентрации всех веществ:
1 = 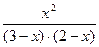 ,
,
Отсюда х = 1,2 моль/л. Таким образом, равновесные концентрации участников реакции:
( 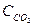 )равн. = (
)равн. = ( 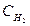 )равн. =1,2 моль/л; (
)равн. =1,2 моль/л; ( 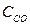 )равн. = (З — 1,2) = 1,8 моль/л;
)равн. = (З — 1,2) = 1,8 моль/л;
( 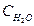 )равн. = (2 — 1,2) = 0,8 моль/л.
)равн. = (2 — 1,2) = 0,8 моль/л.
Пример 2. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
РСl5 (г) ↔РСl3 (г) + С12 (г);∆Hх.р. = + 92,59 кдж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения РСl5?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье:
а) так как реакция разложения РСl5 эндотермическая (∆Нх.р.>0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение РСl5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление;
в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РСl5 так и уменьшением концентрации РСl3 или С12.
Пример 3. Равновесие в системе H2(г)+ I2(г)↔ 2HI(г) установилось при следующих концентрациях участников реакции: HI – 0,05 моль/л, водорода и иода – по 0,01моль/л. Как изменятся концентрации водорода и иода при повышении концентрации HI до 0,08моль/л?
Решение. Зная равновесные концентрации участников реакции, можно рассчитать константу равновесия данной реакции:
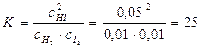 ;
;
При повышении концентрации HI до 0,08моль/л равновесие сместится в обратном направлении, т.е.более интенсивно начнет протекать обратная реакция
хмоль хмоль 2хмоль
H2(г)+ I2(г) ↔ 2HI(г)
1моль 1моль 2моль
Если убыль HI к моменту достижения нового состояния равновесия принять равной 2х моль, то прирост концентраций Н2 и I2 к этому моменту составит х моль; подставив новые равновесные концентрации в выражение для константы равновесия, получим:
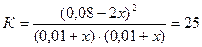 , откуда х = 0,004,
, откуда х = 0,004,
и новые равновесные концентрации Н2 и I2 составят (0,01+0,004) = 0,014 моль/л.
Контрольные задания
71. В каком направлении сместится равновесие системы
СО(г) + 3 Н2(г) ↔ СН4(г) + Н2О(г); ΔНо298<0
а) при повышении температуры; б) введении катализатора; в)понижении давления? Напишите выражение константы равновесия данной реакции.
72. Исходные концентрации монооксида углерода и водяного пара в системе:
СО + Н2О ↔ СО2 + Н2
составляли соответственно 0,09 и 0,03 моль/л. К моменту равновесия прореагировало 22% СО. Найдите равновесные концентрации остальных участников реакции и константу равновесия. Ответ:0,02моль/л;0,07моль/л;0,01моль/л;0,57.
73. Восстановление Fe2O3 водородом протекает по уравнению
Fe2O3(к) + 3 H2(г) ↔ 2 Fe(к) + 3 H2O(г) ; ΔНо298 = +98,6 кДж
В каком направлении сместится равновесие системы а) при уменьшении температуры;
б) увеличении концентрации водорода; в)понижении давления? Напишите выражение константы равновесия данной реакции.
74. При 494оС константа равновесия реакции 2NО (г) +О2 (г) ↔ 2NО2 (г) равна 2,2. Равновесные концентрации NО и О2 соответственно равны 0,020 и 0,030 моль/л. Вычислите их исходные концентрации. Ответ: 0,025 моль/л; 0,0325 моль/л.
75. Как повлияет на выход SO2 в системе:
SO3(г) + C(к) ↔ SO2(г) + CO(г)
а) уменьшение общего объема смеси; б) уменьшение концентрации SO3; в) введение катализатора?
76. Исходная концентрация метана СН4 в системе СН4(г) ↔ С(к) + 2 Н2(г) составила 0,035 моль/л. К моменту равновесия прореагировало 80 % метана. Рассчитайте значение константы равновесия. Ответ: 0,112.
77. В каком направлении будет смещаться равновесие системы 2 СО2(г) ↔ 2 СО (г) + О2 (г) ; ΔНо298 = + 566 кДж
при: а) увеличении давления в системе; б) увеличении концентрации СO; в) введении катализатора; г) уменьшении температуры? Напишите выражение константы равновесия данной реакции.
78. При каких условиях равновесие реакции
MnO2(к) + 4HCl(г) ↔ MnCl2(к) + Cl2(г)
будет смещаться в сторону образования Cl2? Напишите выражение константы равновесия данной реакции.
79. Напишите выражение для константы равновесия гомогенной системы
СН4(г) + СО2(г) ↔ 2 СО(г) + 2 Н2(г) ΔНо298>0;
Как следует изменить температуру и давление, чтобы увеличить выход водорода? Как повлияет на величину выхода водорода увеличение концентрации СО?
80. Константа равновесия системы СCl4(г) ↔ 2Cl2 (г) +C (к) при температуре 700 К составляет 0,77. Начальная концентрация СCl4 равна 3,2 моль/л. Рассчитайте равновесные концентрации участников реакции. Ответ:2,5 моль/л; 1,4 моль/л.
V. VII РАСТВОРЫ
Концентрации растворов
1. Массовая доля (ω) представляет собой отношение массы растворенного вещества, содержащегося в растворе, к общей массе раствора. Массовая доля может быть выражена в процентах ( % ):
ω =( mв / mр-ра ) ∙ 100%,
где mв – масса растворенного вещества, mр-ра – масса раствора, г.
mр-ра = mв + mр-ля , г (mр-ля – масса растворителя, г)
Массовая доля, выраженная в %, (процентная или весовая) – это масса растворенного вещества в 100 г раствора. Например, если раствор 10%-ный, то 10 г вещества содержится в 100 г раствора (mр-ля = mр-ра – mв = 100г – 10г = 90 г).
2. Молярная концентрация (Cм) (молярность) – число молей растворенного вещества в 1 л раствора (моль/л):
См = n / V или См = m/( M V),
где n – количество вещества (моль), V – объем в литрах, М – молярная масса, m – масса растворенного вещества.
Например, раствор, содержащий в 1л 4,00г NaOH (МNaOH =40 г/моль), называют децимолярным (0,1М).
3. Нормальная концентрация (Сн, N) (нормальность) – число эквивалентных масс растворенного вещества в одном литре раствора (моль/л):
Сн = m/(Э V),
где m -масса растворенного вещества, V – объем в литрах, Э – эквивалентная масса.
Э = М/ (n∙В), где (n∙В)– общая валентность.
Практически, чтобы рассчитать эквивалентную массу кислоты, нужно разделить её молярную массу на основность:
( Э (HNO3) = М/1, Э (H2SO4) = М/2, Э (H3PO4) = М/3 ).
Для определения эквивалентной массы основания необходимо разделить его молярную массу на число гидроксогрупп, участвующих в реакции:
( Э (NaOH) = М/1, Э (Ca(OH)2) = М/2, Э (Al(OH)3) = М/3 ).
Эквивалент соли рассчитывается как частное от деления молекулярной массы соли на произведение валентности металла на число его атомов:
( Э (NaCl) = М/1, Э (Na2SO4) = М/2, Э (FeCl3) = М/3,
Э (Al2(SO4)3) = М/6 ).
Например, раствор, содержащий 4,9г H2SO4 в 1л, называется децинормальным ( N = 4,9/49 =0,1н ), раствор, содержащий 0,4г NaOH в 1л, – сантинормальным ( N = 0,4/40 = 0,01н ).
4. Моляльная концентрация (С m)(моляльность) − количество молей растворенного вещества в 1 кг растворителя (моль/кг). С m = n / mр-ля
Например, моляльность раствора, полученного растворением 0,1моль сахарозы (34,2г) в 1кг воды равна 0,1 моль/кг.
5. Молярная доля (X) (мольная доля) есть отношение количества вещества (моль) компонента, содержащегося в данной системе, к общему количеству вещества системы (моль). Её можно выражать в долях единицы и в процентах(%).
Например, молярная доля глюкозы (М = 180 г/моль) в растворе, полученном при растворении 0,1 моль её (18г) в 10 моль (180г) воды (М = 18 г/моль) равна:
X = 0,1 / (0,1+10) = 0,0099 (0,99%).
6. Титр раствора (Т) показывает массу (г) растворенного вещества, содержащегося в 1 мл раствора. Например, в 1л 0,01н. КОН содержится 0,561г КОН. Титр этого раствора равен: Т = 0,561 / 1000 = 0,000561 г/мл
Примеры решения задач
Пример 1. В 150 г воды растворили 50 г KCl. Найти % концентрацию соли.
Решение. Масса раствора складывается из массы растворенного вещества (KCl) и растворителя (воды).
m раствора = m KCl + m воды = 5 + 150 = 200 г
Находим массовую доля KCl в растворе
W = m KCl / m р-ра
W =50 /200 = 0,25 или 25%-ый раствор.
81. Сколько (моль) FeSO4.7H2O надо прибавить к 100 мл воды, чтобы получить 10%-ный раствор FeSO4?
Ответ: 0,18 моль.
82. 125 л хлороводорода (н.у.) растворили в 500 мл воды. Определите массовую долю HCl в полученном растворе.
Ответ: 29%.
83. В каком объёме 1 М раствора серной кислоты содержится 4,9 г H2SO4? Ответ: 50 мл.
84. Сколько (мл) 20%-ного раствора соляной кислоты с плотностью 1,098 г/мл потребуется для приготовления 1 л 2 М раствора? Ответ: 332,4 мл
.
85. Сколько (мл) 0,5 N раствора ВaСl2 можно приготовить из 24,4 г ВаСl2.2Н2О? Ответ: 400 мл.
86. Вычислите нормальную концентрацию и титр Н3РО4 в 13%-ном растворе, плотность которого 1,07 г/мл. Раствор предназначен для реакции, идущей до конца.
Ответ: 4,26 N; 0,139174 г/мл.
87. В какой массе эфира надо растворить 3,04 г анилина C6H5NH2, чтобы получить раствор, моляльность которого равна 0,3 моль/кг? Ответ: 109 г.
88. Какой объём 3 N раствора должен быть прибавлен к 900 мл 0,5 N раствора этого же вещества, чтобы концентрация стала 1 N? Ответ: 225 мл.
89. На реакцию с раствором, содержащим 0,498 г Na2B4O7.10H2O, израсходовано 25,2 мл раствора HCl. Вычислите молярную концентрацию эквивалента (нормальную концентрацию) раствора соляной кислоты.
Ответ: 0,1032 N.
90. К 250 г 10%-ного раствора кислоты добавили 500 г раствора той же кислоты с неизвестной массовой долей и получили 25%-ный раствор. Определите массовую долю кислоты в добавленном растворе.
Ответ: 32,5%.
Давление пара растворов
При данной температуре давление насыщенного пара над каждой жидкостью – величина постоянная. При растворении в жидкости какого-либо вещества давление насыщенного пара этой жидкости понижается.
Таким образом, давление пара над раствором нелетучего вещества в растворителе всегда ниже давления пара над чистым растворителем при той же температуре. Согласно закону Рауля относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и выражается соотношением:
pо - р n
――― ═ ――― ,
po N + n
где po – давление пара над чистым растворителем;
р – давление пара растворителя над раствором;
n - количество растворенного вещества, моль
N – количество растворителя, моль.
Осмос
В гомогенном растворе частицы растворенного вещества и растворителя равномерно распределяются по всему объему раствора. Если поместить в цилиндр концентрированный раствор сахара, а поверх него осторожно налить чистую воду, то вначале сахар и вода будут распределены в объеме раствора не равномерно. Через некоторое время вследствие теплового движения – диффузии сахар и вода равномерно распределятся по всему объему жидкости.
Вместо цилиндра используем U ─ образную трубку, снабженную внизу мембраной (полупроницаемой перегородкой), через которую могут проникать только молекулы воды (растворителя), но не молекулы (ионы) растворенного вещества. Заполним правое колено водой (чистым растворителем), а левое – раствором сахарозы в воде так, чтобы уровни жидкости в обоих коленах были одинаковыми. Выравнивание концентраций осуществляется в одностороннем порядке, только за счет перехода части молекул воды из правой части прибора в левую, где концентрация сахарозы выше. В итоге уровень жидкости в правом колене начнет снижаться, а в левом возрастать, пока не установится некоторая разность столбов, отвечающая давлению, при котором односторонняя диффузия прекратится.
 |
Процесс самопроизвольного перехода (диффузии) растворителя через полупроницаемую перегородку из той части системы, где концентрация растворенного вещества ниже, в другую, где она выше, называется осмосом. Давление, которое нужно приложить к раствору, чтобы прекратить осмос, т.е. проникновение в него через полупроницаемую перегородку чистого растворителя, называется осмотическим давлением ( рис. 10)
Рис.10
Для растворов неэлектролитов зависимость осмотического давления от концентрации и температуры раствора выражается законом Вант-Гоффа:
Осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объём, равный объёму раствора.
Математическое выражение осмотического закона Вант-Гоффа:
Р = См∙ R∙Т,
где Р – осмотическое давление, Па; См– молярная концентрация, моль/л;
R − универсальная газовая постоянная, равная 8,314 Дж/моль∙К;
Т – абсолютная температура раствора, К
или Р = (n·R Т) / V,
где n – количество растворенного вещества, моль; n = m/M, m – масса растворенного вещества, г; а М – его молярная масса, г/моль; V – объем раствора, л.
Осмос лежит в основе целого ряда физиологических процессов, происходящих в организме человека и животных. Посредством осмоса осуществляется усвоение пищи, распределение питательных веществ, переносимых с кровью, и жидкостный обмен в тканях.
Примеры решения задач
Пример 1. Для определения относительной молекулярной массы вещества, являющегося неэлектролитом, его навеска массой 1,764 г была растворена в воде и объем раствора доведен до 100 мл. Измеренное осмотическое давление раствора оказалось равным 2,38∙102 КПа при 20оС. Рассчитайте молярную массу указанного вещества.
Решение. В растворе объемом 1 м3 (103л) масса вещества составляет 17640 г. Из уравнения Вант-Гоффа, подставляя в это выражение экспериментальные данные, получим:
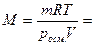
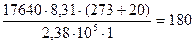 г/моль
г/моль
Пример 2. Навеска вещества массой 12,42 г растворена в воде объемом 500 мл. Давление пара полученного раствора при 25 0С равно 3297,8 Па. Как по этим данным найти молярную массу растворенного вещества?
Решение. Для определения молярной массы растворенного вещества М1 надо вычислить количество молей растворенного вещества ν1, пользуясь законом Рауля:
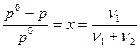 ,
,
где : р - давление пара над раствором;
р0 – давление пара над чистой водой, его значение при 250С согласно табл 14 равно 3306 Па;
ν2 = 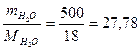 моль, после подстановки в закон Рауля получим:
моль, после подстановки в закон Рауля получим:
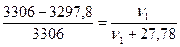 ;
;
отсюда ν1 = ν(вещества) = 0,069 моль;
М1 = 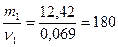 г/моль
г/моль
Пример 3. Раствор, содержащий 0,85 г хлорида цинка ZnС12 в 125 г воды, замерзает при -0,23 °С. Определите кажущуюся степень диссоциации хлорида цинка в этом растворе.
Решение. Выразим прежде всего моляльную концентрацию раствора в молях на 1000 г воды. Так как молярная масса хлористого цинка равна 136 г/моль, то
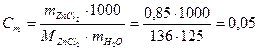 моль/кг
моль/кг
Для растворов электролитов величина понижения точки замерзания рассчитывается по формуле
∆tзам. = i∙ К∙Ст
Криоскопическая постоянная К для воды из табл. равна 1,86 оС следовательно, изотонический коэффициент данного раствора составит:
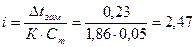
Степень диссоциации связана с величиной изотонического коэффициента соотношением:
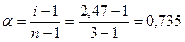 или 73,5%
или 73,5%
Здесь п – количество ионов, образующихся при диссоциации молекулы ZnCl2.
Контрольные задания
91. Давление пара воды при 10° С составляет 1227,8 Па. Сколько граммов метилового спирта СН3ОН следует растворить в 388 г воды , чтобы понизить давление пара до 1200 Па? Ответ: 16 г.
92. Раствор 1,15 г глицерина в 50 мл ацетона кипит при 56,6оС. Используя табличные данные по температуре кипения чистого ацетона и его плотности, вычислите эбуллиоскопическую константу ацетона. Ответ: 1,56.
93. В каких объемных отношениях надо взять воду и этиленгликоль, чтобы приготовленный из них антифриз замерзал примерно при -20оС? Ответ: 5 : 3
.
94. Какое осмотическое давление имеет 17%-ный водный раствор сахарозы С12Н22О11 при 20оС, если плотность данного раствора составляет 1,067 г/мл?
Ответ: 1,29∙106 Па.
95. Раствор анилина С6Н5NH2 в диэтиловом эфире при 25оС имеет давление пара 67319 Па. Рассчитайте процентную концентрацию данного раствора.
Ответ: 7,2%.
96. Раствор, содержащий неэлектролит массой 55,4 г в 2,5 л воды, кипит при 100,16оС. Чему равна молярная масса данного неэлектролита? Ответ: 72 г/моль.
97. В каком количестве воды надо растворить 6,84 г глюкозы С6Н12О6, чтобы давление пара воды, равное при 65оС 250 гПа, снизилось до 248 гПа? Ответ: 84,8 г.
98. Найдите относительную молярную массу неэлектролита, если его 10%-ный раствор замерзает при -1,15оС.
Ответ: 180 г/моль.
99. Сколько воды надо прибавить к 5 л раствора сахара, чтобы понизить его осмотическое давление в 4 раза?
Ответ: 15 л.
100. Растворением 39,7 г мочевины (NH2)2CO в воде было получено 3 л раствора. Какое осмотическое давление имеет данный раствор при 5оС и до какой температуры его надо нагреть, чтобы повысить осмотическое давление на 25 кПа? Ответ: 5,1∙105 Па; 292 К.
РЕАКЦИИ ИОНОГО ОБМЕНА
Примеры решения задач
Пример 1. ПР(РbSО4) = 2,2.10-8. Чему равна концентрация ионов Рb2+ и SО42- в насыщенном растворе сульфата свинца и его растворимость, выраженная молярной и массовой концентрациями?
Решение.
В насыщенном растворе сульфата свинца существует гетерогенное равновесие: РbSО4 (т)↔ Рb2+(р-р) + SО42-(р-р)
х х х
ПР(РbSО4)= 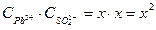
Растворимость бинарного электролита равна молярной концентрации каждого из его ионов:
s=х = 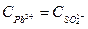 =
= 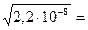 1,5 10-4 моль/л.
1,5 10-4 моль/л.
Растворимость соли, выраженная массовой концентрацией, равна : s∙М= 1,5 ·10-4 моль/л ·303 г/моль = 0,0455 г/л.
Пример 2. Составьте уравнения реакций, протекающих в водных растворах, в молекулярной, ионной и сокращенной ионной формах: 1) между сульфидом натрия и сульфатом меди (II), 2) между гидроксидом железа (III) и соляной кислотой.
Решение.
Решение задачи разобьем на этапы:
а) составляем уравнение реакции в молекулярной форме: Na2S + CuSO4 = CuS↓ + Na2SO4
б) составляем уравнение реакции в ионной форме, изобразив формулы растворимых сильных электролитов в виде ионов, на которые они диссоциируют практически полностью, а формулы остальных веществ (например, выпадающих в осадок или слабых электролитов) оставим без изменения:
2 Na+ +S2- + Cu2+ + SO42- = CuS↓ + 2Na+ + SO42-
в) исключаем из правой и левой частей одинаковые количества одноименных ионов (они подчеркнуты);
г) записываем уравнение в сокращенной ионной форме:
S2- + Cu2+ = CuS↓
2. а) составляем уравнение реакции в молекулярной форме:
Fe(OH)3 + 3 HCl = FeCl3 + 3H2O
б) составляем уравнение реакции в ионной форме, оставляя в виде молекул труднорастворимый гидроксид железа и воду, являющуюся слабым электролитом:
Fe(OH)3 ↓ + 3 H+ + 3 Cl- = Fe3+ + 3 Cl- + 3H2O
в) исключаем из правой и левой частей одинаковые количества одноименных ионов (они подчеркнуты);
г) записываем уравнение в сокращенной ионной форме:
Fe(OH)3 ↓ + 3 H+ + = Fe3+ + 3H2O
Пример 3. Вычислите концентрацию ионов СН3СОО- в растворе, 1 л которого содержит 0,1 моль СН3СООН и 0,2 моль НCl, считая диссоциацию HCl полной.
Решение.
1. Напишем уравнение диссоциации уксусной кислоты:
СН3СООН↔СН3СОО- + Н+
2. Напишем выражение константы диссоциации уксусной кислоты:
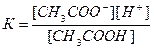
3. Соляная кислота является сильной и диссоциирует полностью, поэтому [H+]=0,2
HCl↔H+ + Cl-
4. Подставим все значения в выражение константы диссоциации уксусной кислоты:

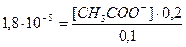
[CH3COO-] = 9.10-6
Пример 4. Вычислите рН 1%-ного раствора уксусной кислоты. Плотность раствора принять равной 1.
Решение.
Вычислим молярную концентрацию уксусной кислоты, учитывая, что плотность раствора равна 1, тогда объем раствора равен массе и равен 100 мл:

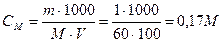
Напишем уравнение диссоциации уксусной кислоты:
х х
СН3СООН↔СН3СОО- + Н+
1 моль 1 моль
Напишем выражение константы диссоциации уксусной кислоты:
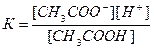
Подставим все значения в выражение константы диссоциации уксусной кислоты:
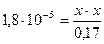
х = [ H + ] = 1,7.10-3
Вычислим значение рН:
рН = -lg[H+] = - lg 1,7.10-3= - (lg1,7 + lg10-3) = 2,8
Контрольные задания
101. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) CdCl2 и K2S;
б) КНSiО3 и НСl.
102. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Cu2+ + CO32- = CuCO3↓;
б) 2Н+ + 2NO2- = NO↑ + NO2↑ + H2O.
103. Какое из веществ (KHCO3, CdSO4 или K3PO4) будет взаимодействовать с KOH? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
104. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) KHCO3 и H2SO4;
б) MgSO4 и Na3PO4.
105. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) 3Bа2+ + 2РО43- = Bа3(РО4)2↓;
б) NH4+ + OH- = NH4OH.
106. Какое из веществ: Zn(ОН)2, CuSO4 или K2CrO4 будет взаимодействовать с КОН? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
107. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) K3BO3 и HNO3;
б) K3PO4 и CaCl2.
108. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) SO32- + 2H+ = H2O + SO2↑;
б) Hg2+ + 4Br- = [HgBr4]2-.
109. Какое из веществ: KHCO3, Cu(NO3)2 или Ca(OH)2 будет взаимодействовать с HCl? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
110. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) AgNO3 и ВаСl2;
б) MnCl2 и NH4OH.
111. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Cd2+ + 4NH4OH = [Cd(NH3)4]2+ + 4 H2O;
б) СО32- + 2H+ = CO2↑ + H2O.
112. Какое из веществ: Na2CO3, BaCl2 или Cu(NO3)2 будет взаимодействовать с H2SO4? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
113. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) ZnCl2 и Na2CO3;
б) NaNO2 и H2SO4.
114. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а)Pb2+ + 2IO3- = PbIO3↓;
б) NH4OH + H+ = NH4+ + H2O.
115. Какое вещество: ZnSO4, ZnCl2 или К2СrO4 будет взаимодействовать с Pb(NO3)2? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
116. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) CH3COOLi и H2SO4;
б) Na2S и CoSO4.
117. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Mg2+ + 2OH- = Mg(OH)2↓;
б) Н+ + НСОО- = НСООН.
118. Какое вещество: H2SO4, Mg(NO3)2 или Na2CO3 будет взаимодействовать с K2SiO3? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
119. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) HCOONa и H2SO4;
б) Bi(NO3)3 и K3PO4.
120. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Сr3+ + 4OH- = [Cr(OH)4]-;
б) 2Ag+ + CO32- = Ag2CO3↓.
V. IX ГИДРОЛИЗ СОЛЕЙ
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды – кислую, щелочную или нейтральную.
Например, водный раствор нитрата алюминия Al(NO3)3 имеет кислую среду (рН < 7), раствор карбоната натрия Na2CO3 – щелочную среду (рН > 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 – нейтральную среду (рН = 7). Эти соли не содержат в своем составе ионы водорода Н+ или гидроксид-ионы ОН¯, которые определяют среду раствора. Изменение рН объясняется тем, что в водных растворах соли подвергаются гидролизу.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Например, раствор ацетата натрия CH3COONa имеет щелочную реакцию среды. Эта соль, как сильный электролит, при растворении в воде полностью диссоциирует на ионы Na+ и СН3СОО–, которые взаимодействуют с Н+ и ОН– – ионами воды. При этом ионы Na+ не могут связывать ионы ОН– в молекулы, т.к. NaOH является сильным электролитом и существует в растворе только в виде ионов. В то же время ацетат-ионы связывают ионы Н+ с образованием молекул слабого электролита – уксусной кислоты, в результате чего новые молекулы Н2О диссоциируют на Н+ и ОН– – ионы. Эти процессы протекают до тех пор, пока не установится равновесие:
СН3СОО– + Н+ 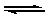 СН3СООН ,
СН3СООН ,
Н2О 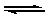 Н+ + ОН–
Н+ + ОН–
Суммарное уравнение одновременно протекающих процессов имеет вид СН3СОО– + Н2О  СН3СООН + ОН–
СН3СООН + ОН–
Это уравнение показывает, что в результате образования слабого электролита (уксусной кислоты) смещается ионное равновесие диссоциации воды и создается избыток ОН– – ионов, а раствор приобретает щелочную реакцию. Применив к данному обратимому процессу закон действующих масс получим:
К = [CH3COOH]∙[OH–] / [CH3COO–]∙[H2O]
Концентрация воды в растворе соли постоянна, поэтому [Н2О] объединяем с К :
К∙[Н2О] = [СН3СООН]∙[ОН–] / [СН3СОО–] = КГ ,
где КГ – константа гидролиза. Чем больше КГ, тем сильнее соль подвергается гидролизу.
Гидролиз – процесс обратимый для многих солей. В состоянии равновесия только часть молекул соли гидролизуется. Количественно гидролиз характеризуется степенью гидролиза (h), выраженной в процентах.
Степень гидролиза равна отношению числа гидролизованных молекул соли к общему числу растворенных молекул:
h = (n / N)·100% ,
где: n – число молекул, подвергшихся гидролизу; N – общее число растворенных молекул соли.
Степень гидролиза можно выразить через ионное произведение воды КW, концентрацию раствора См, константу диссоциации образующегося слабого электролита КЭ:
_____________
h ≈ √ КW/См·КЭ.
Из этой зависимости видно, что степень гидролиза может увеличиться при:
1) увеличении КW, т.е. с повышением температуры; 2) уменьшении концентрации См (при разбавлении раствора); 3) уменьшении КЭ, т.е., чем слабее образующаяся при гидролизе кислота или основание, тем выше степень гидролиза.
Таким образом, степень гидролиза зависит от природы соли, концентрации раствора, температуры.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Гидролизу подвергаются только те соли, в состав которых входят или ионы слабой кислоты, или ионы слабого основания. Если ионы растворённой соли не взаимодействуют с ионами воды, не смещают равновесия диссоциации её, то гидролизу соль не подвергается, при этом среда остается нейтральной.
Гидролизу не подвергаются соли, образованные сильными основаниями и сильными кислотами (NaCl, КNO3, Na2SO4, KMnO4 и др.).
Например, NaCl + HOH  NaOH + HCl.
NaOH + HCl.
В ионной форме это уравнение будет иметь вид:
Na+ + Cl– + HOH  Na+ + OH– + H+ + Cl–
Na+ + OH– + H+ + Cl–
или сокращенно НОН  Н+ + ОН–
Н+ + ОН–
рН = 7.
Гидролизу подвергаются следующие типы солей:
1. Соли, образованные сильным основанием и слабой кислотой. Гидролиз идет по аниону и обусловлен связыванием ионов водорода воды в слабодиссоциируемую кислоту или анион кислой соли:
NaCN + HOH  HCN + NaOH
HCN + NaOH
в ионном виде
Na+ + CN– + HOH  HCN + Na+ + OH–
HCN + Na+ + OH–
CN– + HOH  HCN + OH– pH > 7.
HCN + OH– pH > 7.
Соли, образованные сильным основанием и слабой многоосновной кислотой? гидролизуются ступенчато, при этом получаются кислые соли. Например,
Na2CO3 + HOH  NaHCO3 + NaOH
NaHCO3 + NaOH
CO32– + HOH  HCO3– + OH– pH > 7
HCO3– + OH– pH > 7
Гидролиз по второй ступени протекает незначительно:
NaHCO3 + HOH  H2CO3 + NaOH
H2CO3 + NaOH
HCO3– + HOH  H2CO3 + OH–
H2CO3 + OH–
2. Соли, образованные слабым основанием и сильной кислотой. Гидролиз идет по катиону и обусловлен связыванием гидроксид-ионов воды в малодиссоциируемое основание или катион основной соли. В растворе накапливаются ионы водорода, среда становится кислой. Например:
NH4Cl + HOH  NH4OH + HCl
NH4OH + HCl
в ионном виде
NH4+ + Cl– + HOH  NH4OH + H+ + Cl–
NH4OH + H+ + Cl–
NH4++HOH  NH4OH + H+ pH < 7
NH4OH + H+ pH < 7
Гидролиз солей с многозарядным катионом протекает ступенчато с образованием, как правило, основных солей, а не оснований. Например:
Al(NO3)3 + HOH  AlOH(NO3)2 + HNO3 (1-я ступень)
AlOH(NO3)2 + HNO3 (1-я ступень)
в ионном виде
Al3+ + HOH  AlOH2+ + H+ pH < 7
AlOH2+ + H+ pH < 7
AlOH(NO3)2 + HOH  Al(OH)2NO3 + HNO3 (2-я ступень)
Al(OH)2NO3 + HNO3 (2-я ступень)
AlOH2+ + HOH  Al(OH)2+ + H+
Al(OH)2+ + H+
Гидролиз по третьей ступени практически не протекает.
3. Соли, образованные слабым основанием и слабой кислотой. Гидролиз протекает сильнее, т.к. их ионы – катион и анион одновременно связывают водородные Н+ и гидроксильные ОН– ионы воды, сдвигая равновесие диссоциации её.
При гидролизе таких солей в зависимости от зарядности катиона и аниона могут быть получены следующие вещества:
а) слабое основание и слабая кислота (катион и анион однозарядные) –
CH3COONH4 + HOH  CH3COOH + NH4OH pH ≈ 7
CH3COOH + NH4OH pH ≈ 7
в ионной форме
CH3COO– + NH4+ + HOH  CH3COOH + NH4OH
CH3COOH + NH4OH
б) слабая кислота и основная соль (катион многозарядный) –
Al(CH3COO)3 + HOH  AlOH(CH3COO)2 + CH3COOH
AlOH(CH3COO)2 + CH3COOH
Al3+ + CH3COO– + HOH  AlOH2+ + CH3COOH
AlOH2+ + CH3COOH
в) слабое основание и кислая соль (анион многозарядный) –
(NH4)2S + HOH  NH4HS + NH4OH
NH4HS + NH4OH
NH4+ + S2– + HOH  HS– + NH4OH.
HS– + NH4OH.
При гидролизе солей, образованных слабым основанием и слабой кислотой, реакция среды может быть нейтральной, если образующиеся кислота и основание одинаковы по силе, – слабокислой, если кислота сильнее основания, – слабощелочной, если основание сильнее кислоты.
В большинстве случаев гидролиз является обратимым процессом. Однако некоторые соли подвергаются необратимому (полному) гидролизу. К таким солям относятся соли, образованные слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах. К ним относятся: Al2S3 , Cr2S3 , Fe2(CO3)3 , (NH4)2SiO3 , Al(CN)3 и др. Например, гидролиз сульфида алюминия Al2S3 протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S:
Al2S3 + 6 HOH → 2 Al(OH)3 ↓ + 3 H2S ↑
Здесь продукты гидролиза уходят из сферы реакции в виде осадка Al(OH)3 и в виде газа H2S; равновесие полностью смещается слева направо.
Примеры решения задач
Пример 1. Записать уравнение гидролиза солей: KCl, Na2CO3, Mn(NO3)2, CH3COONH4.
Какое значение рН ( >7, < 7 или ≈7) имеют растворы этих солей?
Решение.
1. Хлорид калия KCl – соль, образованная сильным основанием KOH и сильной кислотой HCl .Такие соли гидролизу не подвергаются, рН водного раствора =7.
2. Карбонат натрия Na2CO3 - соль, образованная сильным основанием NaOH и слабой кислотой H2CO3. Такие соли подвергаются гидролизу по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
СО32- + Н2О ↔ НСО3- + ОН-
Поскольку при гидролизе в свободном виде образуются ионы гидроксила, водный раствор данной соли имеет щелочную среду (рН>7).
Для записи полной ионной формы уравнения следует добавить в правую и левую части уравнения ионы Na+ , которые присутствуют в реакционной смеси, но участия в гидролизе не принимают:
2 Na+ + СО32- + Н2О ↔ НСО3- + ОН- + 2Na+
Объединив ионы в молекулы, получим молекулярную форму уравнения гидролиза:
Na2СО3 + Н2О ↔ NaНСО3 + NaОН
В результате гидролиза образуется кислая соль NaНСО3.
3. Нитрат марганца Mn(NO3)2 - соль, образованная слабым основанием Mn(OH)2 и сильной кислотой HNO3. Такие соли подвергаются гидролизу по катиону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Mn2+ + H2O ↔MnOH+ + H+
Поскольку при гидролизе в свободном виде образуются ионы водорода, водный раствор данной соли имеет кислую среду (рН< 7).
Для записи полной ионной формы уравнения следует добавить в правую и левую части уравнения ионы NО3- , которые присутствуют в реакционной смеси, но участия в гидролизе не принимают:
2NО3- + Mn2+ + H2O ↔MnOH+ + H+ + 2NО3-
Объединив ионы в молекулы, получим молекулярную форму уравнения гидролиза:
Mn(NO3)2 + H2O ↔MnOHNО3 + HNО3
В результате гидролиза образуется основная соль MnOHNО3, гидроксонитрат марганца.
4. Ацетат аммония CH3COONH4 - соль, образованная слабым основанием NН4OH и слабой уксусной кислотой CH3COOH. Такие соли подвергаются гидролизу одновременно по катиону и по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
NH4+ + CH3COO- + H2O ↔ NH4OH + CH3COOH
Поскольку при гидролизе в свободном виде не образуются ни ионы водорода, ни ионы гидроксила водный раствор данной соли имеет близкую к нейтральной среду (рН≈7).
Уравнение гидролиза в молекулярной форме имеет вид:
CH3COONH4 + H2O ↔ NH4OH + CH3COOH
Контрольные задания
121. Составьте молекулярные и ионные уравнения гидролиза солей Li3PO4, KCl, CoSO4. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
122. Составьте молекулярные и ионные уравнения гидролиза солей CuCl2, KCN, Na2 SO4. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
123. Составьте молекулярные и ионные уравнения гидролиза солей (NH4)2СO3, МоSO4, LiNO3. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
124. При смешивании растворов солей Cr2(SO4)3 и Na2SiO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза.
125. Составьте молекулярные и ионные уравнения гидролиза солей NaCN, Pb(NO3)2, K2SO4. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
126. Составьте молекулярные и ионные уравнения гидролиза солей Cr(NO3)3, NaNO3, K2SO3. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
127. При смешивании растворов солей Al(NO3)3 и K2CO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза.
128. Составьте молекулярные и ионные уравнения гидролиза солей ZnSO4, Na3PO4, CsBr. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
129. Составьте молекулярные и ионные уравнения гидролиза солей Bi(NO3)3, BaCl2, Na2SO3. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
130. При смешивании растворов солей AlCl3 и Na2SO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза.
131. Составьте молекулярные и ионные уравнения гидролиза солей Al2(SO4)3, KF, KI. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
132. Составьте молекулярные и ионные уравнения гидролиза солей MnSO4, KNO3, NaF. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
133. Составьте молекулярные и ионные уравнения гидролиза солей Сd(NO3)2, NaCl, KBrO. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
134. При смешивании растворов солей Al2(SO4)3 и K2CO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза.
135. Составьте молекулярные и ионные уравнения гидролиза солей NiCl2, Na3PO4, NaCl. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
136. Составьте молекулярные и ионные уравнения гидролиза солей Mn(NO3)2, K2SiO3, SrSO4. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
137. Составьте молекулярные и ионные уравнения гидролиза солей MgSO4, Na2CO3, Ca(NO3)2. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
138. Напишите молекулярные и ионно-молекулярные уравнения совместного гидролиза Hg(NO3)2 и K2CO3 .
139. Составьте молекулярные и ионные уравнения гидролиза солей NiSO4, Na2S, K3AsO4. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
140. Составьте молекулярные и ионные уравнения гидролиза солей СdBr2, K3PO4, LiI. Какое значение рН (рН ³7, рН £ 7) имеют растворы этих солей?
Метод электронного баланса
основан на сравнении степеней окисления атомов в исходных и конечных веществах. Сущность этого метода можно уяснить на следующем примере.
Пример. Составить электронные уравнения для реакции, протекающей по схеме:
KMnO4 + H3PO3 + H2SO4 ® MnSO4 + H3PO4 + K2SO4 + H2O
1). Расставляем степени окисления атомов.
K+1Mn+7O4-2 + H3+1P +3O3-2 + H2 +1S+6O4-2 = Mn+2S+6O4-2 +
H3 +1P+5O4-2 +K2 +1S+6O4-2 + H2 +1O-2
2). Выписываем элементы, атомы или ионы которых изменяют степени окисления, такими элементами являются Mn и P.
3). Составляем электронные уравнения, то есть схемы изменения зарядов атомов в левой и правой частях реакции:
P3+ - 2e- ® Р5+ ½ 5, процесс окисления
Mn7+ +5e- ® Mn2+ ½ 2, процесс восстановления
4). Общее число электронов, которые присоединяет окислитель, должно быть равно числу электронов, которые отдает восстановитель. Общее наименьшее кратное для отданных и принятых электронов - десять. Делим число 10 на число принятых электронов марганцем и на число отданных электронов фосфором, получим коэффициенты: для марганца - 2, а для фосфора – 5.
5). Найденные коэффициенты 2 и 5ставим перед формулами соединений восстановителя и окислителя.
6) Уравниваем количество ионов калия в правой и левой частях уравнения, подсчитываем число ионов SO42- в правой части, ставим коэффициент 3 перед формулой H2SO4 . Уравниваем число атомов водорода в правой части уравнения, ставим коэффициент 3 перед формулой H2O.
Молекулярное уравнение реакции будет иметь вид:
2KMnO4 + 5H3PO3 + 3H2SO4 = 2MnSO4 + 5H3PO4 + K2SO4 + 3H2O
6). Проводим проверку по количеству атомов кислорода. Вступило в реакцию 35 атомов кислорода. В продуктах реакции атомов кислорода 35. Следовательно, реакция записана, коэффициенты расставлены правильно.
И НЕМЕТАЛЛОВ
Примеры решения задач
Пример 1. Будут ли происходить изменения в водном растворе гидроксида калия, если опустить в них кусочки двухвалентных s-металлов: а) бериллия, б) кальция? Составьте уравнения возможных реакций в молекулярной и электронной формах.
Решение. Оба металла являются элементами IIА – подгруппы, однако лишь кальций проявляет типично металлические свойства.
а) Поскольку бериллий – это амфотерный металл, то он растворим в водно-щелочной среде:
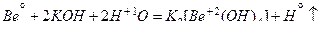


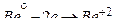 2 1 ; восст-ль, окисляется
2 1 ; восст-ль, окисляется
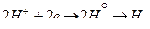 2 1 ; окислитель, вос-ся
2 1 ; окислитель, вос-ся
В итоге образуется водорастворимое комплексное соединение – тетрагидроксобериллат калия. Координационное число катиона бериллия, являющегося комплексообразователем, равно четырём. Акцепторные свойства 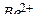 обусловлены наличием четырёх вакантных атомных орбиталей на его внешнем уровне: одной 2 s-АО и трёх 2 p-АО.
обусловлены наличием четырёх вакантных атомных орбиталей на его внешнем уровне: одной 2 s-АО и трёх 2 p-АО.
б) Кальций не реагирует с гидроксидом калия, являющимся типичным основанием. Однако этот металл взаимодействует с растворителем – водой:
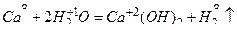


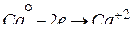 2 1; вос-ль, окис-ся
2 1; вос-ль, окис-ся
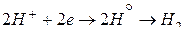 2 1; окис-ль, вос-ся
2 1; окис-ль, вос-ся
В ходе реакции образуется другая щёлочь – гидроксид калия (или гашёная известь).
Пример 2. Сравните между собой электронное строение атомов металлов цезия, бария и лантана, а также их поведение по отношению к кислороду и воде.
Решение. Рассматриваемые элементы соседствуют в шестом периоде таблицы Менделеева; они расположены соответственно в IA, IIA и IIIB – подгруппах. В той же последовательности ослабляются металлические свойства. Цезий (Cs,… 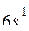 ) – щелочной s-металл с минимальной электроотрицательностью 0,65
) – щелочной s-металл с минимальной электроотрицательностью 0,65  (см. табл. 5 Приложений). Поэтому он наиболее «металличен» и очень энергично взаимодействует как с кислородом (до
(см. табл. 5 Приложений). Поэтому он наиболее «металличен» и очень энергично взаимодействует как с кислородом (до 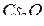 ), так и с водой (до
), так и с водой (до 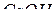 ). Барий (
). Барий ( 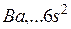 ) – щелочноземельный s-металл с ЭО, равной 0.9
) – щелочноземельный s-металл с ЭО, равной 0.9  . Он также энергично взаимодействует с
. Он также энергично взаимодействует с  (до BaO) и с
(до BaO) и с  (до
(до 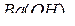 ), но более слабо, чем Cs. Лантан (La,…
), но более слабо, чем Cs. Лантан (La,… 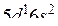 ) – редкоземельный d-металл с ЭО, равной 1,1
) – редкоземельный d-металл с ЭО, равной 1,1  . Он также взаимодействует как с
. Он также взаимодействует как с  (до
(до 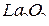 ), так и с
), так и с 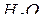 (до
(до 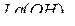 ), но ещё слабее, чем Cs и Ba.
), но ещё слабее, чем Cs и Ba.
Контрольные задания
181. Какая связь существует между восстановительной способностью металлов и их положением в периодической системе? Объясните, почему в водных растворах восстановительную способность можно оценить, используя ряд напряжений металлов, по величине стандартного электродного потенциала. Укажите примеры любых четырёх металлов, вытесняющих кобальт из растворов его солей. Назовите причину этого явления и приведите уравнение электронного баланса одной из соответствующих реакций.
182. Какие периодические характеристики химических элементов могут служить в качестве меры проявления их металлических свойств? У каких элементов из сравниваемых ниже пар металлические свойства выражены более заметно : а) Be и Mg , б) Mg и Al? Из указанных трех металлов выберите те, которые растворимы не только в кислотах, но и в сильных основаниях (щёлочах). Ответ аргументируйте, а также проиллюстрируйте его уравнениями соответствующих реакций в молекулярной и ионной формах.
183. Как зависит сила оснований от «металличности» образующих их элементов? Приведите примеры сильных и слабых оснований, а также оснований средней силы; выделите среди них амфотерные основания и назовите причину проявлений амфотерности. Составьте уравнения реакций между произвольно выбранным амфотерным гидроксидом металла и сильным основанием (щёлочью) в молекулярной и ионной формах.
184. В каком из растворов – NaOH или NH4OH – можно растворить осадок AgCl? Напишите уравнение соответствующей реакции в молекулярной и ионной формах.
185. Объясните различия восстановительной способности атомов в ряду металлов IA-подгруппы, исходя из значений энергии ионизации и электроотрицательности . Какой из щелочных металлов наиболее энергично взаимодействует с водой, галогенами, амфотерными металлами? Составьте уравнения реакций этого металла и H2 O в молекулярной и электронной формах.
186. Опишите наблюдаемые особенности поведения металлов при взаимодействии их с разбавленной и концентрированной серной кислотой. Какие металлы и почему окисляются концентрированной H2 SO4? Как различаются продукты окисления в зависимости от активности реагирующего металла? Приведите молекулярные и электронные уравнения реакций магния с разбавленной и концентрированной серной кислотой. Назовите также металлы, которые с ней не реагируют.
187. Сплав серебра с медью (биллон) подвергали последовательному воздействию азотной и соляной кислот. В каком из растворов – едкого натра или нашатырного спирта - можно растворить выпавший осадок? Составьте уравнения осуществимых реакций в молекулярной и ионной формах.
188. Как ведут себя различные металлы в отношении разбавленной и концентрированной азотной кислоты? В каких случаях, как и почему результат этого воздействия зависит от активности металла? Приведите примеры реакций одного из металлов с разбавленной и концентрированной HNO3; составьте соответствующие уравнения электронного баланса. Назовите те металлы, которые не реагируют с этой кислотой.
189. Осуществите следующие превращения: Hg  HgSO4
HgSO4  HgO
HgO  HgCl2
HgCl2  HgO. Для окислительно-восстановительных реакций приведите уравнения электронного баланса, реакции ионного обмена запишите в молекулярной и ионной формах.
HgO. Для окислительно-восстановительных реакций приведите уравнения электронного баланса, реакции ионного обмена запишите в молекулярной и ионной формах.
190. Осуществите следующие превращения: Pb  Pb2+
Pb2+  [ Pb( OH4)]2-; составьте уравнения соответствующих реакций. Учтя электронную формулу иона Pb2+, покажите, какие его вакантные орбитали участвуют в образовании донорно-акцепторных связей в комплексном катионе.
[ Pb( OH4)]2-; составьте уравнения соответствующих реакций. Учтя электронную формулу иона Pb2+, покажите, какие его вакантные орбитали участвуют в образовании донорно-акцепторных связей в комплексном катионе.
191. Будет ли вытесняться водород из воды при контакте ее с медью? Составьте уравнения возможных реакций:
а) Cu + HCl; в) Cu + HCl (конц.);
б) Cu + HNO3 (конц.); г) Cu + HCl + O2.
Составьте для них уравнения электронного баланса. Объясните причину невозможности протекания остальных реакций.
192. Сравните отношение серебра и меди к разбавленным и концентрированным кислотам: а) HCl; б) H2 SO4; в) HNO3. Укажите схемы соответствующих превращений, дополните их уравнениями электронного баланса.
193. Предложите способ очистки сточных вод, в которых присутствуют токсичные примеси ионов ртути, кадмия, цинка, свинца, олова. Укажите уравнения соответствующих реакций в молекулярной и ионно-электронной формах.
194. Осуществите следующие превращения:
Sn  Sn(NO3)2
Sn(NO3)2  Sn(OH)2
Sn(OH)2  SnCl2
SnCl2  SnCl4
SnCl4  Sn.
Sn.
Для окислительно-восстановительных реакций приведите уравнения электронного баланса; реакции ионного обмена запишите в молекулярной и ионной формах.
195. Ржавая окраска на поверхности водосливных раковин и других резервуаров обусловлена отложением нерастворимого в воде гидроксида железа (III). Предложите химический способ очистки от ржавчины; составьте соответствующие уравнения реакций.
196. Объясните, как будут реагировать с избытком NaOH растворы следующих солей: а) BeCl2; б) MgCl2; в) ZnCl2; г) NaHCO3; д) CuOHCl. Укажите уравнения протекающих реакций в молекулярной и ионной формах.
197. Написать уравнения реакция взаимодействия амфотерных гидроксидов Al(OH)3 и Zn(OH)2 с кислотами и щелочами. Назвать продукты реакции.
198. Закончить уравнения реакций между следующими веществами и назвать продукты реакций:
а) Fe2O3 + SO2 ------>
б) Na2O + ZnO ------>
в) K2O + Al2O3 ------->
г) Al2(SO4)3 + Ba(NO3)2 ------->
д) NaH2PO4 + NaOH ------->
е) Ba(HCO3)2 + Ba(OH)2 ------->
ж) Ca(HCO3)2 + Na2CO3 ------->
з) MgCl2 + Mg(OH)2 ------>
199. Написать уравнения реакций образования средних и кислых солей при взаимодействии следующих веществ, назвать продукты реакций:
а) H2SO4 + NaOH ------>
б) H2SO4 + Ca(OH)2 ------>
в) Na2CO3 + HCl ------->
200. Написать уравнения реакций образования средних и основных солей при взаимодействии следующих веществ:
а) H2SO4 + Al(OH)3 ------>
б) Н3РО4 + Са(ОН)2 ------>
Определение жёсткости воды
Содержание в природной воде ионов кальция и магния обуславливают её жесткость.
Различают постоянную (ПЖ) и временную, карбонатную (КЖ) жёсткость воды. Постоянная жёсткость обусловлена присутствием в воде сульфатов, хлоридов, нитратов и других растворимых солей кальция и магния (за исключением гидрокарбонатов). Постоянная жёсткость при кипячении не изменяется. Гидрокарбонаты кальция и магния составляют временную (карбонатную) жёсткость воды. Её можно устранить кипячением:
Са(НСО3)2 –® CaСO3¯ + CO2 + Н2O
Суммарная концентрация катионов Ca2+ и Мg2+ называется общей жёсткостью (ОЖ = ПЖ + КЖ). Жёсткость воды выражают в миллимолях на литр (ммоль/л).
Гидрокарбонаты кальция и магния создают в воде щелочную реакцию вследствие гидролиза, поэтому временную жёсткость можно определить титрованием воды раствором cерной или соляной кислоты:
Са(НСО3)2 + H2SO4 –® CaSO4 + 2CO2↑ + 2Н2O
Mg(НСО3)2 + 2HCl –® MgCl2 + 2CO2↑ + 2Н2O
При титровании растворов солей слабой кислоты и сильного основания скачок титрования находится в кислой среде, т.е. в качестве индикатора можно использовать метиловый оранжевый.
С1/Z(HCl) . Vср р-ра (HCl) . 1000
КЖ = __________________________________________ (ммоль/л)
V(H2O)
Общая жёсткость воды количественно определяется с помощью комплексонометрического титрования пробы воды раствором трилона Б с индикатором хромоген чёрный.
Расчёт общей жёсткости воды (ОЖ) производится по следующей формуле:
С(1/z тр.Б) . Vср (тр.Б) . 1000
ОЖ = ___________________________________ ммоль/л)
V(H2O)
Примеры решения задач
Пример 1. Определите молярную массу эквивалента ортофосфорной кислоты в реакции её нейтрализации гидроксидом калия с образованием соответствующего моногидрофосфата.
Решение. Из уравнения указанной реакции

следует, что фактор эквивалентности 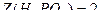
Таким образом,  .
.
Пример 4. Рассчитайте молярную массу эквивалента перманганат-анионов, восстанавливаемых в кислой среде водного раствора.
Решение. В кислой среде осуществляется следующая полуреакция восстановления: MnO-4
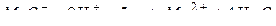
Как видно, Z = 5, 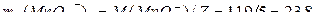 (г / моль).
(г / моль).
Контрольные задания
211. Для определения общей кислотности желудочного сока 5 мл сока оттитровали раствором щелочи с С(1/ZХ) = 0,09 моль/л в присутствии фенолфталеина. На реакцию израсходовано 2,8 мл раствора щёлочи. Рассчитайте кислотность (рН) анализируемого сока. (Ответ:1,3).
212. Сколько миллилитров раствора серной кислоты с плотностью 1,84 г/мл
(w = 95,6 %) необходимо взять для приготовления 2 л раствора с С(1/ZH2SO4) = 0,1 моль/л? (Ответ:5,57 мл).
213. Определите титр и нормальную концентрацию раствора соляной кислоты с плотностью 1,14 г/мл (w = 28,2 %). (Ответ:0,3215 г/мл; 8,81моль/л).
214. Сколько граммов Na2CO3.10H2O потребуется для приготовления 500 мл раствора с С(1/ZХ) = 0,12 моль/л? в реакции полного ионного обмена? (Ответ:8,58 г).
215. Определите титр и молярную концентрацию эквивалента раствора NH4ОН, 10 мл которого оттитровывались 15 мл раствора серной кислоты, титр которого равен 0,005020 г/мл. (Ответ: 0,005379 г/мл; 0,154 моль/л).
216. Найдите титр раствора серной кислоты, если навеска карбоната натрия, равная 0,5330 г, после растворения оттитровывается 12 мл раствора кислоты.
(Ответ: 0,04106 г/мл).
217. Какой объём раствора серной кислоты с плотностью 1,4 г/мл (массовая доля 50,5 %) нужно взять для приготовления двух литров раствора с титром, равным 0,0049 г/мл?
(Ответ:13,86 мл).
218. Рассчитайте временную жёсткость воды, если на титрование 250 мл ее в присутствии индикатора метилового оранжевого было затрачено 7,5 мл раствора соляной кислоты с С(1/ZНС1) = 0,1 моль/л. (Ответ: 3 ммоль/л).
219. Рассчитайте временную жёсткость воды, если на титрование 100 мл её пошло в среднем 3,0 мл раствора серной кислоты, титр которого равен 0,004850 г/мл. (Ответ: 2,97 ммоль/л).
220. Рассчитайте, сколько граммов соли Са(НСО3)2 содержится в 4 м3 воды, временная жёсткость которой составляет 5 ммоль/л. (Ответ: 3240 г).
ПРИЛОЖЕНИЕ
Таблица 1
Слабых электролитов
| Название | Химическая формула | Константа диссоциации
К1 К2 К3 | ||
| Азотистая кислота | HNO2 | 5,1×10-4 | ||
| Борная | H3BO4 | 5,6×10-10 | ||
| Кремниевая | H2SiO3 | 1,3×10-11 | ||
| Муравьиная | HCOOH | 1,8×10-4 | ||
| Мышьяковая | H3AsO4 | 6,0×10-3 | 1×10-7 | 3,0×10-12 |
| Плавиковая | HF | 6,8×10-4 | ||
| Сероводородная | H2S | 1×10-7 | 1×10-14 | |
| Синильная | HCN | 6,2×10-10 | ||
| Угольная | H2CO3 | 4,5×10-7 | 4,8×10-11 | |
| Уксусная | CH3COOH | 1,8×10-5 | ||
| Фосфорная | H3PO4 | 7,6×10-3 | 6,2×10-8 | 4,2×10-13 |
| Хромовая | H2CrO4 | 1,1×10-1 | 3,2×10-7 | |
| Гидроксид аммония | NH4OH | 1,8×10-5 | ||
Таблица 3
ТАБЛИЦА ВАРИАНТОВ
КОНТРОЛЬНЫХ ЗАДАНИЙ
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 0 | 1,11,21, 31,41,51,61,71,81,91,101 ,111,121,131,141, 151,161 ,171,181,191,201 ,211 | 2,12,22, 32,42,52,62,72,82,92,102, 112,122, 132,142, 152,162 ,172,182,192,202, 212 | 3,13,23, 33,43,53,63,73,83,93,103 ,113,123,133,143 ,153,163,173, 183,193 ,203,213 | 4,14,24, 34,44,54,64,74,84,94,104, 114,124, 134,144, 154,164, 174,184 ,194,204,214 | 5,15,25, 35,45,55,65,75,85,95,105, 115,125 ,135,145,155,165 ,175,185,195,205 ,215 | 6,16,26 ,36,46,56,66,76,86,96,106 ,116,126,136,146, 156,166,176,186 ,196,206,216, | 7,17,27 ,37,47,57,67,77,87,97,107 ,117,127,137,147 ,157,167,177,187 ,197,207,217 | 8,18,28, 38,48,58,68,78,88,98,108, 118,128, 138,148 ,158,168,178,188 ,198,208,218 | 9,19,29 ,39,49,59,69,79,89,99,109 ,119,129,139,149 ,159,169,179,189 ,199,209,219 | 10,20,30, 40,50,60, 70,80,90, 100,110 ,120, 130,140 ,150, 160,170 ,180, 190,200 ,210, 220 |
| 1 | 1,12,23, 34,45,56,67,78,89,90,101 ,112,123,134,145, 156,167, 178,189 ,190,201,212 | 2,13,24, 35,46,57,68,79,80,91,102, 113,125, 135,146, 157,168, ,180,191,202,213 172 | 3,14,25, 36,47,58,69,70,81,92,103, 114,125, 136,147, 158,169 ,170,181,192,203 ,214 | 4,15,26, 37,48,59,60,71,82,93,104, 115,126,137,148,159,160,171,182,193,204,215 | 5,16,27, 38,49,50,61,72,83,94,105 ,116,127,138,149 ,150,161,172,183, 194,205, 216 | 6,17,28, 39,40,51,62,73,84,95,106 ,117,128,139,140 ,151,162,173,184, 195,206,217 | 7,18,.29 .30.41.52.63.74.85.96.107 .118.129.130.141. 152.163. 174.185 .196.207.218 | 8,19,21 ,31,42,53,64,75,86,97,108 ,119,120, 131,142, 153,164, 175,186, 197,208, 219 | 9,16,20, 31,42,54,65,76,87, 98,109, 110, 122,133, 144,155,166,177 ,188,199,201,212 | 10,11,21, 31,41,51, 61,71,81, 91,101, 112 121,131, 141, 151,161, 171, 181,191, 200, 211 |
| 2 | 10,20,30,40,50,60,70,80,90,100,110, 120, 129,139, 149,159, 169,179, 189,199, 209,219 | 9,19,29, 39,49,59,69,79,89,99,109, 119, 130,140, 150,160, 170,180, 190,200, 210,220 | 8,18,28, 38,48,58,68,78,88,98,108 ,118, 127,137 ,147,157,167,177, 187,197 ,207,217 | 7,17,27, 37,47,57,67,77,87,97,107, 117, 128,138 ,148,158,168,178, 188,198, 208,218 | 6,16,26, 36,46,56,66,76,86,96,106, 116, 125,135 ,145,155,165,175 ,185,195,205,215 | 5,15,25, 35,45,55,65,75,85,95,105, 115, 126,136 ,146,156,166,176 ,186,196,206,216, | 4,14,24, 34,44,54,64,74,84,94,104, 114, 123,133, 143,153, 163,173 ,183,193,203,213 | 3,13,23, 33,43,53,63,73,83,93,103, 113, 124,134, 144,154, 164,174, 184,194, 204,214 | 2,12,22, 32,42,52,62,72,82,92,102 ,112, 121,131, 141,151,161,171, 181,191,201,211 | 1,11,21, 31,41,51, 61,71,81, 91,101, 111,125, 133,147 150 122,132,142,152,162,172, 182, 192, 202, 212 |
| 3 | 10,11,21,31,41,51,61,71,81,91,101, 112,122, 133,144, 155,166 ,177,188,199,201, 212 | 9,20,31, 42,54,65,76,87,98,109,110, 121,131 ,141,151,161,171, 181,191 ,200,211 | 8,19,21, 31,42,53,64,75,86,97,108, 119, 129.130. 141.152. 163.174. 185.196. 207.218 | 7,18,.29 .30.41.52.63.74.85.96.107. 118. 120,131, 142,153, 164,175, 186,197, 208,219 | 6,17,28, 39,40,51,62,73,84,95,106, 117, 127,138, 149,150, 161,172, 183,194 ,205,216 | 5,16,27, 38,49,50,61,72,83,94,105, 116, 128,139, 140,151,162,173, 184,195,206,217 | 4,15,26, 37,48,59,60,71,82,93,104, 115, 125,136, 147,158, 169,170, 181,192, 203,214 | 3,14,25, 36,47,58,69,70,81,92,103, 114, 126,137, 148,159, 160,171, 182,193 ,204,215 | 2,13,24, 35,46,57,68,79,80,91,102, 113, 123,134, 145,156,167,178, 189,190,201,212 | 1,12,23, 34,45,56, 67,78,89, 90,101, 112, 124,135,146,157,168,179 ,180, 191,202, 213 |
| 4 | 3,12,25, 37,48,56,60,73,85,91,106, 118,125, 134,148, 159,163, 172,189, 194,207, 218 | 6,14,29, 35,46,52,61,75,83,91,105, 117,129, 135,145, 157,163, 179,183 ,193,213,207 | 9,14,26, 34,48,59,62,74,86,94,102, 116,129, 135,142, 156.163, 172,188, 197,204 ,216, | 4,17,23, 34,45,56,67,78,89,91,102, 113,127, 138,149, 155,168, 173,184, 199,205 ,216 | 5,15,25, 35,45,55,65,75,85,95,103, 113,123, 133143, 157,167, 177,187, 194,201, 218, | 2,12,22, 34,45,58,69,73,84,95,103, 116,128,136,145, 155,164,179,182, 193,205,214, | 1,14,25, 36,48,59,63,71,90,100,110, 120,130, 140,150, 160,170, 180,190, 200,210, 220 | 8,10,15, 29,34,45,51,62,81,91,102, 113,126 ,138,149,156,164, 173.189, 200,205, 213, | 7,15,30, 34,49,56,64,72,83,91,110, 116,129,135,147, 153,162,171,184, 199,210,218 | 9,17,24, 39,45,57, 69,78,90, 98,102, 119, 121,137 141,160, 167,173, 182,191, 203,219 |
| 5 | 2,12,22, 34,45,58,69,73,84, 95,103, 116, 129,135, 145,157 ,163,179,183,193 ,213,207, | 6,14,29 ,35,46,52,61,75,83,91,105, 117, 128,136 ,145,155,164,179, 182,193 ,205,214, | 3,12,25, 37,48,56,60,73,85,91,106, 118, 129,135 ,145,157,163,179, 183,193, 213,207 | 6,14,29, 35,46,52,61,75,83,91,105, 117, 125,134, 148,159, 163,172, 189,194 ,207,218 | 9,17,24, 39,45,57,69,78,90,98,102, 119, 129 ,138,149,156,164, 173.189, 200,205, 213, | 8,10,15, 29,34,45,51,62,81,91,102, 113, 121,137 141,160, 167,173, 182,191, 203,219 | 2,12,22, 34,45,58,69,73,84,95,103, 116, 123,133143,157, 167,177, 187,194, 201,218 | 5,15,25, 35,45,55,65,75,85,95,103, 113, 128,136, 145,155, 164,179, 182,193, 205,214, | 7,15,30, 34,49,56,64,72,83,91,110, 116, 127,138, 149,155, 168,173, 184,199, 205,216 | 4,17,23, 34,45,56 ,67,78,89, 91,102, 113, 129,135,147, 153,162, 171, 184,199, 210,218 |
| 6 | 6,14,29, 35,46,52,61,75,83,91,105, 117, 129,135, 145,157, 163,179, 183,193, 213,207 | 3,12,25, 37,48,56,60,73,85,91,106, 118, 125,134, 148,159, 163,172, 189,194, 207,218 | 6,14,29, 35,46,52,61,75,83,91,105, 117, 129,135, 145,157, 163,179, 183,193, 213,207 | 2,12,22, 34,45,58,69,73,84,95,103, 116, 128,136, 145,155, 164,179, 182,193, 205,214, | 9,17,24, 39,45,57,69,78,90,98,102, 119, 121,137 141,160, 167,173, 182,191, 203,219 | 8,10,15, 29,34,45,51,62,81,91,102, 113, 129 ,138,149,156,164, 173.189, 200,205, 213, | 4,17,23, 34,45,56,67,78,89,91,102, 113, 127,138, 149,155, 168,173, 184,199, 205,216 | 7,15,30, 34,49,56,64,72,83,91,110, 116, 129,135, 147,153, 162,171, 184,199, 210,218 | 5,15,25, 35,45,55,65,75,85,95,103, 113, 123,133 143,157, 167,177, 187,194, 201,218 | 2,12,22, 34,45,58, 69,73,84, 95,103, 116, 128,136,145, 155,164, 179, 182,193, 205, 214, |
| 7 | 5,15,25,35,45,55,65,75,85,95,103,113,123,133143,157,167,177,187,194,201,218 | 7,15,30,34,49,56,64,72,83,91,110,116, 128,136,145,155,164,179,182,193,205,214, | 2,12,22,34,45,58,69,73,84,95,103,116, 129,135,145,157,163,179,183,193,213,207 | 8,10,15, 129,135,147,153,162,171,184,199,127,138,149,155,168,173,184,199,205,216 | 4,17,23,34,45,56,67,78,89,91,102,113,129 ,138,149,156,164,173.189,200,205,213, | 3,12,25,37,48,56,60,73,85,91,106,118, 125,134,148,159,163,172,189,194,207,218 | 2,12,22,34,45,58,69,73,84,95,103,116, 129,135,145,157,163,179,183,193,213,207 , | 6,14,29,35,46,52,61,75,83,91,105,117, 129,135,147,153,162,171,184,199,210,218 | 9,17,24,39,45,57,69,78,90,98,102,119, 128,136,145,155,164,179,182,193,205,214, | 6,14,29, 35,46, 52,61, 75,83,91, 105,117, 121,137 141,160, 167,173, 182,191, 203,219,, |
| 8 | 4,17,23, 34,45,56,67,78,89,91,102, 113, 128,136, 145,155, 164,179, 182,193, 205,214, | 2,12,22, 34,45,58,69,73,84,95,103, 116, 129,135, 145,157, 163,179, 183,193, 213,207 | 2,12,22, 34,45,58,69,73,84,95,103, 116,128, 136,145, 155,164, 179,182, 193,205 ,214, | 7,15,30, 34,49,56,64,72,83,91,110, 116,125, 134,148, 159,163, 172,189, 194,207, 218 | 5,15,25, 35,45,55,65,75,85,95,103, 113,123, 133143, 157,167, 177,187, 194,201, 218 | 3,12,25, 37,48,56,60,73,85,91,106, 118, 121,137 141,160, 167,173, 182,191, 203,219 | 3,12,25, 37,48,56,60,73,85,91,106, 118, 128,136, 145,155, 164,179, 182,193, 205,214, | 9,17,24, 39,45,57,69,78,90,98,102, 119, 129,135, 145,157, 163,179, 183,193, 213,207 | 6,14,29, 35,46,52,61,75,83,91,105, 117, 129,135, 147,153, 162,171, 184,199, 210,218 | 6,14,29, 35,46,52, 61,75,83, 91,105, 117, 129,135,145,157,163,179, 183,193, 213,207 |
| 9 | 6,14,29, 35,46,52,61,75,83,91,105, 117, 121,137 141,160, 167,173, 182,191, 203,219 | 9,17,24, 39,45,57,69,78,90,98,102, 119, 126,138, 149,156, 164,173. 189,200, 205,213, | 9,17,24, 39,45,57,69,78,90,98,102, 119, 128,136, 145,155, 164,179, 182,193, 205,214, | 8,10,15, 29,34,45,51,62,81,91,102, 113, 129 ,138,149,156,164, 173.189, 200,205, 213, | 8,10,15, 29,34,45,51,62,81,91,102, 113,126 ,138,149,156,164 ,173.189,200,205, 213,, | 4,17,23, 34,45,56,67,78,89,91,102, 113, 121,137 141,160, 167,173, 182,191, 203,219 | 4,17,23, 34,45,56,67,78,89,91,102, 113, 127,138, 149,155, 168,173, 184,199, 205,216 | 2,12,22, 34,45,58,69,73,84,95,103, 116, 127,138 ,149,155,168,173, 184,199 ,205,216 | 3,12,25 ,37,48,56,60,73,85,91,106, 118, 125,134, 148,159, 163,172, 189,194, 207,218 | 3,12,25, 37,48,56, 60,73,85, 91,106, 118, 129,135,145, 157,163, 179, 183,193, 213,207 |
СОДЕРЖАНИЕ
I. Общие положения по выполнению контрольных работ…………………………………………………. 3
II. Оформление контрольных работ………………………………………………….… 3
III. Программа для подготовки к экзаменам по химии……………………………………………….….. 4
IV. Список рекомендуемой литературы……………………………………………………. 5
V. Основная часть (содержит примеры решения типовых задач с кратким теоретическим введением в содержание разделов курса химии и контрольные
задания для студентов….……………………..…… 7
VI. Приложение (6 таблиц для выполнения контрольных работ)………………………………………. 131
VII. Таблица вариантов контрольных зада ний…………………………… …… 137
Министерство сельского хозяйства Российской Федерации
федеральное государственное бюджетное образовательное
учреждение высшего профессионального образования
«Казанская государственная академия
ветеринарной медицины имени Н.Э. Баумана»
кафедра биологической и неорганической химии
Неорганическая химия
Методические указания и контрольные задания
для студентов заочной формы обучения
( направления подготовки 111100 «зоотехния», 110900 «технология производства и переработки сельскохозяйственной продукции», 221700 «стандартизация и метрология» , (квалификация «бакалавр»), по специальности 111801 «ветеринария», (квалификация «специалист»).
Казань 2013
ББК 24 (Я 7)
УДК 54 (072)
Печатается по решению Ученого совета факультета биотехнологии и стандартизации ФГБОУ ВПО «Казанская государственная академия ветеринарной медицины имени Н.Э. Баумана» от 21 июня 2013 года, протокол № 6
Рецензенты:
старший преподаватель кафедры общей и органической химии КГМУ, к.х.н. И.В. Федюнина;
доцент кафедры патологической физиологии КГАВМ, к.в.н. Ф.А. Медетханов.
Алимов, А.М.
Неорганическая химия. Методические указания и контрольные задания для студентов заочной формы обучения (направления подготовки 111100 «зоотехния», 110900 «технология производства и переработки сельскохозяйственной продукции», 221700 «стандартизация и метрология», (квалификация «бакалавр»), по специальности 111801 «ветеринария», (квалификация «специалист») /А.М. Алимов, Р.Н. Зиятдинов, Е.Ю. Микрюкова. –Казань: ФГБОУ ВПО КГАВМ, 2013. – 145 с.
Методические указания содержат задания по 13-ти разделам курса общей и неорганической химии и весь необходимый материал для выполнения контрольных работ студентами-заочниками.
Подготовлено на кафедре биологической и неорганической химии ФГБОУ ВПО КГАВМ.
УДК 54 (072)
ББК 24 (Я 7)
ã Алимов А.М., Зиятдинов Р.Н., МикрюковаЕ.Ю.
ã федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Казанская государственная академия ветеринарной
медицины Н.Э. Баумана», 2013
I. ОБЩИЕ ПОЛОЖЕНИЯ
Дата: 2018-11-18, просмотров: 855.