План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Самостоятельная работа (написание электронных, электронно-графических формул)
4. Тестовый контроль
5. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
1). Главное квантовое число (n) – характеризует энергию электрона. Это число равно любому положительному значению n = 1,2,3… 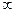 . При n = 1, электрон находится в самом низком энергетическом состоянии. С увеличением n энергия электрона возрастает, одновременно происходит удаление частицы от ядра. Т.е. наряду с энергией главное квантовое число характеризует орбитальный радиус. При
. При n = 1, электрон находится в самом низком энергетическом состоянии. С увеличением n энергия электрона возрастает, одновременно происходит удаление частицы от ядра. Т.е. наряду с энергией главное квантовое число характеризует орбитальный радиус. При 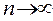 , энергия притяжения становится равной нулю, электрон отрывается от ядра. Происходит ионизация атома. Минимальная энергия, необходимая для отрыва электрона от атома, называется энергией ионизации. Эта величина характеризует электроотрицательность атома. Энергия ионизации уменьшается с возрастанием главного квантового числа и орбитального радиуса.
, энергия притяжения становится равной нулю, электрон отрывается от ядра. Происходит ионизация атома. Минимальная энергия, необходимая для отрыва электрона от атома, называется энергией ионизации. Эта величина характеризует электроотрицательность атома. Энергия ионизации уменьшается с возрастанием главного квантового числа и орбитального радиуса.
2). Орбитальное квантовое число (l) (побочное) – определяет форму атомных орбиталей, а также энергетические (орбитальные) подуровни главного энергетического уровня при данном n (главном квантовом числе). Орбитальное квантовое число l = 0,1,2…(n-1). Для каждого n орбитальное число принимает значение между 0 и (n -1).
При l = 0 – форма орбитали сферическая и называется s – орбиталью
При l = 1 – имеет форму гантели и называется р – орбиталью
При l = 2 – форма орбитали четырехлопастная и называется d – орбиталью
При l = 3 – форма орбитали шестилепестковая и называется f – орбиталью
| Главное квантовое число | Орбиталь | Обозначение орбитали |
| n | n- 1 | |
| 1 | 0 | s |
| 2 | 0,1 | s, р |
| 3 | 0,1,2 | s, р, d |
Для обозначения состояния электрона, главное квантовое число ставят перед символом побочного (орбитального) квантового числа. Например: 4s обозначает n=4; l = 0; 2р обозначает n=2; l = 1.
3) Магнитное (азимутное) квантовое число (ml) – характеризует направление (ориентацию) электронной орбитали (связанного с ним магнитного момента), а также число атомных орбиталей на энергетическом подуровне.
Магнитное квантовое число равно значению от – l до + l, включая 0, оно показывает число атомных орбиталей в данном подуровне, т.е. всего 2l + 1. Например:
S – подуровень, где l = 0, ml = 1, содержит 1 S – орбиталь;
р – подуровень, где l = 1, ml = -1,0,+1, содержит 3р-орбитали, ориентрированные в пространстве по координатным осям x,y,z;
d - подуровень; l = 2, ml = -2,-1,0,+1,+2, содержит 5 d - орбиталей, симметрично ориентированных в пространстве
f – подуровень, где l = 3, ml = -3,-2,-1,0,+1,+2,+3, содержит (7) 7 f – орбиталей разных симметричных ориентации.
Таким образом, с помощью 3 квантовых чисел n, l, ml полностью описывается движение электрона вокруг ядра.
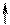
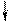
 4) Спиновое квантовое число – характеризует собственное вращательное движение электрона имеет значение
4) Спиновое квантовое число – характеризует собственное вращательное движение электрона имеет значение 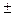 1/2, которое отвечает вращение по часовой и против часовой стрелки. Это вращение описывается понятием "спин". Его обозначают
1/2, которое отвечает вращение по часовой и против часовой стрелки. Это вращение описывается понятием "спин". Его обозначают 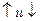 . Электроны, находящиеся на одной орбитали, обладают противоположными спинами
. Электроны, находящиеся на одной орбитали, обладают противоположными спинами 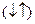 , называются спаренными .
, называются спаренными .
Таким образом, состояние электрона в атоме полностью описывается с помощью 4-х квантовых чисел. Они характеризуют спин, энергию, объем, форму пространства, в котором вероятно пребывание электрона около ядра. При переходе атома из одного состояния в другое меняется квантовое число и перестраиваются электронные облака.
Дальнейшее изучение сложных атомов позволило понять основные принципы заполнения атомных орбиталей.
Дата: 2018-12-21, просмотров: 719.