Цель работы
Выработать навыки работы с типичными окислителями и восстановителями. Изучить условия проведения окислительно-восстановительных реакций и научиться составлять уравнения окислительно-восстановительных реакций электронно-ионным методом с использованием полуреакций.
Теоретическая часть
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окислением называется процесс отдачи атомом, молекулой или ионом электронов, степень окисления при этом повышается:
Al – 3e- = Al 3+
Fe2+ – e- = Fe3+
Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом, степень окисления при этом понижается:
S + 2e- = S2-
Cl2 + 2e- = 2Cl-
Fe3+ + e- = Fe2+
Атомы, молекулы или ионы, отдающие электроны, называются восстановителями. Во время реакции они окисляются
Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются.
Важнейшие восстановители:
1. простые вещества – все металлы и некоторые неметаллы, например, Н2, С, Si, Р4 и др.;
2. водородные соединения щелочных и щелочноземельных металлов, а также водородные соединения некоторых неметаллов, например: HI, HBr, H2O2, H2S, H2Se, H2Te, NH3, PH3, AsH3, SbH3, SiH4, SnH4;
3. оксиды элементов, атомы которых находятся в промежуточной степени окисления. Это оксиды ряда неметаллов – СО, SO2, NO, P2O3, а также низшие оксиды некоторых р- и d-элементов – SnO, FeO, CrO, VO и соответствующие им соли, например, SnCl2, FeSO4 и др.;
4. некоторые кислородсодержащие кислоты и их соли, в состав которых входят атомы элементов в промежуточных степенях окисления, например, H2SO3, H3PO2, Н3РО3 и их соли, а также тиосульфаты (Na2S2O3), дисульфиты (Na2S2O5), дитиониты (Na2S2O4), нитриты;
5. некоторые органические вещества, например, спирты, альдегиды, некоторые карбоновые кислоты (Н-СООН, НООС-СООН), углеводы (С6Н12О6).
Важнейшие окислители:
1. простые вещества – галогены, озон, кислород, сера;
2. оксиды некоторых р- и d-элементов в высоких степенях окисления, например, С l2О7, ClO2, I2O5, SO3, SeO3, SeO2, N2O5, NO2, PbO2, Mn2O7, MnO2, CrO3, V2O5;
3. Кислородсодержащие кислоты некоторых р- и d-элементов в высоких степенях окисления, например, НС lO3, Н5IO6, Н IO3, НВ rO4, НВ rO3, H2SO4, H2SeO4, H2SeO3, HNO3, H2CrO4, H2Cr2O7, HMnO4 и соли этих кислот. К окислителям относятся также кислородсодержащие кислоты галогенов, в которых они проявляют и более низкие степени окисления, например, НС l+1О, НС l+3О2, а также их соли;
4. пероксид водорода Н2О2, пероксиды щелочных и щелочноземельных металлов (Na2O2, BaO2).
Классификация окислительно-восстановительных реакций.
1. Классификация по содержанию восстановителя и окислителя в одном или в нескольких исходных веществах:
а) если восстановитель и окислитель содержатся в одном исходном веществе, то ОВР относится к реакциям внутримолекулярного окисления-восстановления, например:
(N–3Н4)2С r2+6О7 → N2 + С r+32О3 + NH3 + Н2О.
В данной реакции окислитель (С r+6) и восстановитель (N-3) содержатся в одном веществе;
б) если восстановитель и окислитель содержатся в разных исходных веществах, то ОВР относится к реакциям межмолекулярного окисления-восстановления, например:
N-3Н3 + КС l+5О3 → N2° + КС l– + Н2О.
В этой реакции окислитель (С l+ ) и восстановитель (N–3 ) находятся в разных веществах.
2. Классификация по характеру изменения степени окисления атомов одного элемента:
а) если в исходном веществе атомы элемента находятся в одной степени окисления, а в продуктах реакции в двух других (более высокой и более низкой по отношению к исходной степени окисления), то соответствующие ОВР относятся к реакциям диспропорционирования или дисмутации, например:
N+4O2 + Н2О → HN+5O3 + HN+3O2;
б) если в исходных веществах один и тот же элемент находится в двух разных степенях окисления, а в продукте реакции только в одной (промежуточной по отношению к исходным степеням окисления), то соответствующие ОВР относятся к реакциям конпропорционирования или конмутации, например:
H2S–2 + H2S+6О4 (конц.) → S+4О2 + Н2О
Правильно написанное уравнение реакции является выражением закона сохранения массы веществ. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Также и сумма зарядов исходных веществ должна быть равна сумме зарядов продуктов реакции. Для правильного составления уравнений реакций необходимо знать степени окисления. Степень окисления элемента в соединении определяется как число электронов, смещённых от атома данного элемента к другим атомам (при положительной окисленности) или от других атомов к атому данного элемента (при отрицательной окисленности).
Для вычисления степени окисления элемента следует исходить из следующих положений:
1. степень окисления элемента в простых веществах равна 0;
2. алгебраическая сумма степеней окисления атомов, входящих в состав молекулы, равна 0, в состав иона – его заряду;
3. постоянную степень окисления (+1) в соединениях проявляют металлы I А подгруппы (щелочные металлы);
4. постоянную степень окисления (+2) в соединениях проявляют металлы II А подгруппы (щелочноземельные металлы и бериллий);
5. постоянную степень окисления (+3) в соединениях проявляет алюминий
6. водород проявляет степень окисления +1, кроме гидридов металлов ( NaH , CaH 2 и т.п.), в которых водород имеет степень окисления -1;
7. степень окисления кислорода в соединениях -2, за исключением пероксидов (-1) и фторида кислорода OF 2 (+2).
8. степень окисления фтора в соединениях и галогенов в галогенидах ( NaCl , CaBr 2 , HI и т.п.)) ( -1 )/
Применяют два метода составления уравнения реакций: электронного баланса и полуреакций.
Метод электронного баланса.
Этот метод основан на сравнении степени окисления атомов в исходных и конечных веществах. Основное требование состоит в том, что число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем. Надо также знать, какие вещества образуются в результате реакции.
Пример 1. Методом электронного баланса расставить коэффициенты в уравнении реакции, протекающей по схеме:
Н2О–12 + K2Cr+62O7 + H2SO4 → O°2 + Cr+32(SO4)3 + K2SO4 + Н2О
Решение:
1 Данная ОВР относится к реакциям межмолекулярного окисления-восстановления, поэтому расстановку коэффициентов проводим слева направо.
2. Определяем элементы, атомы которых в ходе реакции изменили степень окисления. В данном случае это кислород в пероксиде и хром в хромате. Кислород изменил степень окисления от –1 до 0, а хром от +6 до +3.
3. Записываем электронные уравнения процессов окисления и восстановления. В этих уравнениях число атомов каждого элемента равно их числу в формулах соответствующих исходных веществ. Находим наименьшее общее кратное числа отданных и числа принятых электронов и составляем схему электронного баланса:
2O–1 – 2e– → O20 6 3 O–1 – восстановитель, окисляется
2Cr+6 + 6e– → 2Cr+3 2 1 Cr+3 – окислитель, восстанавливается
4. Находим число атомов кислорода и хрома, умножив каждое из уравнений на соответствующий множитель (первое уравнение на 3, второе на 1). Получаем число атомов кислорода, изменивших степень окисления, которое равно 2∙3 = 6, а число атомов хрома равно 2∙1=2.
5. Расстановку коэффициентов проводим в следующем порядке:
а) уравниваем числа атомов хрома, поставив перед формулами К2С r О7 и Cr2(SO4)3 коэффициент «1»;
б) уравниваем числа атомов кислорода, изменивших степень окисления, поставив перед формулами О2 и Н2О2 коэффициенты «3»;
в) уравниваем числа атомов калия, поставив перед формулой K2SO4 коэффициент «1»;
г) уравниваем числа кислотных остатков SO4–2, поставив перед формулой серной кислоты коэффициент «4»;
д) уравниваем числа атомов водорода, поставив перед формулой воды коэффициент «7»;
е) проверяем, одинаковы ли числа атомов кислорода в левой и правой частях уравнения:
3Н2О2 + К2С r2О7 + 4H2SO4 = 3О2 + Cr2(SO4)3 + K2SO4 + 7Н2О
Пример 2. Методом электронного баланса расставить коэффициенты в уравнении реакции:
F е+3(N+5О3–2)3 → Fe2+3O3 + N+4O2 + О°2
Решение:
2. Данная ОВР относится к реакциям внутримолекулярного окисления-восстановления, поэтому расстановку коэффициентов проводим справа налево.
3. Определяем элементы, атомы которых изменили степень окисления. В данном случае это азот и кислород. Азот изменил степень окисления от +5 до +4, кислород от –2 до 0.
4. Записываем электронные уравнения процессов окисления и восстановления. В этих уравнениях число атомов каждого элемента равно их числу в формулах продуктов реакции. Находим наименьшее общее кратное числа отданных и принятых электронов и составляем схему электронного баланса:
2O–2 – 4e– → O20 6 3 O–2 – восстановитель, окисляется
N+5 + 1e– → 2N+4 2 1 N+5 – окислитель, восстанавливается
5. Находим число атомов азота и кислорода, умножив каждое из электронных уравнений на соответствующий множитель: первое уравнение умножаем на 1, второе на 4. Получаем, что число атомов кислорода, изменивших степень окисления, равно 2∙1 = 2, а соответствующее число атомов азота равно 1∙4 = 4. Но поскольку в формульной единице Fе(NО3)3 содержится 3 атома азота, перед данной формулой придется поставить дробный коэффициент 4/3, что не совсем удобно. Поэтому для избавления от дробного коэффициента найденные числа атомов азота и кислорода умножим на 3. Получается, что степень окисления изменилась у 6 атомов кислорода и у 12 атомов азота.
6. Расстановку коэффициентов проводим в следующей последовательности:
а) уравниваем числа атомов азота, поставив перед формулой F е(N О3)3 коэффициент «4», а перед формулой NO2 – коэффициент «12»;
б) уравниваем числа атомов железа, поставив перед формулой Fe2O3 коэффициент «2»;
в) уравниваем число атомов кислорода, поставив перед формулой О3 коэффициент «3».
6. Проверяем, одинаково ли общее число атомов кислорода в левой и правой частях уравнения:
4F е+3(N+5О3–2)3 → 2Fe2+3O3 + 12N+4O2 + 3О°2
Метод полуреакций.
При составлении уравнений методом полуреакций следует учитывать следующие факторы:
1. записывать в ионном виде восстановитель, окислитель и продукты их взаимодействия, а затем уже приступать к составлению уравнений полуреакций. Сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы – в виде молекул;
2. если исходное вещество содержит больше кислорода, чем продукт реакции, то освобождающийся кислород связывается в кислых растворах с ионом Н+ в воду, а в нейтральных растворах в гидроксид-ионы;
3. если вещество содержит меньше атомов кислорода, чем продукт реакции, то недостаток их восполняется в кислых и нейтральных растворах за счёт молекул Н2О:
Н2О = О–2 + 2Н+
а в щелочных за счёт гидроксид-ионов:
2ОН– = О–2 + Н2О
г) должны быть равны суммарное число и знак электрических зарядов слева и справа от знака равенства.
Реакции окисления-восстановления могут протекать в различных средах: в кислой, нейтральной и щелочной. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления атомов. Схематически эти изменения можно представить так:


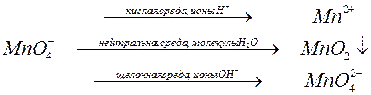
Пример 1. Используя метод полуреакций, расставьте коэффициенты в уравнениях:
1) KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O
2) KMnO4 + Na2SO3 + H2SO4 → MnSO4 + K2SO4 + H2O
3) KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH
Решение.
1. При использовании метода полуреакций поступаем следующим образом:
а) Составляем схему реакции в ионном виде (при этом слабые электролиты и труднорастворимые вещества записываем в виде молекул):
MnO4- + SO32- + OH- → MnO42- + SO42- + H2O.
б) Составляем схему процесса окисления (отдача электронов):
SO32- → SO42-
и далее рассуждаем следующим образом: уравнение – это равенство обеих частей во всех отношениях – и в отношении качества и количества элементов, и в отношении электрических зарядов. Вначале уравниваем обе части по элементам. Для того, чтобы уравнять кислород, необходимо учесть среду реакции: среда щелочная и водная, следовательно, для уравнивания кислорода в нашем распоряжении имеются две кислородсодержащие частицы ОН- и H2O. Поскольку в левой части будущего уравнения пока что меньше атомов кислорода, то в левую часть надо внести более богатую кислородом частицу, т.е. ион OH-, а в правую – менее богатую кислородом молекулу H2O. Нетрудно понять, что коэффициенты при этих частицах будут равны соответственно 2 и 1:
SO32- + 2OH- → SO42- + H2O .
Элементы уравнены. Приступаем к уравниванию электрических зарядов с помощью электронов. Заряд правой части равен -2, а левой -4, следовательно, от левой части необходимо отнять 2 электрона (т.к. заряд электрона равен -1):
SO32- + 2OH- - 2е- → SO42- + H2O .
в) Составляем схему процесса восстановления (присоединения электронов):
MnO4– → MnO42-
рассуждая аналогично предыдущему, находим, что к левой части необходимо прибавить 1 электрон:
MnO4– + е- → MnO42-.
г) Подводим баланс числу отданных и присоединённых электронов:
SO32- + 2OH- - 2е- = SO42- + H2O 1
MnO4- + е- = MnO42- 2
2MnO4- + SO32- + 2OH- = 2MnO42- + SO42- + H2O.
д) составляем молекулярное уравнение реакции (добавляя соответствующие противоионы):
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
2) Вторая реакция осуществляется в кислой среде, следовательно, при составлении уравнений полуреакций можно использовать в левой части как ион Н+, так и молекулы Н2О.
а) Схема процесса окисления такова:
SO32- → SO42-.
Поскольку в левой части не хватает одного моля кислорода, прибавляем к ней 1 моль Н2О, тогда в правой части появятся 2 моля Н+:
SO32- + H2O → SO42- + 2Н+
Заряд правой части равен 0. Для того, чтобы заряд левой части стал также равен 0 (пока он равен -2), необходимо от левой части отнять 2 электрона:
SO32- + H2O – 2е- → SO42- + 2Н+.
б) Схема процесса восстановления такова:
MnO4- → Mn2+
поскольку в левой части в избытке 4 моль кислорода, прибавим к ней 8 моль Н+, которые свяжут кислород в молекулы воды, и тогда в правой части 4 моль H2O:
MnO4- + 8Н+ → Mn2+ + 4H2O
Заряд правой части равен +2, левой +7, поэтому к левой части нужно прибавить 5 электронов, после чего заряд левой части также станет равным +2:
MnO4- + 8Н+ + 5е- → Mn2+ + 4H2O .
в) Подводим баланс числу отданных и принятых электронов и составляем уравнение реакции в ионном виде:
SO32- + H2O – 2е- → SO42- + 2Н+ 5
MnO4- + 8Н+ + 5е- → Mn2+ + 4H2O 2
2MnO4- + 5SO32- + 6Н+ = 2Mn2+ + 5SO42- + 3H2O.
г) Добавляя соответствующие противоионы, составляем молекулярное уравнение реакции:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O.
3) Третья реакция осуществляется в нейтральной среде, следовательно, при составлении уравнений полуреакций к левой части можно добавлять только молекулы воды (а в правой части за счёт этого могут образовываться как Н+, так и OH- — ионы).
а) Схема процесса окисления такова:
SO32- → SO42-
добавляем к левой части 1 моль H2O, тогда в правой части появляются 2 моль Н+:
SO32- + Н2О → SO42- + 2Н+.
Для того, чтобы сделать заряд правой части равным заряду левой, отнимаем от левой части 2 электрона:
SO32- + Н2О – 2е- → SO42- + 2Н+.
б) Схема процесса восстановления такова:
MnO4- → MnO2,
для того, чтобы уравнять кислород, добавляем к левой части 2 моль H2O, тогда в правой части появляются 4 моль OH-:
MnO4- + 2H2O → MnO2 + 4OH-.
Заряд правой части равен -4, а левой -1, поэтому к левой части прибавляем 3 электрона:
MnO4- + 2H2O + 3е- → MnO2 + 4OH-.
в) Составляем уравнение в ионном виде:
SO32- + Н2О – 2е- → SO42- + 2Н+ 3
MnO4- + 2H2O + 3е- → MnO2 + 4OH- 2
2MnO4- + 3SO32- + 7H2O = 2MnO2 + 3SO42- + 6Н+ + 8OH-
2MnO4- + 3SO32- + H2O = 2MnO2 + 3SO42- + 2OH-.
г) Составляем молекулярное уравнение реакции:
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH.
Необходимо отметить, что при составлении окислительно-восстановительных реакций, протекающих в растворах, следует отдавать предпочтение методу полуреакций, который оперирует реально существующими ионами, находящимися в данном растворе, и обязательно учитывает среду реакции. Кроме того, метод полуреакций оказывается совершенно необходимым при нахождении табличных значений стандартных электродных потенциалов φº (см. приложение) для расчёта ЭДС гальванических элементов и определения направления окислительно-восстановительных реакций.
Приборы и реактивы
1. Пробирки.
2. Стеклянная палочка.
3. Тигель.
4. Фарфоровая чашечка.
5. Спиртовка.
6. Цинк (порошок).
7. Сера (порошок).
8. Дихромат аммония.
9. Сульфит натрия.
10. Нитрит калия.
11. Растворы: аммиака (25%-ный), соляной кислоты (2 н.), иодида калия (0,5 н.), дихромата калия (0,5 н.), серной кислоты (2 н.), сульфата меди (0,5 н.), гидроксида калия или натрия (2 н.), перманганата калия (0,5 н.), сульфида натрия (0,5 н.), пероксида водорода (3%-ный).
12. Хлорная и бромная вода.
13. Дистиллированная вода.
Порядок выполнения работы
Дата: 2018-12-21, просмотров: 674.