Неотложная помощь и интенсивная терапия являются неотъемлемой составной частью медицинской помощи инфекционным больным. Необходимость в неотложных мероприятиях может возникнуть уже на догоспитальном этапе. К ним относятся промывание желудка, применение энтеросорбентов при пищевых токсикоинфекциях и ботулизме, регидратационная терапия в случаях обезвоживания при острых диарейных кишечных инфекциях и холере, профилактика вторичного повреждения мозга при нейроинфекциях, ложном крупе (корь), отеке легких или бронхиолите (грипп, респираторно-синцитиальная инфекция). Экстренная медицинская помощь нужна больным с тяжелыми осложнениями инфекционного процесса (инфекционно-токсический шок, острая дыхательная или сердечная недостаточности и др.).
К неотложным терапевтическим мероприятиям следует отнести введение антитоксических противоботулинической, противодифтерийной сывороток или соответствующих иммуноглобулинов, а также антибиотиков и химиопрепаратов при инфекциях с возможностью бурного течения и риском развития критического состояния (менингококковая инфекция, церебральная форма малярии, чума и др.).
С целью проведения интенсивного наблюдения и интенсивной терапии (ИТ), в зависимости от коечной емкости инфекционного стационара, должны быть организованы палаты интенсивной терапии. При необходимости проведения сложных специализированных мероприятий (продленная респираторная поддержка, экстракорпоральный гемодиализ и др.) больные могут быть переведены в ОРИТ лечебных учреждений иного профиля. При необходимости для ее осуществления в полном объеме привлекаются силы и средства других диагностических и лечебных отделений.
Основными организационными принципами ИТ являются ее неотложность, предупредительный (превентивный) характер и нозологический подход к выбору патогенетических средств и методов лечения. Она всегда проводится незамедлительно, до уточнения нозологической формы заболевания.
Нозологический подход к выбору средств и методов ИТ состоит в выделении клинико-патогенетических синдромов критических состояний, которые характеризуются общими патофизиологическими изменениями, общим танатогенезом, предполагающими применение стереотипных (стандартных) средств и методов лечения. К ним относятся: инфекционно-токсический шок, инфекционно-токсическая энцефалопатия, синдром внутричерепной гипертензии, дегидратационный синдром (острое обезвоживание), острые дыхательная, сердечная, печеночная и почечная недостаточности. Применение некоторых лекарственных средств, в частности антибиотиков, гетерогенных сывороток и иммуноглобулинов может осложниться анафилактическим шоком, требующим незамедлительного проведения соответствующих лечебных мероприятий.
Эффективность ИТ зависит от сроков ее применения. Исходя из особенностей патогенеза инфекционного заболевания, в случаях его тяжелого течения или при наличии отягощающих преморбидных факторов (сопутствующие хронические заболевания, снижение резистентности организма, иммунодефицитные состояния и др.) необходимо прогнозировать возможное развитие критического состояния и проводить соответствующее превентивное лечение.
Интенсивная терапия инфекционных больных предполагает воздействие на возбудителей болезни, дезинтоксикацию, восстановление и/или поддержание в оптимальном режиме жизненноважных функций.
Подавление жизнедеятельности возбудителей болезни – этиотропная терапия проводится с учетом нозологической формы заболевания, установленной или предполагаемой чувствительности микробов к антибиотикам и химиотерапевтическим средствам. При вирусных инфекциях решающее значение имеют препараты, обладающие прямым противовирусным действием (напр., осельтамивир при гриппе), интерфероны, специфические иммуноглобулины (противогриппозный, противокоревой, противоклещевой и др.), а в случаях заболеваний с ведущей ролью в патогенезе экзотоксинов – антитоксические сыворотки (противоботулиническая, противодифтерийная). При назначении этиотропных средств необходимо учитывать возможность усиления интоксикации в результате массивного бактериолиза (менингококковая инфекция, пневмонии, тифо-паратифозные заболевания), токсического воздействия самих химиопрепаратов (малярия), анафилактогенного эффекта гетерогенных сывороток, иммуноглобулинов и других лекарственных средств.
Дезинтоксикационные мероприятия включают применение специфических антитоксических сывороток, инфузионно-трансфузионную терапию (ИТТ) с форсированным диурезом, использование методов экстракорпоральной детоксикации (плазмафереза, гемосорбции, лимфосорбции и других методов экстракорпоральной гемокоррекции). Неспецифическая ИТТ должна сочетаться с коррекцией водно-электролитного баланса, кислотно-основного состояния и системы свертывания крови. Она проводится с учетом патогенеза заболевания и его клинических проявлений, результатов постоянного контроля дыхания, кровообращения, функций экскреторных органов, а также показателей состояния внутренней среды организма (КОС и основные электролиты, система свертывания крови и др.).
Восстановление и поддержание оптимального функционирования жизненноважных органов и систем осуществляются дифференцированно, в зависимости от клинико-патогенетических синдромов критических состояний.
Инфекционно-токсический шок (ИТШ) – это острая недостаточность кровообращения, приводящая к тяжелым метаболическим расстройствам и развитию полиорганной патологии. Гемодинамические расстройства возникают в ответ на массивное поступление в кровь микробных токсинов. Под их влиянием высвобождаются вазоактивные и вазопатические вещества (интерлейкины, фактор некроза опухолей - альфа (ФНО-α), катехоламины, гистамин и др.), что приводит к изменению тонуса прекапилляров и венул. Вначале происходит кратковременный их спазм с артерио-венозным шунтированием, а затем продолжительный парез с депонированием крови в микроциркуляторном русле, выходом ее жидкой части в экстравазальное пространство и интерстициальным отеком. Ишемия тканей, гипоксия и ацидоз, способствуют функциональным и морфологическим изменениям с развитием синдрома полиорганной недостаточности. Расстройства микроциркуляции усугубляются нарушением свертывания крови, характеризующимся вначале ДВС, а затем – коагулопатией потребления вследствие мобилизации фибриногена, протромбина с одновременной стимуляцией фибринолиза.
Лечение ИТШ следует осуществлять в палате интенсивной терапии.
Ключевым методом лечения ИТШ является инфузионная терапия. Она должна быть направлена на восполнение ОЦК, оптимизацию ее реологических свойств, неспецифическую дезинтоксикацию, коррекцию синдрома ДВС, коррекцию нарушений КОС и водно-электролитного баланса. При гипотензии необходимо быстрое капельное или струйное внутривенное введение кристаллоидных растворов в течение 20-30 мин., а за тем – коллоидных растворов. Кристаллоидные и коллоидные растворы вводятся в соотношении 2:1 со скоростью введения 0,75-1,5 мл/кг/мин (1,0 мл/кг/мин) с приостановкой введения каждые 10-15 мин и измерением ЦВД. Если после введения 200 мл жидкости ЦВД повышается в пределах 2 см водн. ст., то инфузия продолжается с той же скоростью, но, если при этом ЦВД повышается на 5 см водн. ст., то инфузия резко замедляется или приостанавливается до снижения ЦВД. Для выбора оптимальной скорости инфузии можно использовать динамические показатели давления заклинивания легочных капилляров (ДЗЛК): при ДЗЛК около 3 мм рт. ст. – продолжается струйное введение, при ДЗЛК до 7 мм рт. ст. – капельное введение, при ДЗЛК 12-14 мм рт. ст. – инфузионная терапия достаточна. Если, несмотря на инфузионную терапию, ЦВД остаётся сниженным, то необходима инотропная поддержка. С этой целью применяют внутривенно капельно допамин и добутамин.
Введение допамина в дозе 2-5 мкг/кг/мин улучшает кровоток в почечных, мезентериальных и коронарных сосудах, а в дозе 5-10 мкг/кг/мин усиливает контрактильность миокарда, в дозе 20 мкг/кг/мин – увеличивает общее периферическое сопротивление сосудов (ОПСС), что способствует восполнению гиповолемии.
Введение добутамина в дозе 2,5-20,0 мкг/кг/мин увеличивает число сердечных сокращений, существенно не влияя на ОПСС. Добутамин целесообразно сочетать с допамином или норадреналином. Норадреналин в дозе 0,15 – 0,25 мкг/кг*мин обладает инотропным воздействием на миокард и увеличивает вазоконстрикцию, почечный кровоток после короткого снижения возрастает.
В целях усиления вазопрессивного действия используется также адреналин – 1 мг адреналина разводится в 400 мл физраствора и инфузируется методом «титрования» (10-20 капель в минуту или 1,25-2,5 мкг/мин), достигая требуемого эффекта.
При стойкой артериальной гипотензии целесообразна комбинация нескольких вазоактивных средств в невысоких дозировках. Вазоактивный эффект может быть усилен энергетическим полиионным раствором: глюкоза 20% – 400 мл, хлорид К 7,5% – 20 мл, хлорид Са 10% – 6 мл, сульфат Mg 25% – 3 мл, инсулин 25 ЕД.
Если ЦВД, несмотря на применение катехоламинов, остаётся выше 15 см водн. ст., дополнительно используются кардиотонические средства: строфантин 0,05% раствора 1 мл разводится в 20 мл 5 или 20% глюкозы и вводится медленно внутривенно в течение 5-6 мин или дигоксин 0,05% раствора 1 мл вводится медленно на глюкозе аналогично строфантину.
При адекватной коррекции гемодинамики нарушения КОС компенсируются спонтанно. Интенсивная терапия больных с недыхательным ацидозом должна предусматривать, прежде всего, патогенетическое лечение больного, устранение причины, вызвавшей развитие ацидоза (при успешном лечении органические кислоты постепенно метаболизируются и (или) экскретируются, ацидоз исчезает). Если причину не удается устранить, тяжелый ацидоз нужно корригировать введением оснований: 4,2% или 8,4% раствора натрия гидрокарбоната (в 1 мл раствора соответственно 0,5 или 1 мМ оснований), или лактата натрия (в 1 мл 11% раствора 1 мМ оснований), или 3,6% раствора трисамина, THAM (в 1 мл 3,6% раствора содержится 0,3 мМ оснований). Расчет дозы основания производят по формуле:
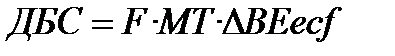 ,
,
где: ДБС – дефицит буферных систем, мМ оснований;
F – объем внеклеточной жидкости, л/кг (равен 0,2);
МТ – масса тела (кг);
∆ВEecf – разница между истинным и нормальным значением ВЕ.
Не следует дефицит оснований корригировать полностью. Если причина ацидоза определена и может быть контролируема, то во введении оснований нередко нет необходимости.
ГКС в начале неотложной терапии (как можно раньше!) следует вводить в дозе, эквивалентной 240 мг преднизолона. Их применение необходимо для нейтрализации патогенного воздействия медиаторов воспаления, стабилизации клеточных мембран. Введение ГКС не является обязательным, так как обладают некоторыми нежелательными эффектами: помимо ингибирования синтеза NO-синтазы, в значительной мере ингибируют синтез антиоксидантных ферментов: каталазы, различных изоформ супероксиддисмутазы, снижают уровень глутатиона в клетках. Все это способствует развитию оксидативного стресса и свободнорадикальному повреждению биомакромолекул. Поэтому назначение высоких доз ГКС должно быть кратковременным и сопровождаться назначением комплекса антиоксидантов: витамин С, витамин Е и унитиола.
Этиотропная терапия должна проводиться непрерывно в виде специально подобранных (клинически или лабораторно) бактерицидных антибиотиков в максимально высоких дозах. При неуточненной нозологической форме тяжело протекающей бактериальной инфекции, подозрении на сепсис после отбора и посева крови, других биологических жидкостей для последующего микробиологического исследования, проводят эмпирическую моно- или комбинированную терапию, применяя такие антибиотики как меронем, имипенем (циластин), цефтриаксон, цефалоспорины IV поколения, фторхинолоны. При подозрении на стафилококковый сепсис эффективно назначение ванкомицина. В качестве комбинированной антибиотикотерапии показаны сочетания цефалоспоринов III поколения (цефтриаксои, цефотаксим, цефтазидим) с аминогликозидами (амикацин, гентамицин). В случаях подозрения на синегнойную инфекцию целесообразно использовать комбинацию тикарциллина (клавуната), азтреонама с аминогликозидами. После выделения возбудителя болезни или уточнения нозологической формы заболевания, назначают соответствующие этиотропные средства, предпочтительнее узкого спектра действия. При отсутствии терапевтического эффекта в течение 48-72 ч целесообразна смена противомикробных препаратов.
Антибактериальные препараты или их комбинации применяют преимущественно внутривенно в максимально допустимых терапевтических дозах. Возможны и другие пути введения антибиотиков, обеспечивающие необходимую концентрацию в очагах инфекции (эндолюбальное или интракаротидное при менингитах, внутриполостное или трансумбиликальное при амебных абсцессах печени, ингаляционное – при легочной патологии). Побочные воздействия различных антибиотиков можно и нужно предупреждать назначением соответствующих патогенетических средств (глюкокортикостероидов, гепатопротекторов, ангиопротекторов, инфузионных растворов). При лечении антибиотиками следует иметь в виду опасность развития дисбактериоза, в частности псевдомембранозного колита.
Из противовирусных химиотерапевтических препаратов в интенсивной терапии вирусных инфекций применяют рекомбинантные альфа-интерфероны (вирусные менингоэнцефалиты, вирусные гепатиты), ацикловир и его аналоги (герпетическая инфекция), ганцикловир (тяжелая цикломегаловирусная инфекция). При лечении тяжелых форм гриппа, кори, клещевых энцефалитов применяют специфические иммуноглобулины. В критическом состоянии их вводят внутривенно одномоментно в максимальных курсовых дозах под прикрытием глюкокортикоидов и антигистаминных средств.
В качестве эффективного метода интенсивной терапии инфекционных больных нашли достаточно широкое применение экстракорпоральная сорбционная детоксикация (плазмо- и лимфосорбция), плазмаферез.
Инфекционно-токсическая энцефалопатия (ИТЭ) – острая церебральная недостаточность в результате прямого или опосредованного воздействия на центральную нервную систему микробов или их токсинов. Она наблюдается при нейроинфекциях (бактериальные, вирусные менингиты и энцефалиты), тяжелых инфекционных интоксикациях (брюшной тиф, чума и др.). ИТЭ может быть следствием нарушений как мозгового (грипп, малярия, риккетсиозы, геморрагические лихорадки), так и системного (гиповолемические состояния при ИТШ, при остром обезвоживании организма) кровообращения. Нарушение функции ЦНС может произойти в результате эндогенной интоксикации у больных с острой недостаточностью печени (вирусные гепатиты, лептоспироз, желтая лихорадка), почек (геморрагические лихорадки, лептоспироз, гемоглобинурийная лихорадка), в случаях острой дыхательной недостаточности (грипп, ботулизм, лихорадка Ку, орнитоз, легионеллез, легочные формы чумы и сибирской язвы), при синдроме полиорганной недостаточности (ИТШ, сепсис).
Основными патогенетическими механизмами ИТЭ являются отек и набухание головного мозга, его гипоксия и ацидоз. Они обычно сочетаются с синдромом внутричерепной гипертензии. Клинические проявления ИТЭ характеризуются нарушениями сознания, протекающими по типу его угнетения (сомноленция, сопор, кома) и/или изменения (затемненность, спутанность, делирий, амнезия, аменция, онейроидный синдром). Возможны судороги и очаговые неврологические симптомы.
Выбор средств и методов лечения определяется нозологической формой заболевания (этиотропная терапия) и патогенезом нарушений функций жизненно важных, прежде всего выделительных, органов и систем (патогенетическая терапия). К последним относятся специфическая и неспецифическая дезинтоксикация, включая экстракорпоральную детоксикацию, антигипоксическая терапия (обеспечение нормальной вентиляции легких, оксигенотерапия, ГБО), улучшение микроциркуляции и питания головного мозга (инфузионные средства, ноотропы и др.). Обязательны и глюкокортикоиды (внутривенно в дозах, эквивалентных 90-240 мг преднизолона в сутки), при психомоторном возбуждении – седативные средства, при гипертермии – антипиретики и (или) искусственное охлаждение. При часто сопутствующей ИТЭ церебральной гипертензии обязательны дегидратационные средства, а в случаях угрожающих жизни нарушений дыхания – ИВЛ.
Синдром внутричерепной гипертензии (СВГ) – повышение внутричерепного давления вследствие гиперпродукции ликвора и отека-набухания головного мозга, развивающийся у больных нейроинфекциями (бактериальные и вирусные менингиты, менингоэнцефалиты). Развитию этого осложнения способствуют выраженная интоксикация (брюшной тиф), расстройства микроциркуляции (грипп, сыпной тиф, малярия), гипоксемия (пневмонии различной этиологии). Типичными признаками СВГ являются менингеальные симптомы. По мере ее усиления, особенно в связи с отеком-набуханием головного мозга, развивается инфекционно-токсическая энцефалопатия, возможна дислокация головного мозга с летальным исходом.
Интенсивная терапия, необходимая для купирования проявлений СВГ, не является специфической в отношении инфекционных больных. Она такая же, как и при других патологических состояниях. В качестве основного метода используется дегидратационная терапия с применением диуретиков: осмотических (для экстренной дегидратации) и салуретиков (для более мягкой, постепенной дегидратации) или их сочетания. Их применение должно обязательно сопровождаться поддержанием водно-электролитного баланса. Дегидратационных средств должны обязательно сочетаться с инфузионно-дезинтоксикационными растворами. Используют салуретики (по 40-80 мг внутривенно, внутримышечно). В случаях тяжелой гипертензии, угрозы вклинения показаны осмодиуретики (со скоростью 120-140 кап/мин в количестве 1,0-1,5 г препарата на кг массы больного). Кратность введения диуретических средств зависит от терапевтического эффекта. Искусственную дегидратацию обязательно сочетают с применением противовоспалительных (глюкокортикостероиды), инфузионно-дезинтоксикационных средств. Используют кристаллоидные изоосмотические растворы, глюкозо-калиевые смеси в количествах, равных выделенной моче. Показаны ингаляция увлажненного кислорода, другие средства и методы, которые применяются при лечении ИТЭ.
Этиотропная терапия проводится в соответствии с нозологической формой заболевания. Учитывают не только этиологический фактор, чувствительность возбудителей к применяемым антибактериальным средствам, но и проницаемость их через гематоэнцефалический барьер, что очень важно. Хорошо проникают через гематоэнцефалический барьер: метронидозол, рифампицин, котримоксазол, флуконазол, хлорамфеникол. Хорошо проникают через гематоэнцефалический барьер только при воспалении: амикацин, канамицин, азитреонам, амоксациллин, ванкомицин, меропенем, пенициллин, пефлоксацин, парентеральные цефалоспарины III поколения, цефуроксим, ципрофлоксацин, офлоксацин, мезлоциллин. Плохо проникают через гематоэнцефалический барьер даже при воспалении: стрептомицин, гентамицин, азлоциллин, макролиды, кетонизолон, ломефлоксацин, норфлоксацин. Не проникают через гематоэнцефалический барьер амфотерацин В, клиндамицин, линкомицин.
Острая дыхательная недостаточность (ОДН) у инфекционных больных может быть следствием нарушений центральной нервной регуляции дыхания (менингоэнцефалиты, коматозные состояния, церебральная гипертензия) и (или) иннервации дыхательных мышц (ботулизм, полиомиелит, восходящий паралич при гриппе и других ОРЗ); ухудшения проходимости дыхательных путей вследствие их воспаления (дифтерия, корь, грипп и ОРЗ) либо аспирации (ИТЭ II-III ст.); ухудшения вентиляции (пневмонии, в том числе специфические); нарушения альвеолярно-капиллярного газообмена (пневмония, отек легких, РДСВ и др.). При ботулизме ОДН является следствием паралича основных дыхательных мышц, обусловленного нарушением передачи возбуждения в холинергических синапсах, мотонейронах шейного и верхнего грудного отделов спинного мозга. Она может усиливаться в связи со скоплением густой слизи в над- или подсвязочном пространстве гортани, вследствие аспирации жидкости и пищи, аспирационной пневмонии на фоне нарушенного механизма кашлевого рефлекса. У больных гриппом и другими ОРЗ в остром периоде болезни ОДН может возникать в связи с обтурационным трахеобронхитом, бронхиолитом, инфекционно-токсическим отеком легких, первичным геморрагическим пневмонитом. Она развивается чаще у людей с хронической патологией органов дыхания. В более поздний период заболевания причиной ОДН могут быть вторичные бактериальные (вирусно-бактериальные) пневмонии, восходящий паралич.В случаях дифтерии причиной ОДН чаще является так называемый истинный круп – обтурация гортани фибринными пленками, не поддающимися механическому удалению. Очень опасен нисходящий круп, когда фибринные пленки вызывают обтурационный трахеобронхит. У больных корью может внезапно развиться ложный круп в результате отека слизистой трахеи, подсвязочного пространства гортани. ОДН у больных полиомиелитом при бульварной форме заболевания обусловлена в основном нарушениями ритма дыхания и проходимости верхних дыхательных путей. При спинальной форме заболевания гиповентиляция легких развивается вследствие пареза дыхательных мышц. Довольно характерно парадоксальное дыхание – увеличение объема грудной клетки в фазу выдоха. Ухудшению вентиляции легких способствует аспирация слюны и мокроты, воды, пищи. При столбняке в механизме ОДН важная роль принадлежит нарушению дыхания, возникающему на фоне судорожного синдрома, аспирационной бронхопневмонии.
Интенсивная терапия ОДН зависит от патогенеза и степени дыхательных расстройств. Этиотропная терапия при этом дифференцирована в зависимости от нозологической формы эаболевания, чувствительности возбудителей к противомикробным средствам. Ключевую роль играет своевременное применение специфических антитоксических сывороток при ботулизме и дифтерии, интерферона и специфических иммуноглобулинов при гриппе и вирусных менингоэнцефалитах, своевременное в оптимальных дозах применение антибиотиков и химиопрепаратов. Этиотропные средства не ведут к непосредственному устранению причины ОДН. Поэтому существенная роль принадлежит лечебной ларинготрахеобронхоскопии, интубации трахеи и трахеостомии, ГБО, интенсивной терапии критических состояний, способствующих развитию ОДН.
При нарушении проходимости дыхательных путей необходимы туалет ротоглотки, вибромассаж грудной клетки со стимуляцией кашля, введение S-образных воздуховодов, при необходимости – интубация трахеи или трахеостомия. Кроме того, при крупе назначают горячие горчичные ванны, внутривенно вводят 90 мг преднизолона. Больным с отеком легких необходимо обеспечить полусидячее или сидячее (с опущенными ногами) положение, ингаляцию увлажненного кислорода, грелку к ногам, наложение жгутов на нижние конечности на 30–40 мин (пережимать только вены). Применяют ингаляции пеногасителей (10% спиртовой р-р антифомсилана или кислород, пропущенный через 70% спирт). Внутривенно – 1 мл 1% раствора морфина (или другого наркотического анальгетика) в 20 мл 0,9% раствора натрия хлорида дробно по 5–10 мл смеси. При нормальном или повышенном АД – 20–40 мг салуретиков внутримышечно или внутривенно. При тенденции к гипотонии и тахикардии – внутривенно струйно медленно 1 мл 0,025% дигоксина в 20 мл 5% раствора глюкозы или 0,9% хлорида натрия.
При кардиогенном отёке легких на фоне артериальной гипотензии вводить нитроглицерин внутривенно только после повышения систолического АД выше 90–100 мм рт.ст. с помощью внутривенного капельного введения 5 мл 4% раствора допамин (со скоростью 2,5–10 мкг/кг/мин) или вводить одновременно оба препарата через разные капельные системы под контролем АД и ЦВД. В этом случае добавляется внутривенное струйное введение 60–120 мг преднизолона. При ацидозе – внутривенно струйно, при необходимости повторно, по 20–40 мл 4% раствора гидрокарбоната натрия под контролем КОС. При появлении и прогрессировании острой дыхательной недостаточности – респираторная поддержка. Интенсивная терапия предусматривает, кроме мероприятий неотложной помощи, применение средств, разжижжающих патологическое содержимое дыхательных путей, экспирацию патологического содержимого. Используются бронхорасширяющие средства. При отсутствии эффекта от проводимых терапевтических мероприятий решается вопрос об ИВЛ.
Дегидратационный синдром (ДС) – острый дефицит воды в организме в результате преобладания потерь жидкости над ее поступлением. Он, как правило, сочетается с нарушениями электролитного баланса и КОС. Характер и степень обезвоживания определяется с учетом количества поступившей (питье, пища, инфузионные растворы) и выделенной (диурез, перспирация, рвота, испражнения) воды, содержания натрия в крови и ее коллоидно-осмотического давления (КОД). В зависимости от этого выделяют изотонический, гипертонический и гипотонический типы дегидратации. Первые два типа обезвоживания являются наиболее частыми в инфекционной патологии вследствие потерь изотонической жидко-сти, бедной белком, при профузной диаррее, часто в сочетании с неукротимой рвотой (холера, пищевые токсикоинфекции, гастроинтестинальные формы сальмонеллеза и другие диарейные инфекции), при неконтролируемом применении салуретиков, а также ги-пертонической дегидратации при повышенных потерях жидкости через кожу и дыхательные пути (высоколихорадящие больные, ИВЛ) и недостаточного поступления воды вследствие нарушения глотания (ботулизм, коматозные состояния). Если потеря жидкости возмещается водой с избытком без электролитов, то гипертоническая дегидратация может перейти в гипотоническую.
Следует отметить, что тип дегидратации (изотоническая, гипертоническая, гипотоническая, внутри- или внеклеточная) и степень ее тяжести не всегда дифференцируется. Выяснение формы дегидратации является ключевым в определении количества и качества инфузнонных средств, а также методики регидратации.
Изотоническая (внеклеточная) дегидратация возникает вследствие невосполняемых потерь изотонической жидкости у больных с профузной диареей (холера, сальмонеллез, пищевые токсикоинфеции и другие заболевания с синдромом энтерита). При этом происходит преимущественное уменьшение жидкости внеклеточного пространства (плазма, интерстиций). Развиваются гиповолемия, метоболический ацидоз, дегидратационный шок. Критериями ее диагностики являются профузная диарея, клинические признаки дегидратации (жажда, нарушения тургора кожи, судороги и т.д.), тахикардия на фоне падения артериального давления (шоковый индекс больше 1,0), уменьшение ЦВД.
Потребность в интенсивной патогенетической терапии чаще возникает в случаях изотонической дегидратации при острых кишечных диарейных инфекциях. Показанием к интенсивной регидратационной терапии является гиповолемический (дегидратационный) шок. В качестве неотложных мероприятий проводится первичная регидратация – быстрое струйное введение полиионного инфузионного раствора для замещения потерянной жидкости. Критерий эффективности – улучшение состояния больного, появление диуреза. Ориентировочные потери изотонической жидкости определяются по дефициту массы тела, степени клинических проявлений обезвоживания. Они могут быть установлены по формуле:
V=4×103(Д-1025)×Р,
где V – определяемый дефицит жидкости в мл, Д – относительная плотность плазмы больного, 1025 – усредненная нормальная плотность плазмы, Р – масса больного в кг.
Вторым этапом является компенсаторная регидратация. Она проводится теми же лечебными растворами капельно в темпе и в объемах, равных продолжающимся потерям жидкости. Преждевременное прекращение корригирующей регидратационной терапии способствует повторному дегидратационному шоку, который протекает более тяжело и труднее поддается интенсивной терапии.
Гипертоническая дегидратация является следствием потерь гипотонической жидкости у высоколихорадящих больных (тифо-паратифозные заболевания, и др.), при нарушениях глотания (ботулизм, дифтерия, стволовые энцефалиты и др.), при сопорозных или коматозных состояниях. Происходит повышение КОД крови с перемещением жидкости из интерстиция, а затем и клеток во внутрисосудистое пространство. Возникает клеточная дегидратация, для которой характерны жажда, сухость кожи и слизистых, угнетение сознания, олигурия. Гемодинамические расстройства появляются в случаях невосполненных потерь 6–8 л воды.
Неотложная помощь заключается в обильном питье. При гипертонической дегидратации для этих целей используют чай, компоты, разбавленные фруктовые соки, воду. В случаях изотонического обезвоживания при отсутствии рвоты и гемодинамических расстройств (дегидратационного шока) неотложная регидратационная терапия может проводиться приемом внутрь глюкозо-электрлитных растворов. В случаях неукротимой рвоты, дегидратационного шока показано внутривенное введение полиионных растров до 2 л внутривенно со скоростью 120 кап/мин.
Интенсивная терапия в случаях гипертонической дегидратации состоит во внутривенном введении 5% р-ра глюкозы и в обильном питье. Ориентировочные потребности в воде определяются по формуле:
количество 5% р-ра глюкозы (л) = [(Nа ист – 142):142] × (Р × 0,2),
где Nа ист. – концентрация натрия в плазме больного (ммоль/л), 142 – усредненное нормальное содержание натрия в плазме человека (ммоль/л), Р – масса тела больного в кг, 0,2 – коэффициент перерасчета на количество внеклеточной жидкости.
Больным с дегидратационным синдромом противопоказаны коллоидные инфузионные растворы, прессорные амины с целью повышения артериального давления. Нужна осторожность при проведении внутривенной регидратации лицам пожилого возраста, с сопутствующими гипертонической болезнью, ИБС, пороками сердца. Необходимы контроль ЦВД, ЭКГ, содержания К и Nа в крови и ее кислотно-основного состояния.
Острая печеночная недостаточность (ОПечН) представляет собой острое нарушение функции печени, характеризующееся энцефалопатией и геморрагическим синдромом. Она является осложнением крайне тяжелого течения вирусных гепатитов, желтушных форм лептоспироза, желтой лихорадки и других инфекций с поражением печени.
Основные патогенетические механизмы ОПечН обусловлены нарушениями дезинтоксикационной и синтетической функций печени. При этом происходит накопление в крови церебротоксических веществ – ароматических (триптофан, тирозин) и серосодержащих (метион, цистеин) аминокислот, низкомолекулярных жирных кислот (масляной, валериановой, капроновой), производных пировиноградной кислоты (ацетон и 2,3-бутиленгликоль). Их совместное действие даже в небольших количествах оказывает выраженный церебротоксический эффект. Повышение проницаемости мембран гепатоцитов ведет к потере калия, метаболическому алкалозу. Вследствие нарушений синтетической функции печени возникает диспротеинемия (гипоальбуминемия), снижается содержание в крови факторов свертывания крови, в частности II, V, VII и IX. Возникает коагулопатия дефицита.
Основным клиническим признаком ОПечН является печеночная энцефалопатия. Для нее характерны инверсия сна, поведенческие аномалии, тремор, сомноленция – сопор – кома с приступами психомоторного возбуждения или судорог. Типичен геморрагический синдром, который завершается массивными желудочно-кишечными кровотечениями. Летальные исходы наступают на фоне тотального некроза печени, отека-набухания головного мозга или геморрагического шока. Одним из наиболее объективных критериев развития ОПечН является протромбиновый индекс, уменьшение которого до 50% и ниже свидетельствует о возможности неблагоприятного исхода болезни.
Интенсивная терапия больных с ОПечН должна быть направлена на стабилизацию мембран (глюкокортикоиды в дозах, эквивалентных 180-240 мг преднизолона в сутки) и блокаду лизосомальных протеаз (гордокс, контрикал и др.). Одновременно осуществляется неспецифическая инфузионно-дезинтоксикационная терапия с коррекцией белкового, электролитного балансов, КОС и гемостаза. Преимущество должно отдаваться свежезамороженной плазме, глюкозо-калиевым растворам, альбумину. Очень важно предупреждение эндогенной интоксикации из ЖКТ, особенно при кровотечениях, ежедневные промывания желудка, высокие очистительные клизмы, назначение антибиотиков (канамицина или ампициллина внутрь) и энтеросорбентов. Необходимы постоянная ингаляция кислорода, достаточное энергообеспечение, предупреждение и лечение острой дыхательной, сердечно-сосудистой недостаточности. Высокоэффективны ГБО, особенно в сочетании с экстракорпоральной детоксикацией, при резком дефиците факторов свертывания – свежезамороженная плазма, обменные переливания крови. ГБО должна применяться не только в случаях развития ОПечН, но также при ее предвестниках и даже больным с факторами угрозы неблагоприятного течения гепатита.
Острое почечное повреждение (ОПП) – синдром стадийного нарастающего острого поражения почек от минимальных изменений почечной функции до ее полной потери. Критериями наличия ОПП считают:
- увеличение креатинина сыворотки крови ³ 0.3 мг/дл (³ 26.5 мкмоль/л) в течение 48 ч или
- увеличение креатинина сыворотки крови более, чем в 1,5 раза от известного или предполагаемого в течение последних 7 дней исходного значения или
- диурез менее 0.5 мл/кг/час в течение 6 час.
Тяжесть ОПП оценивается по трем степеням, каждая из которых последовательно сменяет предыдущую (табл. 1).
Таблица 1
Степень тяжести ОПП
| Тяжесть | Креатинин сыворотки крови | Диурез |
| 1 | Повышение в 1,5-1,9 раз от исходного или Увеличение на ³ 0.3 мг/дл (³ 26.5 мкмоль/л) | < 0.5 мл/кг/час в течение 6-12 час |
| 2 | Повышение в 2,0-2,9 раз от исходного | < 0.5 мл/кг/час в течение ³ 12 час |
| 3 | Повышение в 3,0 раза от исходного или Увеличение до ³ 4.0 мг/дл (³ 353.6 мкмоль/л) или Начало почечной заместительной терапии или У больных моложе 18 лет снижение сбалансированной скорости клубочковой фильтрации менее 35 мл/мин на 1,73 м2 | < 0.3 мл/кг/час в течение ³ 24 час или Анурия в течение ³ 12 час |
Ранее существовало понятие острой почечной недостаточности (ОПН) как синдрома критического снижения основной – выделительной функции почек с формированием угрожающих жизни азотемии, нарушений водно-электролитного баланса и кислотно-основного состояния, что в целом соответствует III степени тяжести ОПП. При инфекционных заболеваниях ОПП развивается в целом относительно редко и только при тяжелом и осложненном течении инфекционного заболевания, однако, при некоторых нозологических формах почки являются одной из основных мишеней (лептоспироз, геморрагическая лихорадка с почечным синдромом), в связи с чем вероятность развития ОПП повышается до 30 - 50%. ОПП является также одним из основных компонентов и пусковых механизмов полиорганной недостаточности. Летальность при изолированной тяжелой ОПП достигает 20% и существенно зависит сроков начала и объема интенсивной терапии. В отличие от хронической почечной недостаточности, ОПП является потенциально обратимым состоянием и при адекватной терапии функция почек восстанавливается практически полностью.
Патогенез ОПП у инфекционных больных. ОПП может быть обусловлена воздействием первичных почечных и внепочечных факторов, приводящих к функциональным нарушениям и морфологическим повреждениям почек. По возрастанию значимости первичных инициирующих факторов при инфекционных заболеваниях, выделяют постренальное, ренальное и преренальное ОПП.
Постренальное ОПП возникает в результате нарушения проходимости мочевыводящих путей и оттока мочи. При инфекционных заболеваниях постренальное ОПП не формируется, однако может быть фоном при других формах ОПП.
Ренальное ОПП обусловлена прямым или опосредованным поражением нефронов. Основными ее причинами считаются:
- массивный внутрисосудистый гемолиз с блокадой перфузии почечных клубочков и блокадой почечных канальцев при тропической малярии и лихорадке денге;
- прямое поражение эндотелия сосудов почечных клубочков (ГЛПС, желтая лихорадка);
- прямое поражение канальцевого и клубочкового аппарата почек в сочетании с гемолизом (лептоспироз);
- рабдомиолиз с массивной миоглобинурией (столбняк, легионеллез, тяжелые вирусные инфекции);
- нефротоксическое действие лекарственных средств применяемых при инфекционных заболеваниях (аминогликозиды, гликопептиды, полимиксин, сульфаниламиды, противоцитомегаловирусные препараты, некоторые антипаразитарные препараты, декстраны, рентгеноконтрастные препараты).
Нужно подчеркнуть, что ренальное ОПП может развиваться на фоне хронической почечной недостаточности с синдромом взаимного отягощения.
Преренальное ОПП возникает при резком снижении почечного кровотока и падении артериального давления ниже порога фильтрации мочи (60 мм рт. ст). Причинами преренальной ОПН являются:
- системные нарушения микроциркуляции в сочетании со снижением среднего артериального давления при ИТШ любого генеза (сепсис, ГФМИ, тифо-паратифозные заболевания, лептоспироз, шигеллез, ГЛПС, чума, туляремия, сибирская язва, пневмонии и др.);
- критическое уменьшение ОЦК (дегидратационный шок) с гипервязкостью крови при изотонической дегидратации или гипертонической дегидратации (холера, пищевые токсикоинфекции, салмонеллезы и т.д.);
- развитие инфекционного миокардита с резким нарушением сократительной способности миокарда и острой сердечной недостаточностью (дифтерия, тифо- паратифозные заболевания, и др.).
- критическое снижение ОЦК без гипервязкости крови (кишечные кровотечения из брюшнотифозных язв, кровотечения при вирусных гепатитах и др., вторичные кровотечения).
При несвоевременном купировании причинных факторов и неадекватной терапии преренальное ОПП переходит в ренальное ОПП с повреждением клубочково- канальцевого аппарата почек, а при некоторый инфекциях преренальные и ренальные механихмы почечного повреждения реализуются в рамках единого патологического процесса (лептоспирозы, некоторые геморрагические лихорадки).
Следует подчеркнуть, что в первые 6-8 ч после формирования ОПП функциональные изменения в почках относительно быстро устраняются после прекращения воздействия причинного фактора, в более поздние сроки ОПП сохраняется и после устранения причинных факторов и восстановления перфузии почек. Длительность ОПП при инфекционных заболеваниях составляет от нескольких часов до 2-3 недель, но при адекватной лечебной тактике и, при необходимости, заместительной почечной терапии, почечная функция неизбежно восстанавливается, причем сначала восстанавливается фильтрационная функция почек и возникает полиурия и только спустя несколько суток начинается функционирование эпителия почечных канальцев и канальцевая реабсорбция.
Таким образом, в начале ОПП происходит изолированное или комбинированное воздействие сосудистых, канальцевых и клубочковых факторов, которое в последующем усугубляется синергидным их повреждающим действием, в результате чего ухудшается клубочковая фильтрация, а затем и реабсорбция мочи с формированием олигоанурии и следующих угрожающих жизни нарушений гомеостаза:
- гиперкалиемия;
- гипергидратация;
- азотемия и уремия;
- метаболический ацидоз;
- накопление экзогенных и эндогенных токсических веществ.
Клиника и диагностика ОПП. В соответствии с последовательностью нарушения и восстановления почечной функции можно условно выделить следующие 4 стадии ОПП:
1. Начальную (соответствует тяжести 0 – 1).
2. Олигоанурическую (соответствует по тяжести 2 – 3).
3. Полиурическую.
4. Стадию реконвалесценции.
Клинические проявления начальной стадии ОПП скудны и заключаются в снижении суточного объема мочи до 500 мл и снижении почасового диуреза до 20 мл/час. При стабильной гемодинамике и восстановлении систолического АД выше 80 мм рт. ст. целесообразна проба с водной нагрузкой: внутривенная инфузия 400- 500 мл полиионного кристаллоидного раствора в течение 40-60 минут. Отсутствие изменения темпа мочеотделения (минутный диурез) показывает нарушение функции клубочкового аппарата почек.
Лабораторные признаки начального периода ОПП заключаются в выявлении т. н. «мочевого синдрома» по следующим изменениям общего анализа мочи:
- снижение относительной плотности мочи (изо- гипостенурия);
- резкий сдвиг рН мочи в кислую сторону;
- протеинурия;
- цилиндроурия (гиалиновые и зернистые цилиндры);
- появление в моче клеток эпителия почечных канальцев.
Обнаружение подобного комплекса свидетельствует о значительном повреждении нефронов и значимых, но обратимых функциональных нарушениях, хотя отдельные показатели мочевого осадка и состава мочи могут изменяться изолированно при многих инфекционных заболеваниях с высокой лихорадкой и без существенного поражения почек.
Для диагностики начальной стадии ОПП имеют значение следующие биохимические показатели крови: повышение уровня креатинина и мочевины, «средних молекул», концентрации ионов калия и натрия, гиперосмолярность крови.
Развернутая (олигоанурическая) стадия ОПП характеризуется снижением суточного диуреза до 50-500 мл (олигурия) и ниже 50 мл (анурия).
Клинические проявления ОПП зависят от степени гипергидратации и уремии:
- проявления общей интоксикации и поражения ЦНС (слабость, недомогание, тремор конечностей, головные боли без определенной локализации, энцефалопатия вплоть до комы);
- бледность кожных покровов, повышенная кровоточивость и высокая вероятность желудочных, носовых, маточных кровотечений в результате постепенного развития анемии в сочетании с токсическим поражением сосудистой стенки;
- анорексия, тошнота и рвота, умеренная диарея, признаки формирования острых язв желудочно- кишечного тракта как проявления уремической интоксикации;
- брадикардия и брадиаритмия, глухость сердечных тонов как проявление гиперкалиемии;
- увеличение массы тела, появление периферических отеков, влажных хрипов в легких, кашля с пенистой мокротой, полисерозитов, одышки и признаков отека легких как следствия гипергидратации. В последующем возможно развитие отека мозга с соответствующими клиническими проявлениями.
Клиника ОПП быстро прогрессирует и без адекватного лечения неизбежно приводит к терминальному состоянию.
Лабораторные данные характеризуются резким и значительным повышением концентрации в крови креатинина (до 1000 и более мкмоль/л), мочевины (до 50 ммоль/л), калия (до 10-12 ммоль/л). Выявляется нарастающий декомпенсированный метаболический ацидоз.
Развернутая (олигоанурическая) стадия ОПП продолжается от нескольких дней до нескольких недель и при благоприятном исходе на фоне восстановления клубочковой фильтрации и нарушенной канальцевой реабсорбции наступает полиурия.
Полиурическая стадия ОПП начинается обычно с кратковременного (до 3 суток) периода восстановления объема диуреза. Количество мочи постепенно возрастает на 100-300 мл в сутки, но уремическая интоксикация может нарастать с соответствующей клинической симптоматикой. В последующем происходит быстрое (до 1 л/сут.) нарастание диуреза до уровня 4-5 и более л/сут.
Рековалесценция – продолжительное (до 3 месяцев) восстановление почечных функций с постепенной нормализацией почечных проб.
Интенсивная терапия ОПП. Интенсивная терапия ОПП базируется на результатах интенсивного наблюдения и принципиально различается по целям, задачам и лечебной тактике в при разных стадиях ОПП. Необходимо также учитывать первичный (преренальный, ренальный или постренальный) генез ОПН.
Интенсивная терапия базируется на результатах лабораторных тестов и на интенсивном наблюдении, которое при ОПН должно включать в себя:
1. Мониторирование гемодинамики и ЭКГ. При невозможности мониторирования в олигоанурической стадии ОПН необходимо оценивать ЭКГ минимум 2 раза в сутки.
2. Каждые 12 ч наблюдения необходимо оценивать баланс жидкости в организме больного с учетом перорального и парентерального поступления воды и выведением ее с остаточным диурезом, с перспирацией с учетом лихорадки, с рвотой, потом, со стулом.
3. Контроль диуреза с измерением почасового диуреза после катетеризации мочевого пузыря. Оценивается темп мочеотделения, реакция на инфузии, суточный объем мочи. У больных, самостоятельно контролирующих мочеиспускание, при стабилизации состояния и положительной динамике ОПП возможно оценивать суточный диурез без катетеризации мочевого пузыря.
4. Измерение ЦВД для оценки ОЦК, центральной и периферической гемодинамики и адекватности инфузионной терапии.
5. Взвешивание пациента не реже одного раза в сутки для объективного контроля степени дегидратации/гипергидратации.
6. Исследование не реже двух раз в сутки крови и мочи с определением концентраций мочевины, креатинина, ионов калия и натрия, а также вычислением концентрационных индексов.
7. Ежедневное определение осмоляльности крови и мочи.
8. Ежедневные общие анализы мочи.
В процессе интенсивной терапии любой стадии ОПП необходимо придерживаться следующих общих правил:
1. Немедленно отменить нефротоксичные препараты (антибиотики, химиотерапевтические средства, рентгеноконтрастные вещества и т.д.).
2. Необходимо ограничивать поступление белков с пищей до этапа применения заместительной почечной терапии.
3. Не следует назначать без особых показаний высокомолекулярные коллоидные растворы.
4. Необходимо учитывать возможное негативное влияние на почечный кровоток нередко применяемых в практике общей интенсивной терапии и реанимации симпатомиметиков (норадреналин, мезатон).
Особенности интенсивной терапии начальной стадии ОПП. Интенсивная терапия начальной стадии ОПП нацелена на стимуляцию диуреза при контролируемом усилении водной нагрузки на организм. При этом первичны мероприятия, направленные на устранение преренальных механизмов, ведущих к нарушению почечного кровотока и повреждению клубочкового и канальцевого аппарата почек.
При дегидратационном шоке (холере и других диарейных инфекциях) основное значение имеет незамедлительное восстановление ОЦК путем массивной инфузии полиионных кристаллоидных растворов через центральные вены или одновременно две периферические вены. При ОПП на фоне дегидратационного шока противопоказана стимуляция диуреза осмодиуретиками и петлевыми диуретиками, введение любых (в т.ч. и низкомолекулярных) коллоидных растворов. Не следует применять вазопрессоры и ГКС.
При ИТШ алгоритм интенсивной терапии для предупреждения развития и купирования начальной стадии ОПП совершенно иной. В основе лежит детоксикация, устранение нарушений микроциркуляции, стабилизация мембран и параметров гемодинамики, антигипоксическая терапия, медикаментозная стимуляция диуреза.
Детоксикация достигается инфузионной терапией, рациональной этиотропной терапией с учетом степени нарушения почечной функции, блокадой медиаторов воспаления (ГКС в высоких дозировках коротким курсом), по показаниям – энтеросорбцией и экстракорпоральной гемокоррекцией.
При восстановлении ОЦК следует назначать препараты, улучшающие почечный кровоток (эуфиллин, папаверин, платифиллин, дофамин). Препаратом выбора является дофамин. Важным направлением терапии начального периода ОПП является стимуляция диуреза. Ведущим является внутривенное введение высоких доз салуретиков – 180-240 мг фуросемида в течение 1-3 ч, при отсутствии эффекта дозы фуросемида повышают до 800-1200 мг в сутки. Эффект салуретиков повышается при предварительной инфузии 200-300 мл 4% раствора гидрокарбоната натрия и 10 мл 2,4% раствора эуфиллина. В тех случаях, когда интенсивная терапия начального периода ОПП оказывается безуспешной или выделительная функция почек уже не может быть восстановлена при поздней госпитализации, развивается стадия олигоанурии.
Интенсивная терапия олигоанурической стадии ОПП. Задачи интенсивной терапии ОПН в данной стадии принципиально отличаются от начальной стадии ОПН. Основными целями является борьба с гипергидратацией, гиперкалиемией и гипермагниемией, метаболическим ацидозом, уменьшение уремической интоксикации, воздействие на первичные факторы, обусловившие развитие ОПН.
Контроль водного баланса при олигоанурии. При критическом снижении объема выделяемой мочи развивается задержка жидкости в организме, формируется гипергидратация с периферическими отеками, отеком легких и головного мозга. В этот период необходим строгий контроль вводимой жидкости как перорально с пищей и питьем, так и с внутривенными инфузиями. Следует также учитывать, что в организме ежедневно образуется 300-500 мл так называемой «эндогенной воды» – одного из конечных продуктов окисления углеводов и белков. Общее количество вводимой жидкости должно составлять 800-1000 мл в сутки, что ограничивает возможности инфузионной терапии. Объем жидкости должен быть увеличен, если у больного рвота, диарея, повышенное потоотделение. Показана стимуляция внепочечного выведения жидкости путем усиления потоотделения (настой малины) или назначения слабительных (сорбитол). В олигоурической стадии ОПП следует руководствоваться следующим правилом: незначительное недовосполнение жидкости менее опасно, чем любой положительный баланс воды. Гипергидратация с отеком легких является одним из экстренных показаний для начала заместительной почечной терапии.
Коррекция электролитных нарушений и ацидоза. Консервативная терапия направлена на снижение концентрации в крови иона калия путем перемещения его в клетки. Для этого используют ежедневные инфузии 500 мл 10% глюкозы с 24 Ед инсулина и 40 мл 10% раствора глюконата кальция. Для коррекции ацидоза применяют 4% раствор гидрокарбоната натрия (200-400 мл в сутки), что достоверно повышает выживаемость больных. При гиперкалиемии необходим гемодиализ.
Уменьшение уремических проявлений. Основной задачей является уменьшение катаболизма белков путем снижения лихорадки у инфекционных больных, назначения анаболических стероидов, компенсации энерготрат концентрированными (25-40%) растворами глюкозы с инсулином. Параллельно, но только на додиализном этапе развития ОПП, следует ограничивать поступление белков до 0,4 г/кг в сутки. При критической азотемии проводят диализную терапию.
Для снижения уремической интоксикации возможно применение более простых методов: очистка кишечника с помощью сифонных клизм (1-2% раствор гидрокарбоната натрия) с четким контролем выводимой из кишечника воды во избежание дополнительного всасывания в толстой кишке и усиления гипергидратации. При отсутствии уремических поражений ЖКТ применяют также промывание желудка.
Обосновано применение энтеросорбции в период уремии. Действие энтеросорбентов при ОПП заключается в очищении пищеварительных соков (в сутки выделяется не менее 8 л), которые содержат уремические токсины в той же концентрации, что и плазма крови. Имеет значение обратный переход токсинов через кишечную стенку в просвет кишки по градиенту концентрации с последующим их поглощением сорбентами – т.н. «кишечный диализ».
Рекомендуются следующие энтеросорбенты: угольные – карбактин 1,0 г/кг/сут. или производные лигнина – полифепан 1,0 г/кг/сут., или дисперсная окись алюминия – полисорб МП 0,3 г/кг/сут., или алюмосиликат – энтеросгель 1,0 г/кг/сут. Курс энтеросорбции при ОПН составляет от 3 до 10 суток. Противопоказанием для энтеросорбции является кишечная непроходимость или перфорация кишечника. В процессе энтеросорбции необходимо контролировать стул больного, при запорах обязательно назначать слабительные (сорбитол).
Энергетические потребности восполняются внутривенным введением концентрированных растворов глюкозы/декстрозы с инсулином. При невозможности самостоятельного приема пищи следует переходить на зондовое питание энпитами.
При церебральной недостаточности и судорожном синдроме следует использовать оксибутират натрия и/или нейролептики; барбитураты противопоказаны.
При сердечной недостаточности следует использовать дигоксин как препарат, метаболизирующийся в печени и с наименьшим кумулятивным эффектом при ОПП.
Этиотропная терапия основного инфекционного заболевания должна быть продолжена в олигоурической стадии ОПП. Следует учитывать необходимость уменьшения дозы антибиотиков и химиопрепаратов соответственно почечным клиренсам и возможное их нефротоксическое действие.
Дозы любых лекарственных средств, вводимых больным с ОПП, должны корректироваться с учетом замедленного их выведения почками и проницаемости мембран при диализе.
Особенности интенсивной терапии полиурической стадии ОПП. В начале полиурической стадии ОПП может быть продолжена на непродолжительный период заместительная почечная терапия при критически высоком уровне мочевины. Важнейшее значение имеет восполнение потерь электролитов и объема выводимой с мочой жидкости. Инфузионная терапия проводится полиионными кристаллоидными растворами в объеме 75-80% от объема выделяемой мочи, остальная жидкость должна поступать перорально.
Акценты в коррекции электролитного состава крови существенно изменяются по сравнению с олигоанурической сталией ОПП: гиперкалиемия сменяется гипокалиемией, что требует введения полиионных растворов, содержащих калий или добавления в инфузии раствора хлорида калия. Может потребоваться коррекция гипонатриемии инфузиями концентрированных растворов хлорида натрия.
Тактика ведения больных в полиурической стадии ОПП заключается в постепенном переходе на пероральный прием жидкости под постоянным мониторингом водно-электролитного баланса и с быстрой коррекцией электролитных нарушений.
Методы экстракорпоральной гемокоррекции и заместительной почечной терапии. Методы экстракорпоральной гемокоррекции реализуются детоксикационными операциями экстракорпоральной гемокоррекции (плазмообмен, плазмаферез и плазмосорбция), имеющих опережающую направленность в отношении патологических процессов, быстрое прогрессирование которых может привести к развитию тяжелого ОПП. У инфекционных больных это главным образом состояние ИТШ или патогенетически обусловленное поражение почек при некоторых инфекциях. Указанные методы направлены в основном на выведение высоко- и среднемолекулярных токсических субстанций, микробных эндо- и экзотоксинов, непосредственно бактерий и вирусов из кровотока, что снижает риск ОПП. Однако, данные методы в принципе не оказывают существенного влияния на концентрацию электролитов и низкомолекулярных в т.ч. уремических токсинов, которые распределены равномерно не только в крови, но и во внутриклеточной и внеклеточной жидкости. Поэтому удаление даже больших объемов плазмы не сказывается на их уровне в организме, а гемосорбенты почти не поглощают их.
Эфферентные методы терапии показаны в терапии тяжелого лептоспироза и ГЛПС.
При лептоспирозе плазмообмен вошел в стандарты интенсивной терапии. Кратность – 2-3 операции плазмообмена с интервалом 24 ч при тяжелом лептоспирозе в начальной стадии ОПП. Данный метод позволяет предупредить прогрессирование ОПП и развитие полиорганной недостаточности и существенно уменьшает потребность в заместительной почечной терапии. Основными точками приложения плазмообмена при лептоспирозе считают не только прямую детоксикацию, но и удаление из кровотока свободного гемоглобина, образующегося в результате гемолиза эритроцитов под влиянием гемолизина лептоспир. При невозможности проведения плазмообмена его можно заменить плазмосорбцией или комбинацией плазмафереза и плазмосорбции.
При ГЛПС применяется модифицированный плазмаферез с полным замещением удаляемой плазмы донорской. Основной целью, помимо детоксикации, является купирование ДВС-синдрома и восстановление микроциркуляции в почках еще до развития значимых нарушений почечной функции. Таким образом удается стабилизировать состояние больных и предупредить прогрессирование ОПП.
Заместительная почечная терапия (ЗПТ). ЗПТ абсолютно необходима при инфекционных заболеваниях со II и III стадией ОПП при следующих общих показаниях:
- гиперкалиемия выше 6,4 ммоль/л и ЭКГ-признаками гиперкалиемии;
- гипергидратация с начинающимся отеком легких или головного мозга;
- уровень мочевины крови выше 36 ммоль/л при быстром нарастании азотемии (повышение уровня мочевины более, чем на 10 ммоль/л в сутки) или выше 50 ммоль/л при нарастании на 5 ммоль/л в сутки.
Методы заместительной терапии при ОПП делятся на прерывистые (гемодиализ, гемодиафильтрация, перитонеальный диализ и др.) и непрерывные продолжительные (гемофильтрация, продленная гемодиафильтрация и др.). Результат ЗПТ во многом определяется своевременностью начала ее проведения и только во вторую очередь выбором наиболее адекватной методики ЗПТ.
Дата: 2018-11-18, просмотров: 402.