Объекты исследования, материалы и оборудование: замороженная в соломинах или гранулах сперма быка; 10%-ный раствор желатины (рН 7,0); фазово-контрастный микроскоп или микроскопы БИОЛАМ (МБИ-3 или МБИ-4) с осветителями ОИ-19 (ОИ-35, МКИ-11) и конденсор светлого и темного поля марки ОИ-10 производства ЛОМО; дозаторы пипеточные и наконечники к ним или Пастеровские пипетки; предметные и покровные стекла; фильтровальная бумага, марлевые салфетки; термостат.
Акросома сперматозоидов содержит две группы ферментов, которые играют важную роль в процессе оплодотворения. Различные дефекты ее или повреждения структуры в процессе обработки и хранения спермы приводят к потере сперматозоидами оплодотворяющей способности. Такие повреждения, как правило, возникают в процессе замораживания и оттаивания спермы. При этом большое значение имеют индивидуальные особенности производителей. Высокая частота повреждений акросомы может существенным образом повлиять на результаты осеменения. Поэтому целесообразно оценивать замороженную сперму не только по подвижности, но и по числу сперматозоидов с поврежденной акросомой. Для этой оценки используют интерференционный или фазово-контрастный микроскоп. При отсутствии их достаточно иметь микроскоп БИОЛАМ (МБИ-3 или МБИ-4) и конденсор темного поля ОИ-10.
Сперматозоиды по окраске почти не отличаются от окружающей среды. Они не адсорбируют свет, не изменяют ни интенсивность, ни цвет прошедшего через них луча, поэтому микроскопия их затруднена. Однако они изменяют фазу волны света. Для обнаружения сдвига фаз используются интерференционные или фазово-контрастные микроскопы.
В фазово-контрастном микроскопе освещение устроено по методу светлого поля. Но в нем имеются: 1) дополнительная (кольцевая) осветительная диафрагма, которая помещается под конденсором (в его передней фокальной плоскости) и 2) фазовая пластинка из вещества, поглощающего свет и вносящего определенный сдвиг фаз; фазовая пластинка помещается в задней фокальной плоскости объектива, где изображается и кольцевая диафрагма. Изображения диафрагмы и фазовой пластинки (вследствие соответствия их размеров) совмещаются. Весь свет, не прошедший через объект, проходит через фазовую пластинку. Луч, прошедший через объект, распадается (подвергается дифракции) на пучки света (убывающей интенсивности), выходящие из объекта под разными углами. Этот дифрагированный свет проходит через весь зрачок объектива, в основном вне изображения кольцевой диафрагмы. Два пучка лучей – один от объекта, другой от среды, в которой находится объект, – соединяются, преобразуя при этом фазовые изменения, обусловленные объектом, в амплитудные (различной интенсивности). В результате получается видимое, фазово-контрастное изображение структуры объекта, в котором распределение яркостей (амплитуд) воспроизводит фазовый рельеф.
Экспресс метод определения оплодотворяющей способности сперматозоидов (разработанный под руководством Соколовской И.И.). Этот метод позволяет определять состояние акросом непосредственно у движущихся сперматозоидов в неразбавленной или оттаянной сперме быка, а также соотношение подвижных и неподвижных клеток.
Замороженную сперму быка оттаивают и разбавляют 10%-ным раствором желатины в отношении 1:1 для создания повышенной вязкости и снижения интенсивности движения сперматозоидов. Каплю разбавленной спермы (0,03 мл) наносят на предметное стекло дозатором пипеточным (Пастеровской пипеткой) и накрывают покровным стеклом. Сперму за пределами стекла удаляют при помощи фильтровальной бумаги. Приготовленные мазки немедленно исследуют под микроскопом БИОЛАМ, оснащенном окуляром 15х и объективом 40х и конденсором ОИ-10. Необходимый уровень освещения обеспечивается при помощи осветителя ОИ-19.
Для получения четкого изображения прикрывают диафрагму конденсора и опускают его кремальеру до упора; находят изображение сперматозоидов в светлом поле конденсора, затем наводят фокус, полностью открывают диафрагму конденсора и вводят в ход лучи темного поля. Следя за изображением, медленно перемещают кремальеру кверху до появления ярко светящихся контуров половых клеток на темном фоне.
На этом фоне можно отчетливо различить три категории клеток:
– сперматозоидов с ярким свечением всего контура головки, иногда с утолщенным передним краем – это биологически полноценные клетки с неповрежденной акросомой; у таких сперматозоидов ярко светятся также тело и хвост (рис.6 );
|    
|
|
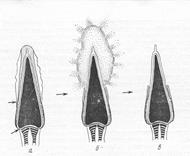
Рис. 6. Слева: сперматозоид с нормальной акросомой (показана стрелкой) и поврежденной. Справа: схема акросомной реакции и потеря плазматической и наружной акросомной мембран при оплодотворении. | |
– сперматозоидов с отчетливо заметным задним ядерным кольцом и хвостом, но слабо заметным контуром передней половины головки – это неполноценные половые клетки с разбухшей акросомой;
– сперматозоидов с полностью отсутствующими контурами всей передней части головки – это клетки с полностью разрушенной или
утерянной акросомой.
Просматривают в препарате 100 сперматозоидов, обладающих прямолинейным поступательным движением, и вычисляют процент клеток с поврежденной акросомой. Каждый образец спермы исследуют сразу после ее оттаивания и спустя 1 и 2 ч (по И.И. Соколовской – однократно). В период исследований сперму выдерживают в термостате при температуре 37°С.
В сперме хорошего качества через 2 ч после оттаивания не должно содержаться более 7 % дефектных сперматозоидов (из всех подвижных). В сперме удовлетворительного качества число таких клеток может быть от 8 до 11%. При содержании 12 % или более дефектных сперматозоидов сперма оценивается как низкого качества (Медведев Г.Ф., Турчанов С.О., 2000).
Дата: 2018-11-18, просмотров: 872.