(морфологически ненормальных) сперматозоидов
Объекты исследования, материалы и оборудование: свежеполученная сперма; микроскопы МБР (МБИ или БИОЛАМ) с осветителями, МБИ-11 или МБИ-14 с телевизионной камерой; конденсор светлого и темного поля марки ОИ-10 производства ЛОМО или фазово-контрастный микроскоп; дозаторы пипеточные и наконечники к ним, пипетки глазные, палочки стеклянные; предметные стекла, стекла с шлифованными краями, пробирки, ванночки; фильтровальная бумага; красители: эозин, берлинская лазурь, кристаллвиолет, анилин, основной фуксин; карболовая кислота, спирт этиловый; калий хлорид, натрий фтористый, КН2РО4 и Na2HPO4 для приготовления фосфатного буфера; 2,9%-ный раствор натрия цитрата, дистиллированная вода, смесь спирта этилового с эфиром (1:1), марлевые салфетки; термостат, обогревательный столик, устройство для сушки мазков.
Для сперматозоидов каждого вида животных характерна своя структура и величина; не исключены и некоторые индивидуальные особенности. Появление в эякуляте значительного числа клеток с явными отклонениями в их структуре (тератоспермия) сопровождается понижением плодовитости производителя. Это может быть обусловлено тем, что продвижение ненормальных сперматозоидов в половом тракте самки к месту оплодотворения нарушено и не накапливается там необходимое число половых клеток (в половом тракте есть места, которые не пропускают ненормальных сперматозоидов), или же с неспособностью таких клеток вызвать оплодотворение и последующее развитие зародыша.
Ненормальности головки имеют большее значение, чем ненормальности в области хвоста. В связи с этим классифицируют ненормальности сперматозоидов как: первичные (главные), вторичные и третичные. Первичные связаны с головкой или акросомой клетки, вторичные – с наличием цитоплазматической капельки в средней части хвоста и третичные – с другими дефектами хвоста.
В предприятиях по искусственному осеменению необходимо периодически (один – два раза в год) тщательно просматривать образцы спермы от каждого производителя и при выявлении повышенного числа ненормальных клеток внимательно обследовать животное.
При наличии фазово-контрастного микроскопа или конденсора ОИ-10 готовят сырой неокрашенный мазок. На обезжиренное предметное стекло наносят капельку спермы и капельку 0,35 М раствора калия хлорида или 40,0 mM натрия фтористого, приготовленных на 2,9%-ном растворе натрия цитрата. После смешивания делают тонкий мазок. Просматривают с использованием иммерсионного объектива 100 клеток. Можно исследовать свежеполученную и оттаянную сперму.
Более надежно исследование производить в окрашенных сухих мазках. Самый простой способ – это использование мазка, окрашенного смесью эозина и анилина голубого при определении процента живых и мертвых сперматозоидов. Однако можно готовить и окрашивать мазок непосредственно для определения патологических форм сперматозоидов.
При приготовлении мазка следует предотвратить температурный шок, в результате которого хвостики сперматозоидов закручиваются и невозможно отличить такие клетки от тех, которые образовались в семенниках. Попадание воды (например, влажное предметное стекло) также вызывает этот артефакт. Свежеполученные сперматозоиды легко разламываются в области шейки, что приводит к увеличению процента бесхвостых головок. Чтобы предотвратить такую опасность, можно до исследования сперму выдержать при комнатной температуре (сохраняемые сперматозоиды менее чувствительны к разломам).
Перед приготовлением мазка сперму разбавляют изотоническим раствором натрия хлорида или натрия цитрата. В пробирку вносят 1 мл раствора и добавляют одну каплю спермы быка. Степень разбавления спермы барана должна быть большей, а спермы хряка и жеребца – меньшей. Температура раствора и спермы перед смешиванием должна быть одинаковой. Смешивание проводят осторожно путем легкого постукивания пальцем по нижнему концу пробирки. Каплю приготовленной смеси помещают на обезжиренное предметное стекло и делают мазок.
Если сперма хранилась несколько часов, то можно нанесенную на предметное стекло каплю спермы накрыть вторым таким же стеклом и плавно, и ровно протянуть его по первому. Мазки высушивают при температуре 36–37°С в термостате, а затем фиксируют на пламени или погружением на 1–2 мин в стаканчик с 96%-ным этиловым спиртом. После фиксации производят окрашивание. Используют различные красители. Хорошие результаты получают при двойном окрашивании анилиновым генцианвиолетом и карболовым фуксином Циля. Фиксация мазков после высушивания не требуется.
Анилиновый генцианвиолет (Эрлиха)
Раствор:
кристаллвиолет (85% красящего вещества) – 2,5 г;
этиловый спирт (96%-ный) – 12 мл.
Раствор:
анилин – 2 мл;
дистиллированная вода – 98 мл.
После полного растворения оба раствора смешивают вместе и хранят во флаконе со стеклянной пробкой.
Карболовый фуксин Циля
Раствор А:
основной фуксин (90% красящего вещества) – 3 г;
этиловый спирт (96%-ный) – 10 мл.
Раствор Б:
фенол (карболовая кислота) – 5 г;
дистиллированная вода – 95 мл.
Раствор А добавляют в раствор Б, смешивают и хранят во флаконе со стеклянной пробкой.
Для получения лучших результатов карболовый фуксин надо время от времени фильтровать. Хранить обе краски можно бесконечно.
Высушенные мазки окрашивают в течение 2 мин анилиновым генцианвиолетом и сразу же промывают проточной, затем дистиллированной водой и высушивают. После этого дополнительно окрашивают карболовым фуксином в течение 10–15 с или дольше, в зависимости от желательной интенсивности окрашивания; промывают проточной водой, потом дистиллированной и высушивают.
Из каждого образца спермы готовят 2–3 мазка, исследуют под микроскопом с иммерсионной системой и в каждом из них просматривают 100–200 сперматозоидов. Это дает более надежные результаты, чем просмотр большего количества клеток (до 500) в одном мазке. При подсчете ненормальных сперматозоидов придерживаются какой-либо классификации. Проще всего аномалии в структуре сперматозоидов классифицировать по измененным частям их: аномалии в области головки, шейки, средней части (тела) и хвоста (рис. 5).
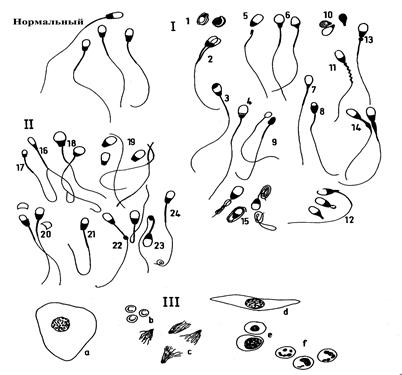
|
| Рис. 5. Классификация патологических форм сперматозоидов в зависимости от степени влияния их на плодовитость. Главные дефекты (I ): 1 – несформировавшиеся клетки; 2 – сдвоенные; 3 – дефект акросомы (шишковидный сперматозоид); 4 – «корона» дефект; 5 – отделенная головка (хвост активный); 6 – грушевидные формы; 7 – головка с суживающимся основанием; 8 – головка с ненормальными очертаниями; 9 – маленькая ненормальная головка; 10 – отделенные ненормальные головки; 11 – штопорообразное тело; 12 – дополнительный хвост, культявидное тело; 13 – проксимальная цитоплазматическая капелька; 14 – псевдокапелька, утолщение тела; 15 – извитой или сильно сложенный хвостик, «даг» дефект (клок свалявшейся шерсти). Второстепенные дефекты (II): 16 – узкая головка; 17 – маленькая нормальная головка; 18 – гигантская и короткая широкая головка; 19 – отделенные нормальные головки; 20 – отделенные акросомы; 21 – асимметричное прикрепление тела и хвоста; 22 – дистальная цитоплазматическая капелька; 23 – правильно изогнутый хвост; 24 – закрученный кончик хвоста. Другие клеточные элементы (III): а – эпителиальные клетки; b – эритроциты; c – медузоподобные образования; d – ладьевидные клетки; e – мононуклеарные лейкоциты; f – нейтрофилы (Arthurۥs Veterinary Reproduction and Obstetrics. Eighth Edition. 2001. 868 р. Reprinted 2007). |
Головки могут быть двойными, конусообразными и грушевидными, круглыми, сморщенными, большими, узкими, удлиненными, уменьшенными, асимметричными. Наиболее частые аномалии шейки: сломанные шейки, бесхвостые головки. Аномалии тела: изогнутые, разорванные, удлиненные, утолщенные, двойные, нитевидные и рудиментарные, а также ненормальное прикрепление тела к головке. Аномалии хвостика: извитые, двойные, сломанные, изогнутые, закрученные и срезанные.
В сперме барана и быка содержание морфологически ненормальных сперматозоидов не должно превышать 7 – 14%, в сперме хряка и жеребца – 20%.
Дата: 2018-11-18, просмотров: 772.