МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА
И ПРОДОВОЛЬСТВИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
 |
ГЛАВНОЕ УПРАВЛЕНИЕ ОБРАЗОВАНИЯ, НАУКИ И КАДРОВ

УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ
«БЕЛОРУССКАЯ ГОСУДАРСТВЕННАЯ
СЕЛЬСКОХОЗЯЙСТВЕННАЯ АКАДЕМИЯ»
 | |||
 | |||
Кафедра физиологии, биотехнологии и ветеринарии
БИОТЕХНИКА РАЗМНОЖЕНИЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ
ЖИВОТНЫХ
ЧАСТЬ 2. ПОЛУЧЕНИЕ И ОЦЕНКА КАЧЕСТВА СПЕРМЫ САМЦОВ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ И ПТИЦ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К ЛАБОРАТОРНЫМ ЗАНЯТИЯМ
Для студентов специальности 1-74 03 01 – зоотехния
Специализаций 1-74 03 01 01 – биотехнология и селекция
животных, 1-74 03 01 03 – птицеводство, 1-74 03 01 06 –
Производство свинины на промышленной основе
Горки 2008
Одобрено методической комиссией зооинженерного факультета 16.07.2008 (протокол № 9).
Составили: Г. Ф. Медведев, Н. И. Гавриченко, И. А. Долин.
УДК 619:591.16
Биотехника размножения сельскохозяйственных животных. Ч а с т ь 2. Получение и оценка качества спермы самцов сельскохозяйственных животных и птиц: методические указания / Белорусская государственная сельскохозяйственная академия; сост. Г. Ф. М е д в е д е в, Н. И. Г а в р и ч е н к о, И. А. Д о л и н. Горки, 2008. 52 с.
Приведены по трем темам занятий цель, материалы и оборудование, описаны сущность и использование различных методов получения спермы от производителей сельскохозяйственных животных и птиц и оценки качества ее, дано разъяснение влияния на сперматозоидов физических и химических факторов.
Для студентов специальности 1-74 03 01 – зоотехния специализаций 1-74 03 01 01 – биотехнология и селекция животных, 1-74 03 01 03 – птицеводство, 1-74 03 01 06 – производство свинины на промышленной основе.
Таблиц 4. Рисунков 6.
Рецензент профессор И.С. Серяков.
ã Составление. Г.Ф. Медведев,
Н.И. Гавриченко, И.А. Долин, 2008
ã Учреждение образования
«Белорусская государственная
сельскохозяйственная академия», 2008
Получение спермы от производителей
В искусственную вагину
Получение спермы от быка
Условия и место получения спермы. Сперму от быка получают на корову, другого быка, вола или же на чучело. Использование быков-производителей в качестве подставных животных неблагоприятно отражается на качестве их спермы, поэтому практикуется редко. Взятие спермы с использованием механических установок более целесообразно по сравнению с подставными животными: снижается микробная контаминация эякулятов, улучшаются условия работы техников, повышаются технологические свойства спермы и удлиняются сроки эксплуатации производителей. Наиболее популярны механическое чучело с амортизирующим устройством и подвижное чучело.
Получают сперму в манеже, а в теплое время года – и на открытой площадке. Манеж должен быть просторным, высотой не менее 4 м, площадью – 70 м2 или более. В нем устанавливается одно или несколько чучел и станки (устройства) для фиксации животных-манекенов. Сзади станка или чучела пол покрывают прочными резиновыми матами или ковриками из другого эластичного материала. Возле стенок манежа устанавливают защитные барьеры, обеспечивающие безопасность работы с животными.
Взятие спермы проводят в утренние часы до кормления производителей. Именно такая очередность производственных процессов необходима потому, что одновременное сочетание акта кормления и взятия спермы является одним из факторов, предрасполагающих к развитию импотенции.
Получение высококачественной спермы возможно лишь при условии хорошей подготовки быков непосредственно перед ее взятием. При этом важное место должно отводиться функциональной подготовке. Целостная эффективная система подготовки их к получению спермы включает следующие мероприятия.
1. Гигиена манекена (животного, чучела). До начала работы животных, на которых получают сперму, необходимо тщательно почистить, чтобы во время садки производителя микроорганизмы с частицами грязи и пыли с них не попадали в воздух, на половой член производителя и в искусственную вагину. Если используют чучело, то его моют теплой водой с мылом, высушивают и обеззараживают 2%-ным раствором хлорамина. Можно использовать для мытья и обеззараживания раствор перекиси водорода. Обработку чучела проводят обычно сразу после окончания получения спермы.
2. Гигиена быка-производителя – чистка, подмывание препуция и высушивание. Наружную поверхность препуция обмывают теплым раствором фурацилина и насухо вытирают бумажной салфеткой или туалетной бумагой. Можно использовать индивидуальные полотенца. Если препуций сильно загрязнен, то его моют теплой водой с мылом, а затем обмывают раствором фурацилина. Полностью животное моют за день до получения спермы или не ранее, чем за 1–1,5 ч до получения, и тщательно высушивают.
3. Подвязывание стерильного фартука.
4. Функциональная подготовка к взятию спермы быков молочных пород: ввод в манеж, подвод к манекену, одна холостая садка, выдержка возле манекена 2,5 мин, две холостые садки и получение эякулята. Такая же подготовка и перед получением второго эякулята. При отсутствии фартука во время холостых садок половой член производителя необходимо отводить в сторону, чтобы он не касался манекена или чучела. Быков мясных пород после подвода к манекену не сдерживают, а позволяют сделать три холостых садки, затем берут первый эякулят; второй эякулят обычно получают без предварительных холостых садок.
5. Температура в искусственной вагине с одноразовым полиэтиленовым спермоприемником устанавливается в пределах 45 – 46°С (возможно до 55°С).
6. Проводка производителя и получение второго эякулята не позднее, чем через 10–15 мин.
7. Регулярная смена манекена, замена чучела на манекена или наоборот, смена места получения спермы, присутствие других животных в манеже.
Техника получения спермы от быка. В манеж для взятия спермы вводят быка с помощью палки-водила длиной около 2 м, зафиксированной за носовое кольцо. Производителя подводят к животному-манекену, выдерживают 1–2 мин (не более 3 мин) и допускают садку. В момент прыжка быка оператор, расположенный справа и сзади подставного животного или чучела, левой рукой осторожно смещает за препуциальный мешок половой член производителя в правую сторону и направляет его в искусственную вагину, продольная ось которой в этот момент должна совпадать с направлением полового члена. После совокупительного толчка искусственную вагину с полового члена снимают не сразу, а опускают ее с движением быка. После этого, отняв искусственную вагину, нужно перевернуть ее спермоприемником вниз, открыть краник, чтобы выпустить из вагины воздух, дать стечь эякуляту в спермоприемник и отделить его от вагины. От вагины стеклянный спермоприемник отделяют постепенно и осторожно, затем закрывают крышкой. В современной модели прибора полиэтиленовый спермоприемник оставляют на цилиндре вагины и при помощи прибора "Молния" герметизируют в нем полученный эякулят, после чего ножницами отделяют эту часть и передают в лабораторию.
Получение спермы от хряка
От хряков сперму получают в манеже пункта искусственного осеменения. В качестве манекена используют чучело свиньи. Конструкции чучел разнообразны, но все они имеют сплошную поверхность, что позволяет легко мыть и дезинфицировать ее. Чаще используется деревянное чучело. По внешнему виду оно похоже на свинью, и это способствует более быстрой выработке у хряков условных половых рефлексов и обеспечивает в последующем хорошее их проявление. Искусственная вагина фиксируется внутри чучела. Наружная поверхность задней части его имеет воронкообразное углубление с отверстием в центре. Оно совпадает с просветом искусственной вагины. Для обеспечения скольжения и попадания полового члена хряка в вагину углубление в стенке чучела делают гладким и скользким. Это достигается путем нанесения на деревянную поверхность кисточкой раствора органического стекла в ацетоне или дихлорэтане. При получении спермы в холодном помещении внутрь чучела помещается электрическая лампочка. Включают ее в сеть в момент получения спермы. Это предотвращает снижение температуры в искусственной вагине. На спермоприемник надевают ватно-марлевый чехол.
Нередко используются чучела, представляющие собой простые лавки. На расстоянии примерно 60 см от задней части чучела размещают опоры для передних конечностей хряка. Лавку обивают мягким материалом, а сверху – кожей. При получении спермы на такое чучело искусственную вагину техник держит в руке или же получает сперму мануальным способом. В помещении чучело размещается так, чтобы хряк подходил к нему сзади и с боков, но не спереди. Особое внимание обращают на высоту задней части чучела и наличие удобной для хряка поверхности пола (не скользкой, ребристой).
После садки на чучело хряк делает поисковые движения пенисом, при этом все глубже и глубже вводит его в вагину. После нескольких глубоких совокупительных движений он успокаивается и начинает выделять сперму. Хвост у него в это время закручивается кверху, семенники подтягиваются ближе к анальному отверстию, мошонка становится слабо напряженной и несколько отвисшей. После окончания эякуляции хряка удаляют из манежа, искусственную вагину вынимают из чучела, отсоединяют от нее спермоприемник и передают его в лабораторию.
Получение спермы от жеребца
Сперму от жеребца получают на открытой ровной площадке среди двора или под навесом. В холодную дождливую погоду получать сперму лучше в закрытом помещении (манеже) с высоким потолком. Получают сперму на кобылу в охоте. Тазовые конечности ее фиксируют случной шлеей, хвост забинтовывают.
После подготовки кобылы два человека выводят жеребца на поводьях. Спокойных жеребцов может выводить один человек. Как только у производителя хорошо проявится эрекция (пенис приподнимается к брюху), его сразу же пускают на кобылу. Техник по взятию спермы находится с правой стороны кобылы, в нескольких шагах; вагину удерживает в правой руке. Один из его помощников находится с другой стороны и во время садки жеребца должен быстро отвести хвост кобылы в сторону и постоянно удерживать его. Техник в момент начала садки быстро приближается к животным, искусственную вагину прижимает к крупу кобылы, а левой рукой берется за половой член жеребца вблизи головки (ладонь руки обращена вниз) и направляет его в вагину. Касание рукой полового члена не тормозит половых рефлексов у жеребцов. Не следует только дотрагиваться до головки пениса. Как только половой член производителя попадет в искусственную вагину, ее необходимо прижать обеими руками к крупу кобылы. При этом левая рука фиксирует скобу корпуса, а правая располагается сверху спермоприемника; угол наклона вагины спермоприемником вверх 30–35°. При получении спермы от крупных жеребцов технику помогает удерживать вагину помощник. Жеребец делает мощные совокупительные движения, и чтобы вагина не отходила вперед необходимо особый упор делать на спермоприемник. Эякуляция проявится быстрее, если головка пениса будет достигать суженной части горловины. Здесь возникает необходимое для выделения спермы давление. Во время совокупительных движений необходимо следить за состоянием резиновой камеры вагины. Если возникает опасность срыва ее с цилиндра или нарушения целостности, то немедленно ослабляют пробку патрубка и выпускают немного воздуха; затем опять пробку плотно закручивают. При разрыве камеры воздух и вода выходят из цилиндра и жеребец немедленно прекращает садку.
Садка у лошадей продолжается 1–1,5 мин, зякуляция происходит в течение 10–20 с. Об эякуляции можно судить по ритмичному сокращению мускулатуры корня хвоста, вследствие чего он поднимается и опускается, а также путем ощущения продвижения спермы по мочеполовому каналу вблизи мошонки. Совокупительные движения во время выделения спермы прекращается.
В конце эякуляции жеребец медленно опускается (сползает) с кобылы. Вместе с ним опускают искусственную вагину спермоприемником вниз, а затем медленно и осторожно, чтобы не потерять часть зякулята, снимают с полового члена. Следует учитывать, что головка пениса в это время сильно увеличена и грубое и быстрое снятие вагины может причинить боль производителю. Если садка по какой-то причине не получилась, то жеребцу делают проводку в течение нескольких минут и затем опять подводят к кобыле.
Спермы от производителей
Мануальный метод получения спермы от хряка. При получении спермы хряки менее чувствительны к температуре в вагине, чем быки, но для них очень важным является давление. При коитусе необходимое давление создается после введения закрученной головки пениса в сильно складчатый цервикальный канал. В зависимости от состояния мышечной оболочки шейки матки давление в нем периодически изменяется. Соответствующие условия можно симулировать путем обхватывания выдвинутого пениса пальцами руки, на которую одета теплая, смазанная латексная перчатка. Давление, создаваемое рукой, легко вызывает эякуляцию. Этот прием, названный мануальным методом, вытеснил традиционный метод искусственной вагины и в настоящее время повсеместно используется для получения спермы.
При этом методе после вскакивания хряка на чучело или свиноматку в охоте и первых начальных движениях полового члена осторожно кладут на него левую руку в перчатке. Когда совокупительные движения хорошо проявятся и половой член окажется выдвинутым полностью, обхватывают головку и плавным движением назад пытаются распрямить естественную ее извитость. Давление усиливают, что вызывает более энергичные совокупительные движения, и вскоре начинается эякуляция. На протяжении всей эякуляции, которая длится 305 с (колебания от 181 до 366 с), давление на головку пениса не должно ослабевать.
После начала эякуляции конечную часть полового члена обычно отводят в сторону и несколько вниз. Сперму собирают в изотермический сосуд со специальным мешком с фильтром. Можно использовать простую стеклянную теплую (температура 30°С) банку. На нее также кладут фильтр (марлевый). Фильтр необходим для отделения густой желеобразной фракции спермы.
Первые порции спермы содержат небольшие количества желатина– подобного вещества, которое остается вблизи головки полового члена, и сразу же выделяется прозрачная или слегка мутноватая фракция. Длительность выделения первой фракции около 50 с (24–79 с). Ее не собирают, а собирают только последующую фракцию, которая имеет молочно-белую окраску и богата сперматозоидами. Длительность выделения этой фракции – 140 с (от 92 до 195 с). Концентрация сперматозоидов в начале выделения фракции достигает 0,33 – 0,48 млрд/мл, но к концу уменьшается до 0,01 – 0,03 млрд/мл. После основной фракции выделяется в течение 106 с (с колебаниями от 39 до 161 с) третья фракция сероватого цвета; ее также не собирают. К концу эякуляции хряк опять начинает делать совокупительные движения и выделяется при этом желеобразная фракция спермы. Объем фракций составляет соответственно 8,6 ± 2,0 мл, 185,7 ± 21,9 мл и 116,1 ± 20,0 мл. В целом объем эякулята равен 310,4 ± 30,0 мл (Медведев Г.Ф., Ходыкин Д.С., 2007).
Используя этот способ, можно уверенно распознать и отделить основную фракцию спермы от остальных, снизить микробную загрязненность спермы, объективно и точно оценить весь процесс эякуляции.
При получении спермы от хряков следует строго соблюдать правила гигиены. Даже при хороших условиях содержания хряки обычно загрязнены и при садке их на чучело поднимается много пыли. Больше всего загрязнена кожа живота и препуция. Поэтому незадолго до получения спермы хряка необходимо помыть под душем либо в специальной установке, где кожа не только смачивается, но и механически очищается щетками и затем высушивается теплым воздухом.
Получение спермы от быка с помощью электроэякулятора. В практике иногда возникает необходимость применить метод электроэякуляции. Обычно этим методом получают сперму от молодых, не приученных к искусственной вагине быков для оценки качества их спермы, а в центрах по искусственному осеменению – и от старых, хромых быков, которые не могут сделать садку. Перед получением спермы производителя фиксируют в станке, прямую кишку освобождают от каловых масс и подмывают препуций. При наличии современного прибора зонд с электродами вставляют в прямую кишку и прижимают книзу. После этого делают электрические стимулы в соответствии с рекомендованным инструкцией режимом, при этом напряжение тока постепенно повышают. Вначале при невысоком напряжении происходит выделение секрета луковичных желез, затем следует обильное выделение секрета пузырьковидных и предстательной желез, и наконец семенная жидкость по каплям стекает по волосам препуция или из отростка уретры выдвинутого полового члена. Обычно сперма выделяется спонтанно, пассивно, но иногда отмечается эрекция пениса и оргазм. В таких случаях эякулят нередко теряется. Оргазм часто сопровождается поворотом головки полового члена вокруг продольной оси. Это же можно наблюдать и при массаже и при получении спермы в искусственную вагину. В момент электроэякуляции сперму собирают как и при ректальном массаже. Объем зякулята чаще больше стандартного.
Получение спермы от быка методом массажа. Известно, что во время полового возбуждения сперматозоиды из канала придатка семенника перемещаются в ампулы спермиопроводов и сохраняются там до момента эякуляции. Массажем можно вызвать сокращение ампул и выделение половых клеток наружу.
Перед получением спермы быка выдерживают возле коровы в охоте, чтобы вызвать у него половое возбуждение. Затем руку вводят в прямую кишку на глубину 25 – 35 см; при необходимости освобождают ее от каловых масс. В момент расслабления находят твердый червеобразный орган – мочеполовой канал. Двигая по нему рукой вперед, отыскивают мягкую шейку мочевого пузыря с лежащими на ней ампулами спермиопроводов в виде эластичных трубок толщиной почти с палец, а по бокам от них – грушевидные пузырьковидные железы. Производят осторожный массаж желез спереди назад и таким же образом массируют ампулы спермиопроводов. Обычно двухминутного массажа бывает достаточно для того, чтобы выделилась сперма. Если массировать только пузырьковидные железы, то, как правило, выделяется семенная жидкость без сперматозоидов.
Так как пенис при массаже часто не выдвигается и не наступает эрекция, то для предотвращения загрязнения спермы волос вокруг отверстия препуция тщательно подмывают и вытирают насухо. Сперму собирают в чистый стаканчик, подставленный к отверстию препуция, или специальное приспособление, входящее в комплект электроэякулятора.
Полученная этим методом сперма нередко загрязняется мочой, имеет более высокое содержание секрета пузырьковидных желез и вообще худшее, чем в нормально эякулированной жидкости соотношение отдельных компонентов. При грубом и неумелом массаже возможны травмы спермиопроводов и пузырьковидных желез. Этом метод используют лишь иногда для получения спермы от тех быков, которые по какой-либо причине не в состоянии выделить сперму в искусственную вагину (слабые или больные задние конечности, слишком вялое проявление половых рефлексов и др.).
Карболовый фуксин Циля
Раствор А:
основной фуксин (90% красящего вещества) – 3 г;
этиловый спирт (96%-ный) – 10 мл.
Раствор Б:
фенол (карболовая кислота) – 5 г;
дистиллированная вода – 95 мл.
Раствор А добавляют в раствор Б, смешивают и хранят во флаконе со стеклянной пробкой.
Для получения лучших результатов карболовый фуксин надо время от времени фильтровать. Хранить обе краски можно бесконечно.
Высушенные мазки окрашивают в течение 2 мин анилиновым генцианвиолетом и сразу же промывают проточной, затем дистиллированной водой и высушивают. После этого дополнительно окрашивают карболовым фуксином в течение 10–15 с или дольше, в зависимости от желательной интенсивности окрашивания; промывают проточной водой, потом дистиллированной и высушивают.
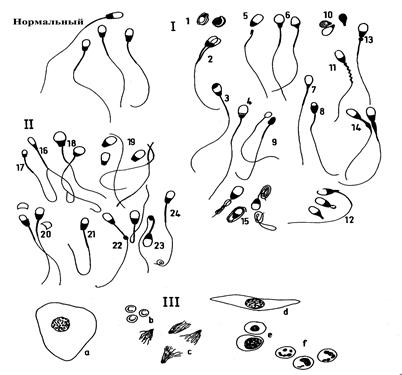
Из каждого образца спермы готовят 2–3 мазка, исследуют под микроскопом с иммерсионной системой и в каждом из них просматривают 100–200 сперматозоидов. Это дает более надежные результаты, чем просмотр большего количества клеток (до 500) в одном мазке. При подсчете ненормальных сперматозоидов придерживаются какой-либо классификации. Проще всего аномалии в структуре сперматозоидов классифицировать по измененным частям их: аномалии в области головки, шейки, средней части (тела) и хвоста (рис. 5).
|
| Рис. 5. Классификация патологических форм сперматозоидов в зависимости от степени влияния их на плодовитость. Главные дефекты (I ): 1 – несформировавшиеся клетки; 2 – сдвоенные; 3 – дефект акросомы (шишковидный сперматозоид); 4 – «корона» дефект; 5 – отделенная головка (хвост активный); 6 – грушевидные формы; 7 – головка с суживающимся основанием; 8 – головка с ненормальными очертаниями; 9 – маленькая ненормальная головка; 10 – отделенные ненормальные головки; 11 – штопорообразное тело; 12 – дополнительный хвост, культявидное тело; 13 – проксимальная цитоплазматическая капелька; 14 – псевдокапелька, утолщение тела; 15 – извитой или сильно сложенный хвостик, «даг» дефект (клок свалявшейся шерсти). Второстепенные дефекты (II): 16 – узкая головка; 17 – маленькая нормальная головка; 18 – гигантская и короткая широкая головка; 19 – отделенные нормальные головки; 20 – отделенные акросомы; 21 – асимметричное прикрепление тела и хвоста; 22 – дистальная цитоплазматическая капелька; 23 – правильно изогнутый хвост; 24 – закрученный кончик хвоста. Другие клеточные элементы (III): а – эпителиальные клетки; b – эритроциты; c – медузоподобные образования; d – ладьевидные клетки; e – мононуклеарные лейкоциты; f – нейтрофилы (Arthurۥs Veterinary Reproduction and Obstetrics. Eighth Edition. 2001. 868 р. Reprinted 2007). |
Головки могут быть двойными, конусообразными и грушевидными, круглыми, сморщенными, большими, узкими, удлиненными, уменьшенными, асимметричными. Наиболее частые аномалии шейки: сломанные шейки, бесхвостые головки. Аномалии тела: изогнутые, разорванные, удлиненные, утолщенные, двойные, нитевидные и рудиментарные, а также ненормальное прикрепление тела к головке. Аномалии хвостика: извитые, двойные, сломанные, изогнутые, закрученные и срезанные.
В сперме барана и быка содержание морфологически ненормальных сперматозоидов не должно превышать 7 – 14%, в сперме хряка и жеребца – 20%.
Оценка качества спермы птиц
Для оценки спермы определяют ее внешние свойства (цвет, консистенцию), объем, густоту, подвижность и концентрацию сперматозоидов. Объем эякулята определяют по верхнему мениску градуированного спермоприемника или градуированной пипеткой. Цвет и густоту спермы определяют визуально.
У индюка густая сперма имеет консистенцию сметаны, в 1 мл содержит 8 млрд. сперматозоидов или более. Она почти не стекает по желобку копуляторного органа, в массе своей имеет выпуклую форму. Средняя сперма с консистенцией густых сливок, медленно стекает по желобку толстым слоем, в 1 мл – 6–8 млрд. клеток. Редкая сперма с консистенцией густого молока или редких сливок тонким слоем стекает быстро по желобку, в 1 мл содержит 3–5 млрд. сперматозоидов.
Подвижность сперматозоидов оценивают под микроскопом, нередко в смешанных эякулятах (от 7–10 самцов), а концентрацию – путем подсчета в счетной камере и с помощью ФЭК или спектрофотометра. Вследствие высокой концентрации оценка подвижности сперматозоидов по 10-балльной системе затруднена.
Н. Канарейкин (1975) использовал 6-балльную систему оценки качества спермы индюков:
1 балл – движение сперматозоидов настолько энергично, что едва можно различить отдельные клетки;
2 балла – движение сперматозоидов энергичное, но можно различить отдельные клетки;
3 балла – движение спокойное поступательное;
4 балла – слабое (ленивое) замирающее движение;
5 баллов – слабое колебательное движение;
6 баллов – сперматозоиды неподвижные.
Для осеменения рекомендует использовать сперму индюков с оценкой 1 и 2 балла.
Контрольные вопросы
1. В какие сроки должна быть проведена оценка полученной спермы? При какой температуре хранят ее до разбавления?
2. От чего зависят внешние свойства спермы – цвет и консистенция? Каковы характерные цвет и консистенция спермы хорошего качества у различных производителей животных и птиц?
3. Чем может быть загрязнена сперма? Что делают со спермой, загрязненной или с измененными цветом, консистенцией?
4. Можно ли ограничиться оценкой внешних свойств спермы?
5. Как влияет понижение температуры на подвижность сперматозоидов в свежеполученной сперме? При какой температуре следует определять их подвижность?
6. Влияют ли толщина мазка и процент подвижных сперматозоидов на результаты оценки спермы при микроскопическом исследовании? Как оценивают подвижность сперматозоидов в различных странах?
7. С какой целью определяют концентрацию сперматозоидов в сперме?
8. Какой метод наиболее часто используется для определения концентрации сперматозоидов? Какие факторы влияют на этот показатель?
9. Какие наиболее типичные отклонения встречаются в морфологии сперматозоидов? Как их классифицируют?
10. Какие факторы могут вызвать появление в сперме повышенного числа ненормальных сперматозоидов?
11. Какие аномалии сперматозоидов обусловлены генетически и какие связаны с факторами внешней среды? Какие аномалии наиболее сильно влияют на плодовитость производителя?
12. Какие тесты можно использовать для оценки интенсивности метаболических процессов в сперме? Их сущность?
13. Существует ли корреляционная связь между концентрацией сперматозоидов в сперме и индексом фруктолиза, величиной рН, скоростью обесцвечивания метиленовой сини?
14. Как изменяется рН свежеполученной спермы при хранении при комнатной температуре?
15. Каковы стандартные показатели качества спермы быков, баранов, хряков, жеребцов, кроликов и индюков?
16. Какие показатели качества спермы подвержены наибольшим изменениям?
17. Возможно ли улучшение качества спермы после ее получения?
18. Какие методы оценки качества спермы позволяют наиболее объективно и точно прогнозировать ее оплодотворяющую способность?
19. Результаты какой оценки спермы: до замораживания (охлаждения) или после оттаивания более важны при искусственном осеменении?
20. Как определить состояние акросом у подвижных сперматозоидов? Сохраняют ли сперматозоиды способность к оплодотворению при повреждении акросомы?
21. Какие факторы влияют на результаты оценки качества спермы?
22. Почему необходимо постоянно регистрировать показатели качества эякулятов у одного и того же производителя?
Тема 6. Изучение влияния на сперматозоидов
физических и химических факторов
Цель занятия: изучить действие физических и химических факторов на подвижность и выживаемость сперматозоидов.
Объекты исследования, материалы и оборудование: животные – бык, корова (чучело) или самец и самка другого вида; оборудование, материалы и инструменты для получения спермы (соответствующего вида животных); термостат для микроскопа; микроскопы с осветителями, микроскоп МБИ-11 (БИОЛАМ - М) с телевизионной камерой; обогревательные столики, металлическая пластина; дозаторы пипеточные и наконечники к ним, пипетки глазные, палочки стеклянные; предметные и покровные стекла; марлевые салфетки, полотенца; растворы натрия хлорида: физиологический, 0,5%-ный и 3%-ный; 1%-ный раствор молочной кислоты; лед, поваренная соль; ртутный термометр; прибор для измерения рН, раствор универсального индикатора (или бумажные индикаторные полоски).
Методические указания. Занятия проводят в ветеринарной клинике и лаборатории кафедры или в учебном пункте. Сначала преподаватель объясняет студентам действие на сперматозоидов некоторых факторов, знакомит их с методами контроля физических и химических свойств сред для разбавления спермы. Затем студенты готовят искусственную вагину для получения спермы (от быка или самца другого вида животных), получают сперму; одновременно приготавливают и среду для разбавления спермы. Разделившись на группы (по 2 человека за столом) изучают действие температуры, растворов с различным осмотическим давлением, молочной кислоты на подвижность и выживаемость сперматозоидов. В конце занятия преподаватель демонстрирует студентам определение осмотического давления среды для разбавления спермы методом криоскопии и рН среды потенциометрическим методом.
Изучение действия высокой и низкой температуры. В выделенной сперме, имеющей температуру 38,5°С, сперматозоиды проявляют высокую метаболическую активность и подвижность. При повышении температуры до 41–43°С подвижность их возрастает, а скорость гликолиза в сперме быка достигает максимума при 43–46°С. При температуре около 50°С происходит денатурация белка и другие необратимые изменения, которые приводят к гибели клеток. Продолжительность жизни сперматозоидов при температуре выше 20°С ограничена несколькими часами. Это связано с быстрым расходованием ими ряда химических соединений и неспособностью восстанавливать или поглощать их из внешней среды.
При понижении температуры интенсивность движения сперматозоидов уменьшается, а при температуре 7°С они приостанавливают свои движения. Интенсивность метаболических процессов снижается, но полностью они не прекращаются и протекают еще на достаточно высоком уровне (состояние анабиоза). Продолжительность сохранения оплодотворяющей способности сперматозоидов при таких температурах (0–5°С) увеличивается до нескольких дней.
После подогревания охлажденной спермы подвижность сперматозоидов восстанавливается. Однако это наблюдается в том случае, если охлаждалась сперма медленно. В других случаях охлаждение может вызвать у сперматозоидов необратимые изменения и их гибель. Это происходит вследствие "холодового удара" (температурного шока) в результате резкого охлаждения. Температурный шок наблюдается при температурах выше 0°С, но возможен и при отрицательных температурах, когда сохраняется жидкая фаза и имеются условия для протекания осмотических процессов.
Наиболее чувствительны к быстрому снижению температуры сперматозоиды хряка. В неразбавленной сперме быка температурный шок у сперматозоидов возможен при температуре ниже 24°С. В разбавленной желточно-цитратной или молочной средой сперме действие температурного шока может проявиться при резком снижении температуры ниже 16°С. В связи с этим в практике должны обращать внимание на скорость охлаждения разбавленной спермы до момента замораживания.
Для изучения действия различных температур на сперматозоидов из полученной спермы готовят три мазка; предметные стекла предварительно подогревают до температуры спермы. Один мазок помещают поочередно на два подготовленные обогревательные столики с температурой 38°С и 43–45°С и определяют под микроскопом подвижность сперматозоидов; затем мазок снимают с обогревательного столика и оставляют при комнатной температуре на 5–7 мин. Второй мазок помещают на лед и охлаждают несколько минут. После охлаждения вначале определяют под микроскопом состояние сперматозоидов при комнатной температуре, а затем кладут на обогревательный столик и определяют их подвижность при температуре 38°С.
Также поступают и с уже исследованным первым мазком: просматривают его при комнатной температуре, а потом – после подогревания до 38°С.
При комнатной температуре в первом мазке сперматозоиды будут проявлять заметную подвижность, а после подогревания исходная подвижность восстановится. Во втором мазке при комнатной температуре только отдельные сперматозоиды проявят слабые движения, а после подогревания немногие из них восстановят подвижность; большинство же клеток будут неподвижными – они погибнут вследствие температурного шока.
В третьем мазке определяют подвижность сперматозоидов сначала при температуре 38°С, а затем мазок помещают на подогретую до 55°С пластину и оставляют на ней несколько минут. После этого опять определяют подвижность сперматозоидов. Все клетки погибнут и не проявят подвижность.
Изучение действия растворов (сред) с различным осмотическим давлением. Осмотическое давление спермы определяется количеством растворенных в плазме веществ: минеральных и органических. Выражается осмотическое давление в атмосферах; колеблется в пределах 6,7–8,7 атм. Определяется этот показатель на основании величины депрессии, т.е. точки замерзания, которая для спермы животных равна примерно минус 0,6°С, и исходя из правила, что раствор, содержащий в 1 л грамм-молекулу не электролита, дает депрессию минус 1,86°С и имеет осмотическое давление 22,4 атм. Для получения равных по осмотическому давлению сперме растворов (изотонических) необходимо брать 1/3 грамм-молекулы не электролита на 1 л дистиллированной воды. Если берется электролит, то количество вещества уменьшается во столько раз, на сколько ионов диссоциирует его молекула. Например, для приготовления изотонического раствора натрия хлорида необходимо взять не одну треть, а одну шестую грамм-молекулы, т.е. 58,5:6.
Если поместить сперматозоидов в гипотонический раствор или дистиллированную воду, то они быстро погибнут вследствие повышения внутреннего давления. Под влиянием гипотонического раствора хвостики сперматозоидов набухают и закручиваются. В гипертоническом растворе сперматозоиды погибают от обезвоживания. Они сморщиваются, а хвостики их приобретают зигзаговидную форму. Особенно губительно для сперматозоидов быстрое изменение осмотического давления. В изотоническом растворе (физиологический раствор, среда Дюльбекко и др.) сперматозоиды будут проявлять высокую подвижность в течение достаточно продолжительного периода времени.
Для изучения действия на сперматозоидов растворов с различной концентрацией солей из полученной спермы (или оттаянной) готовят три мазка. Для этого на подогретое предметное стекло наносят дозатором пипеточным или глазной пипеткой три капельки спермы и рядом с каждой из них капельку одного из трех растворов натрия хлорида: изотонического, 0,5%-ного и 3%-ного. Каждую пару капелек (сперму и раствор) осторожно накрывают покровным стеклом так, чтобы они соединились под покровным стеклом, но граница между ними четко просматривалась. Все три мазка исследуют под микроскопом и наблюдают за состоянием сперматозоидов на границе раствора и спермы, а также в растворе и в сперме.
Изучение действия рН среды. Если сперму быка или барана хранить при комнатной температуре, то в результате гликолиза накапливается молочная кислота, буферные свойства спермы ослабевают, а затем показатель рН начинает снижаться. Подвижность сперматозоидов замедляется, а затем приостанавливается полностью вследствие наступления состояния анабиоза. Тормозится подвижность сперматозоидов и в гипертонических солевых растворах. При повышении рН и температуры среды, или при добавлении воды в гипертонический раствор сперматозоиды восстанавливают свою подвижность.
Для перевода клеток в активное состояние температура должна быть тем выше, чем ниже рН. Так, в слабощелочной среде (рН 7,6) сперматозоиды двигаются при температуре 15–20°С, а при рН 6,0 движение их проявляется только при 35–40°С. При рН 4,5 одного повышения температуры уже недостаточно, чтобы вывести сперматозоидов из анабиоза, требуется одновременное повышение температуры и подщелачивание среды. Длительное воздействие на сперматозоидов среды с более низким значением рН приводит к их гибели. Слабые органические кислоты проявляют губительное действие и при рН выше 5,0. Так, при температуре 4°С молочная кислота может необратимо иммобилизовать сперматозоидов уже при рН 6,0.
Сразу же после получения из неразбавленной спермы готовят несколько мазков. На одном предметном стекле помещают две капельки спермы. Рядом с одной капелькой помещают капельку 1%-ного раствора молочной кислоты и обе капельки накрывают покровным стеклышком. На другую капельку спермы наносят такую же капельку кислоты и обе капли смешивают стеклянной палочкой. При помощи универсального индикатора определяют рН смеси: оранжевая или желто-оранжевая окраска капли свидетельствует о том, что рН ниже 6,0. После этого просматривают под микроскопом мазок на границе раствора кислоты и спермы и наблюдают за гибелью сперматозоидов после попадания их в раствор кислоты.
На другое предметное стекло также наносят две капли спермы. Рядом с одной помещают капельку подкисленного физиологического раствора (к 10 мл 1%-ного раствора натрия хлорида приливают 2 мл 1%-ного раствора молочной кислоты) и обе капли накрывают покровным стеклом. На другую капельку спермы наносят каплю подкисленного физиологического раствора и обе капельки смешивают. При помощи индикатора определяют рН смеси – показатель рН около 6,0. Мазок исследуют под микроскопом сначала при температуре 20–25°С, а затем – на обогревательном столике при 38°С. При комнатной температуре сперматозоиды будут неподвижны, но после подогревания некоторые из них могут возобновлять движения.
На третье предметное стекло также наносят две капли спермы. Рядом с ними помещают по капельке подкисленного физиологического раствора и по 1–2 капельки натрия цитрата. Первые три (четыре) капельки смешивают, накрывают покровным стеклом и исследуют под микроскопом, а другие три (четыре) капельки после смешивания используют для определения рН смеси. После добавления натрия цитрата рН смеси приобретает щелочную реакцию (желто-зеленая или зеленая окраска). Подвижность сперматозоидов в такой смеси может быть достаточно активной.
Изучение действия антисептических растворов. Пункты (лаборатории) по искусственному осеменению нередко расположены вблизи ветеринарных аптек, где могут храниться различные дезинфицирующие вещества. На сперматозоидов они действуют губительно. Это относится и к моющим средствам: даже следы мыла на руках или на посуде проявляют на половые клетки губительное действие.
В процессе занятия целесообразно изучить действие на сперматозоидов ряда дезинфицирующих средств. Из неразбавленной или разбавленной спермы готовят несколько мазков. На одно предметное стекло наносят 2–3 капельки спермы. Рядом с каждой капелькой ее помещают по одной капельке какого-либо раствора: марганцовокислого калия 1:2000, лизола 1%-ного, спирта 70%-ного, йода 5%-ного, мыльной воды (и т.д.) и каждую пару капелек накрывают покровным стеклышком. Все три мазка исследуют под микроскопом и наблюдают за состоянием сперматозоидов на границе раствора и спермы, а также в растворе и в сперме.
ОГЛАВЛЕНИЕ
Тема 4. Получение спермы от производителей …………………………………… 3
4.1. Получение спермы от производителей в искусственную вагину …...…... 4
4.2. Использование других методов для получения спермы
от производителей ……………………………...…………………………… 14
4.3. Получение спермы у самцов птиц ……………………………………..…… 17
Тема 5. Оценка качества спермы …….……………………………………..………… 20
5.1. Обязательные методы оценки качества спермы ……...………………… 21
5.2. Дополнительные методы оценки качества спермы ………………..……. 31
Тема 6. Изучение влияния на сперматозоидов физических
и химических факторов . ……………………………………………………... 44
У ч е б н о - м е т о д и ч е с к о е и з д а н и е
Григорий Федорович Медведев
Николай Иванович Гавриченко
Игорь Анатольевич Долин
БИОТЕХНИКА РАЗМНОЖЕНИЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
Ч а с т ь 2. ПОЛУЧЕНИЕ И ОЦЕНКА КАЧЕСТВА СПЕРМЫ САМЦОВ
СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ И ПТИЦ
Методические указания к лабораторным занятиям
Редактор Т.П. Рябцева
Техн. редактор Н. К. Шапрунова
Корректор А.М. Павлова
ЛИ №348 от 09.06.2004. Подписано в печать 08.08.2008
Формат 60 х 84 1/16. Бумага для множительных аппаратов.
Печать ризографическая. Гарнитура «Таймс».
Усл. печ.л. 3,02. Уч.-изд. л. 2,84. .
Тираж 100 экз. Заказ 273/08. Цена 3940 руб.

Редакционно-издательский отдел БГСХА
213407, г. Горки Могилевской обл., ул. Студенческая, 2
Отпечатано в отделе издания учебно-методической литературы, ризографии
и художественно-оформительской деятельности БГСХА
г. Горки, ул. Мичурина, 5
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА
И ПРОДОВОЛЬСТВИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
 |
ГЛАВНОЕ УПРАВЛЕНИЕ ОБРАЗОВАНИЯ, НАУКИ И КАДРОВ

УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ
«БЕЛОРУССКАЯ ГОСУДАРСТВЕННАЯ
СЕЛЬСКОХОЗЯЙСТВЕННАЯ АКАДЕМИЯ»
 | |||
 | |||
Кафедра физиологии, биотехнологии и ветеринарии
Дата: 2018-11-18, просмотров: 997.