Каждый такой ряд состоит состоит из металла, его основного оксида, основания и любой соли этого же металла:
| МЕТАЛЛ | → | ОСНОВНЫЙ ОКСИД | → | ОСНОВНЫЙ ГИДРОКСИД (ОСНОВАНИЕ) | → | СОЛЬ |
Приведём примеры таких рядов:
| Ряд кальция: | Сa | → | CaO | → | Ca(OH)2 | → | СaCl2; |
| Ряд натрия: | Na | → | Na2O | → | NaOH | → | Na3PO4; |
| Ряд магния: | Mg | → | MgO | → | Mg(OH)2 | → | Mg(NO3)2; |
| Ряд железа: | Fe | → | FeO | → | Fe(OH)2 | → | FeSO4. |
Для перехода от металлов к основным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
2Сa + O2 = 2СaO; 2Mg + O2 = 2MgO;
Переход от основных оксидов к основаниям в первых двух рядах осуществляется путём известной вам реакции гидратации, например:
СaO + H2O = Сa(OH)2.
Что касается последних двух рядов, то содержащиеся в них оксиды MgO и FeO с водой не реагируют. В таких случаях для получения оснований эти оксиды сначала превращают в соли, а уже их – в основания. Поэтому, например, для осуществления перехода от оксида MgO к гидроксиду Mg(OH)2 используют последовательные реакции:
MgO + H2SO4 = MgSO4 + H2O; MgSO4 + 2NaOH = Mg(OH)2↓ + Na2SO4.
Переходы от оснований к солям осуществляются уже известными вам реакциями. Так, растворимые основания (щёлочи), находящиеся в первых двух рядах, превращаются в соли под действием кислот, кислотных оксидов или солей. Нерастворимые основания из последних двух рядов образуют соли под действием кислот.
Генетические ряды неметаллов и их соединений.
Каждый такой ряд состоит состоит из неметалла, кислотного оксида, соответствующей кислоты и соли, содержащей анионы этой кислоты:
| НЕМЕТАЛЛ | → | КИСЛОТНЫЙ ОКСИД | → | КИСЛОТНЫЙ ГИДРОКСИД (КИСЛОТА) | → | СОЛЬ |
Приведём примеры таких рядов:
| Ряд фосфора: | P | → | P2O5 | → | H3PO4 | → | Na3PO4; |
| Ряд углерода: | C | → | CO2 | → | H2CO3 | → | CaCO3; |
| Ряд серы: | S | → | SO2 | → | H2SO3 | → | MgSO3; |
| Ряд кремния: | Si | → | SiO2 | → | H2SiO3 | → | K2SiO3. |
Для перехода от неметаллов к кислотным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
4P + 5O2 = 2 P2O5; Si + O2 = SiO2;
Переход от кислотных оксидов к кислотам в первых трёх рядах осуществляется путём известной вам реакции гидратации, например:
P2O5 + 3H2O = 2 H3PO4.
Однако, вы знаете, что содержащийся в последнем ряду оксид SiO2 с водой не реагирует. В этом случае его сначала превращают в соответствующую соль, из которой затем получают нужную кислоту:
SiO2 + 2KOH = K2SiO3 + H2O; K2SiO3 + 2HСl = 2KCl + H2SiO3↓.
Переходы от кислот к солям могут осуществляться известными вам реакциями с основными оксидами, основаниями или с солями.
Следует запомнить:
· Вещества одного и того же генетического ряда друг с другом не реагируют.
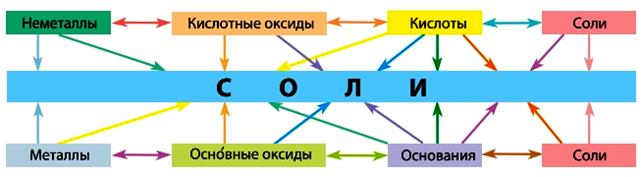
· Вещества генетических рядов разных типов реагируют друг с другом. Продуктами таких реакций всегда являются соли (рис. 5):
Рис. 5. Схема взаимосвязи веществ разных генетических рядов.
Эта схема отображает взаимосвязь между различными классами неорганических соединений и объясняет многообразие химических реакций между ними.
Задание по теме:
Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
1. Na → Na2O → NaOH → Na2CO3 → Na2SO4 → NaOH;
2. P → P2O5 → H3PO4 → K3PO4 → Ca3(PO4)2 → CaSO4;
3. Ca → CaO → Ca(OH)2 → CaCl2 → CaCO3 → CaO;
4. S → SO2 → H2SO3 → K2SO3 → H2SO3 → BaSO3;
5. Zn → ZnO → ZnCl2 → Zn(OH)2 → ZnSO4 → Zn(OH)2;
6. C → CO2 → H2CO3 → K2CO3 → H2CO3 → CaCO3;
7. Al → Al2(SO4)3 → Al(OH)3 → Al2O3 → AlCl3;
8. Fe → FeCl2 →FeSO4 → Fe(OH)2 → FeO → Fe3(PO4)2;
9. Si → SiO2 → H2SiO3 → Na2SiO3 → H2SiO3 → SiO2;
10. Mg → MgCl2 → Mg(OH)2 → MgSO4 → MgCO3 → MgO;
11. K → KOH → K2CO3 → KCl → K2SO4 → KOH;
12. S → SO2 → CaSO3 → H2SO3 → SO2 → Na2SO3;
13. S → H2S → Na2S → H2S → SO2 → K2SO3;
14. Cl2 → HCl → AlCl3 → KCl → HCl → H2CO3 → CaCO3;
15. FeO → Fe(OH)2 → FeSO4 → FeCl2 → Fe(OH)2 → FeO;
16. CO2 → K2CO3 → CaCO3 → CO2 → BaCO3 → H2CO3;
17. K2O → K2SO4 → KOH → KCl → K2SO4 → KNO3;
18. P2O5 → H3PO4 → Na3PO4 → Ca3(PO4)2 → H3PO4 → H2SO3;
19. Al2O3 → AlCl3 → Al(OH)3 → Al(NO3)3 → Al2(SO4)3 → AlCl3;
20. SO3 → H2SO4 → FeSO4 → Na2SO4 → NaCl → HCl;
21. KOH → KCl → K2SO4 → KOH → Zn(OH)2 → ZnO;
22. Fe(OH)2 → FeCl2 → Fe(OH)2 → FeSO4 → Fe(NO3)2 → Fe;
23. Mg(OH)2 → MgO → Mg(NO3)2 → MgSO4 → Mg(OH)2 → MgCl2;
24. Al(OH)3 → Al2O3 → Al(NO3)3 → Al2(SO4)3 → AlCl3 → Al(OH)3;
25. H2SO4 → MgSO4 → Na2SO4 → NaOH → NaNO3 → HNO3;
26. HNO3 → Ca(NO3)2 → CaCO3 → CaCl2 → HCl → AlCl3;
27. CuСO3 → Cu(NO3)2 → Cu(OH)2 → CuO → CuSO4 → Cu;
28. MgSO4 → MgCl2 → Mg(OH)2 → MgO → Mg(NO3)2 → MgCO3;
29. K2S → H2S → Na2S → H2S → SO2 → K2SO3;
30. ZnSO4 → Zn(OH)2 → ZnCl2 → HCl → AlCl3 → Al(OH)3;
31. Na2CO3 → Na2SO4 → NaOH → Cu(OH)2 → H2O → HNO3;
32. Al2(SO4)3 → Al(OH)3 → AlCl3 → NaCl → HCl → H2;
33. MgCl2 → Mg(OH)2 → H2O → H2SO4 → FeSO4 → Fe(OH)2;
34. Cu(OH)2 → CuO → CuSO4 → ZnSO4 → Na2SO4 → NaOH;
35. Fe → FeCl2 → HCl → H2O → NaOH → Na2CO3 → NaCl;
36. Al(OH)3 → H2O → H2SO3 → CaSO3 → CaO → Ca(OH)2;
37. KOH → Zn(OH)2 → Zn(NO3)2 → HNO3 → Fe(NO3)3 → Fe(OH)3;
38. Fe(NO3)2 → Fe(OH)2 → FeSO4 → FeCl2 → Fe(OH)2 → H2O;
39. H2S → SO2 → Na2SO3 → BaSO3 → BaCl2 → HCl;
40. CH4 → CO2 → Na2CO3 → BaCO3 → Ba(NO3)2 → BaSO4;
41. FeCl2 → Fe → Cu → CuO → CuCl2 → CuSO4 → Cu;
42. Zn → ZnO → Zn(NO3)2 → Zn(OH)2 → H2O → KOH;
43. CO2 → CaCO3 → H2CO3 → CO2 → K2CO3 → K2SO4;
44. MgSO4 → MgCl2 → Mg(OH)2 → MgO → Mg3(PO4)2;
45. K2O → KOH → Cu(OH)2 → CuSO4 → K2SO4 → KOH;
46. H2SO4 → Na2SO4 → NaOH → NaCl → Na2SO4 → NaCl;
47. Fe(OH)3 → H2O → H3PO4 → K3PO4 → Zn3(PO4)2 → ZnSO4;
48. H2S → SO2 → Na2SO3 → CaSO3 → Ca(OH)2 → Ca(NO3)2;
49. Na2SO4 → NaOH → Fe(OH)3 → H2O → HNO3 → Al(NO3)3;
50. Cu(OH)2 → H2O → H3PO4 → K3PO4 → K2SO4 → KOH.
[1] Относящийся к щелочам гидроксид кальция Сa(OH)2 мало растворим в воде.
Дата: 2016-10-02, просмотров: 286.