Тема 1. «Основные понятия и законы химии»
Изучаемый материал: Атом. Атомная единица массы. Химический элемент. Относительная атомная масса элемента. Молекула и относительная молекулярная масса. Вещество. Простые и сложные вещества. Вещества молекулярного и немолекулярного строения. Кристаллические решётки веществ. Химические формулы. Формульная единица вещества. Химическое количество вещества. Моль как единица количества вещества. Молярная масса и молярный объём вещества.
Закон сохранения массы веществ. Закон постоянства состава веществ. Закон кратных отношений. Газовые законы. Закон объёмных отношений Гей-Люссака. Закон Авогадро.
Атом – мельчайшая электронейтральная химически неделимая частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Химический элемент – вид атомных частиц с одинаковым зарядом ядер. Каждый химический элемент имеет своё название и символ. В настоящее время известны 118 химических элементов.
Постоянная атомной массы (mu, u) – физическая величина, численно равная одной двенадцатой массы атома  :
:
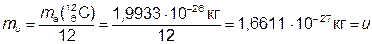 .
.
Раньше эту величину называли «атомная единица массы» (а. е. м) или «углеродная единица» (у. е.). В биологической литературе встречается ещё одно устаревшее название этой величины – «Дальтон» (Dа).
Относительная атомная масса элемента Ar(Э) – величина, равная отношению средней массы атомов данного элемента к mu:
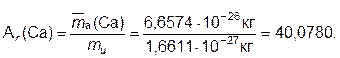
Относительная атомная масса является одной из главных характеристик химического элемента и приводится в таблице Периодической системе под символом элемента. Округленные до целых значения Ar наиболее распространенных химических элементов желательно знать «на память». Они равны 1 (H), 16 (O), 14 (N), 12 (C), 32 (S), 23 (Na), 24 (Mg), 40 (Ca), 27 Fl), 56 (Fe), 35,5 (Cl).
Молекула – мельчайшая, способная к самостоятельному существованию частица, обладающая всеми химическими свойствами и химическим составом данного вещества. В большинстве случаев молекулы состоят из нескольких химически связанных атомов, например, Н2О; C3H8; P4O10; C60. Однако известны и одноатомные молекулы, к которым относятся атомы «благородных газов» – He, Ne, Ar, Kr, Xe, Rn, и атомы ртути Hg, содержащиеся в её парáх. В состав молекул могут входить атомы одного или нескольких химических элементов.
Относительная молекулярная масса (Mr) – величина, равная отношению средней массы молекул или формульных единиц данного вещества к mu.
Например, относительная молекулярная масса воды равна:
Mr(H2O) = 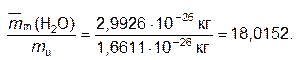
Значение относительной молекулярной массы можно найти, исходя из значений относительных атомных масс, например:
Mr(H2O) = 2 ∙ Ar(H) + Ar(O) = 2 ∙ 1,0079 + 15,9994 = 18,0152.
Округленные до целых значения Mr ряда важнейших веществ молекулярного и немолекулярного строения желательно знать «на память»: H2 (2), O2 (32), N2 (28), Cl2 (71), H2O (18), NH3 (17), NaCl (58,5), CaO (56), MgO (40), NaOH (40), KOH (56), Ca(OH)2 (74), HCl (36,5), HNO3 (63), H2SO4 (98), H3PO4 (98), NaNO3 (85), Na2CO3 (106), CaCO3 (100).
Вещество – устойчивая совокупность частиц (атомов, ионов или молекул), обладающая определёнными химическими и физическими свойствами.
В настоящее время известно около 89 миллионов индивидуальных веществ. Подавляющее большинство из них (~98 %) относятся к органическим веществам, остальные – к неорганическим.
В зависимости от числа химических элементов, образующих вещества, последние делятся на простые и сложные. Простое вещество образовано атомами одного элемента, сложное – атомами разных элементов. Известно около 550 простых веществ, что намного больше числа известных элементов. Причина этого в том, что некоторым элементам соответствуют по несколько простых веществ. Такое явление называется аллотрóпией, а сами простые вещества, образованные атомами одного элемента, – его аллотропными модификациями.
При определенных условиях вещества могут находиться в трёх агрегатных состояниях – газообразном, жидком и твёрдом (аморфном или кристаллическом).
Для описания пространственного строения любого твёрдого кристаллического вещества используется понятие «кристаллическая решётка».
Кристаллическая решётка вещества – пространственная модель его кристалла, представляющая собой условный каркас, в узлах которого находятся молекулы, атомы или ионы, образующие данное вещество.
В зависимости от природы частиц, образующих вещества, различают 4 основных типа кристаллических решёток – молекулярные, атомные, ионные и металлические решётки. Вещества с молекулярным типом кристаллической решётки относятся к веществам молекулярного, а вещества с тремя другими типами решёток – к веществам немолекулярного строения.
Вещества молекулярного строения обладают низкими температурами плавления (обычно до 300 оС). Они летучи и часто обладают запахом. К ним относятся все газообразные или жидкие при комнатной температуре вещества, а также некоторые легкоплавкие твёрдые вещества (ромбическая сера, белый фосфор, иод, парафин, фенол, сахароза и др.).
Вещества немолекулярного строения характеризуются высокими температурами плавления (обычно выше 300 оС). При комнатной температуре они находятся только в твёрдом агрегатном состоянии, практически нелетучи и поэтому не обладают запахом. Атомное строение присуще кристаллам некоторых простых веществ-неметаллов – бора, углерода, кремния, красного фосфора и других. Ионное строение характерно почти для всех соединений щёлочных и щёлочноземельных металлов, магния, а также для всех солей аммония.
Важнейшей характеристикой любого сложного вещества является его качественный и количественный состав, выражающийся с помощью химических формул.
Химическая формула – графическое изображение состава и (или) строения вещества с помощью символов химических элементов и математических знаков (цифр, скобок, штрихов, точек).
Различают несколько типов химических формул.
Стехиометрические формулы (формулы состава) отражают качественный и количественный состав веществ с помощью символов химических элементов, цифр, скобок и точек, например: C6H12O6, (NH4)2CO3, CuSO4∙5H2O. Различают простейшие (эмпирические) и молекулярные стехиометрические формулы, например, СH2O и С6Н12О6.
Структурные формулы (формулы строения) отображают порядок (последовательность) соединения атомов в молекулах или в атомных кристаллах с помощью символов элементов, штрихов и цифр. Различают сокращённые и развёрнутые структурные (графические) формулы.
Формульная единица вещества (ФЕ) – реальная или условная частица вещества, сотав которой определяет его химическую формулу.
К реальным формульным единицам относятся молекулы (в случае веществ молекулярного строения) и атомы (в случае простых веществ атомного строения). Например, формульной единицей воды является её молекула – H2O, формульной единицей кремния – его атом – Si.
К условным формульным единицам относят группы атомов или ионов, входящих в состав сложных веществ немолекулярного строения. Например, формульной единицей сульфата калия K2SO4 является условная частица, состоящая из двух катионов калия и одного сульфат-аниона, т. е. группа ионов состава «K2SO4». Формульной единицей оксида кремния(IV) SiO2 является условная частица, состоящая из одного атома кремния и двух атомов кислорода, т. е. группа атомов состава «SiO2».
Химическое количество вещества n(X) – величина, равная отношению числа ФЕ данного вещества Х к постоянной Авогадро:
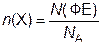 .
.
Числовое значение n показывает, во сколько раз число ФЕ вещества в данной его порции больше числа Авогадро. Единица химического количества вещества – моль. Установлено, что любое вещество химическим количеством 1 моль всегда содержит 6,02∙1023 его ФЕ. Число 6,02∙1023 называется числом Авогадро. Это число, отнесённое к количеству вещества, равному 1 моль, называется постоянной Авогадро и обозначается символом NA:
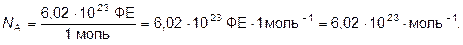
Обратите внимание на различие понятий «моль» и «1 моль». Моль – единица химического количества вещества, но 1 моль – порция вещества, содержащая 6,02∙1023 его формульных единиц.
Важнейшей количественной характеристикой любого сложного вещества является его количественный состав, который отображает массовое либо мольное соотношение атомов элементов, входящих в его состав.
Массовое соотношение элементов в веществе выражается через их массовые доли.
Массовая доля элемента в веществе (w) – величина, показывающая, какую часть от общей массы всего вещества составляет масса атомов данного элемента. Массовая доля элемента А в сложном веществе AxBy рассчитывается по формуле:
w(А) = 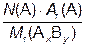 ,
,
где N(A)– число атомов элемента А в молекуле вещества АxBy; Ar(A) – относительная атомная масса элемента A; Mr(AxBy) – относительная молекулярная масса вещества АxBy.
Мольное соотношение атомов определяет простейшую химическую формулу данного вещества. Это соотношение получают исходя из значений массовых долей атомов разных элементов, образующих вещество.
Молярная масса вещества (М) – физическая величина, равная отношению массы данного вещества Х к его химическому количеству:
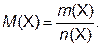
Единицы молярной массы – г/моль.
Физический смысл молярной массы: она численно равна массе вещества, взятого в количестве 1 моль.
Числовые значения молярных масс всех сложных веществ и простых веществ молекулярного строения совпадают с соответствующими числовыми значениями относительных молекулярных масс, например:
Мr(Н2О) = 18,015 и М(Н2О) = 18,015 г/моль;
Mr(CuSO4 ∙ 5H2O) = 249,681 и M(CuSO4 ∙ 5H2O) = 249,681 г/моль.
Значения молярных масс простых веществ немолекулярного строения численно равны соответствующим значениям относительных атомных масс, например: Ar(Si) = 28,085 и М(Si) = 28,085 г/моль.
Молярный объём вещества Vm – физическая величина, численно равная отношению объёма данного вещества Х к его химическому количеству:
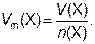
Единицы молярного объёма – см3/моль; дм3/моль; м3/моль. Например,
Vm (CO2)(н.у.) = 22,392 дм3/моль; Vm(Fe) = 7,086 см3/моль.
Закон сохранения массы веществ: «Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ с учётом изменения массы, соответствующего тепловому эффекту данной реакции».
В общем виде математическое выражение этого закона для химической реакции aA + bB = cC + dD 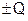 имеет вид:
имеет вид:
[m(A) + m(B)] = [m(C) + m(D)] 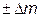 ,
,
где 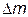 – изменение массы за счёт выделения или поглощения теплоты (энергии), происходящее в соответствии с уравнением А. Эйнштейна:
– изменение массы за счёт выделения или поглощения теплоты (энергии), происходящее в соответствии с уравнением А. Эйнштейна: 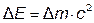 , где
, где 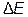 – изменение энергии (в данном случае – тепловой эффект реакции),
– изменение энергии (в данном случае – тепловой эффект реакции), 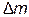 – изменение массы, с – скорость света в вакууме, равная 3∙108 м ∙ с-1. Поскольку тепловые эффекты химических реакций (
– изменение массы, с – скорость света в вакууме, равная 3∙108 м ∙ с-1. Поскольку тепловые эффекты химических реакций ( 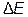 ) чрезвычайно малы по сравнению с величиной с2, то соответствующими значениями
) чрезвычайно малы по сравнению с величиной с2, то соответствующими значениями 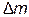 (10–9–10–11 г) можно пренебрегать из-за невозможности их практического определения.
(10–9–10–11 г) можно пренебрегать из-за невозможности их практического определения.
Закон постоянства состава веществ: «Количественный и качественный состав любого сложного вещества молекулярного строения не зависит от способов его получения».
Обратите внимание: данный закон применим для веществ только молекулярного строения. Например, количественный состав воды, независимо от способов её получения, всегда один и тот же: w(H) = 11,1899 %, w(O) = 88,8101 %. Поэтому молекулярная формула воды, выведенная исходя из указанных значений массовых долей элементов всегда одна и та же – Н2,000О1,000, или просто H2O.
Экспериментально доказано, что количественный состав веществ немолекулярного строения зависит от способов их получения. Так, например, в образцах оксида меди(II), полученных разными способами, значения массовой доли меди могут изменяться от 74,6 % до 80,7 %. Поэтому количественный состав оксида меди(II) выражается формулами от Cu0,739O до СuO1,053. Однако часто формулу этого вещества записывают упрощённо в виде CuO, округляя соответствующие индексы до целых чисел.
Закон объёмных отношений газов Гей-Люссака: «Объёмы газов, вступающих в химическую реакцию и образующихся в результате реакции, относятся между собой как небольшие целые числа».
Закон Авогадро: «В равных объёмах различных газов при одинаковых внешних условиях (давление и температура) содержатся одинаковые числа молекул».
Этот закон применим для веществ, находящихся только в газообразном состоянии.
Из молекулярно-кинетической теории газов следует, что при одинаковых внешних условиях расстояния между частицами в сотни раз больше размеров самих частиц. Поэтому объем порции любого газа определяется не размером его молекул, а расстоянием между ними. Именно по этой причине в равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул.
Следствия из закона Авогадро:
НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ»
Изучаемый материал: Простые и сложные вещества. Явление аллотропии. Аллотропные модификации. Классификация сложных неорганических веществ. Важнейшие классы неорганических соединений. Оксиды: состав, классификация, номенклатура, свойства и получение. Гидроксиды и их классификация. Основания: состав, классификация, номенклатура, свойства и получение. Кислоты: состав, классификация, номенклатура, свойства и получение. Соли: состав, классификация, номенклатура, свойства и получение
Генетическая связь важнейших классов неорганических соединений.
В зависимости от числа элементов, атомы которых входят в состав веществ, все они делятся на простые и сложные вещества.
Простыми называются вещества, состоящие из атомов одного элемента, например: О2, Al, P4, Si, C60, Au, I2. Названия простых веществ, как правило, совпадают с названиями соответствующих химических элементов, например: литий, бор, сера. Исключение составляют углерод (простые вещества которого имеют названия – «алмаз», «графит», «карбин», «фуллерены») и кислород, одно из простых веществ которого имеет название озон.
Сложными называются вещества, в состав которых входят атомы двух и большего числа элементов, например: H2O, NaCl, HNO3, Ca3(PO4)2, Cu(OH)2.
В зависимости от состава и химических свойств, все сложные неорганические вещества подразделяются на классы, важнейшими из которых являются оксиды, кислоты, основания и соли. Общая схема классификации неорганических веществ представлена на рис. 1.
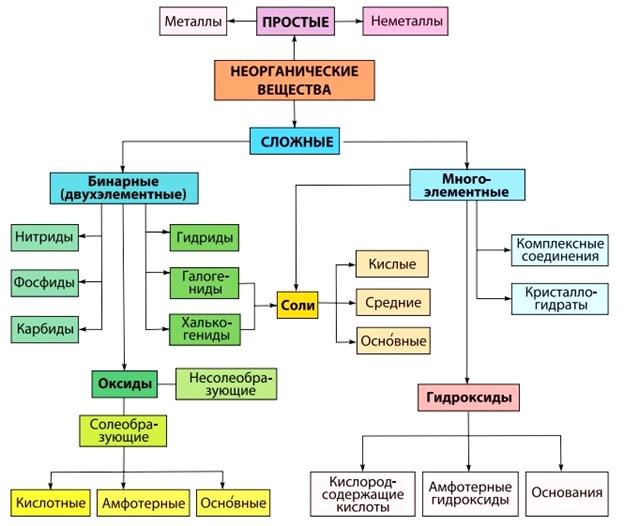 |
Рис. 1. Схема классификации неорганических веществ
О к с и д ы
Номенклатура оксидов
Названия оксидов состоят из двух слов: первое слово «оксид» – производное от латинского названия кислорода (оксигениум), а второе – русское название элемента в родительном падеже. Если элемент образует несколько оксидов, то после названия элемента римской цифрой в скобках указывается его степень окисления. Примеры: Na2O – оксид натрия, CaO – оксид кальция, Al2O3 – оксид алюминия, FeO – оксид железа(II), Cr2O3 – оксид хрома(III), N2O5 – оксид азота(V).
Если в оксиде степень окисления атомов элемента чётная, то в названии этого оксида число атомов кислорода может быть указано греческими названиями чисел: 1 – моно, 2 – ди, 3 – три, 4 – тетра, которые вводятся в виде префикса к слову «оксид». При этом степень окисления элемента не указывается. Примеры: СО – монооксид углерода, СО2 – диоксид углерода, SO3 – триоксид серы, RuO4 – тетраоксид рутения.
Кислотные оксиды часто называются ангидридами соответствующих кислот: SO3 – серный ангидрид, SO2 – сернистый ангидрид, P2O5 – фосфорный ангидрид, N2O3 – азотистый ангидрид, N2O5 – азотный ангидрид. Слово «ангидрид» переводится как «безводный», следовательно, подобное название оксида SO3 дословно означает «безводная серная кислота», P2O5 – «безводная фосфорная кислота» и т. д.
Свойства оксидов
Физические свойства оксидов разнообразны. Одни из них – газообразные вещества (SO2, SO3, CO2, NO), другие – жидкости (N2O4, Mn2O7), третьи – твёрдые (CaO, SiО2, P2O5).
Химические свойства оксидов определяются их взаимодействием с водой и другими оксидами, кислотами, щелочами.
О с н о в н ы е о к с и д ы
а) В з а и м о д е й с т в и е с в о д о й.
Оснόвные оксиды Li2O, Na2O, K2O, CaO, BaO реагируют с водой согласно общей схемы:
| ОСНОВНЫЙ ОКСИД | + | ВОДА | = | ОСНОВАНИЕ |
При написании уравнений таких реакций следует помнить, что степень окисления металла в образующемся основании равна его степени окисления в исходном оксиде.
Примеры:
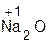 + H2O = 2
+ H2O = 2 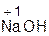 ;
; 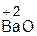 + H2O =
+ H2O = 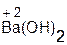 .
.
оксид вода гидроксид оксид вода гидроксид
натрия натрия бария бария
Основные оксиды, образованные такими металлами, как Cu, Fe, Cr, с водой не реагируют. Соответствующие им основания получают другими способами.
б) В з а и м о д е й с т в и е с к и с л о т а м и.
Практически все основные оксиды реагируют с кислотами с образованием солей по общей схеме:
| ОСНОВНЫЙ ОКСИД | + | кислота | = | СОЛЬ | + | ВОДА |
Следует помнить, что в образующейся соли валентность металла такая же, как в исходном оксиде, а валентность кислотного остатка такая же, как в исходной кислоте.
Примеры:
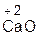 + 2
+ 2 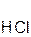 =
= 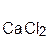 + H2O;
+ H2O; 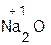 +
+ 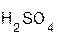 =
= 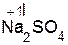 + H2O;
+ H2O;
оксид хлорово- хлорид вода оксид серная сульфат вода
кальция дородная кальция натрия кислота натрия
кислота
в) В з а и м о д е й с т в и е с к и с л о т н ы м и о к с и д а м и
Основные оксиды реагируют с кислотными оксидами с образованием солей согласно общей схемы:
| ОСНОВНЫЙ ОКСИД | + | КИСЛОТНЫЙ ОКСИД | = | СОЛЬ |
В образующейся соли степень окисления металла такая же, как и в исходном основном оксиде. Кроме того, следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид N2O5, которому соответствует кислота HNO3(указана в скобках), то в состав соли будет входить остаток этой кислоты, т. е. NO3. Его заряд, как вы уже знаете, равен 1–:
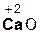 +
+ 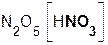 =
= 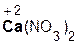 .
.
оксид оксид нитрат
кальция азота(V) кальция
Если же в реакцию вступает кислотный оксид Р2О5, которому соответствует кислота Н3РО4 (указана в скобках), то в составе образующейся соли будет остаток этой кислоты, т. е. РO4 с с зарядом, равным 3–:
3 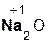 +
+ 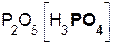 = 2
= 2 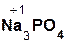 .
.
оксид оксид фосфат
натрия фосфора(V) натрия
К и с л о т н ы е о к с и д ы
а)В з а и м о д е й с т в и е с в о д о й
Кислотные оксиды, кроме оксида кремния SiO2, реагируют с водой согласно общей схемы:
| кислотный ОКСИД | + | ВОДА | = | КИСЛОРОДСОДЕРЖАЩАЯ КИСЛОТА |
Например:
SO3 + H2O = H2SO4; CO2 + H2O = H2CO3
оксид вода серная оксид вода угольная
серы(VI) кислота углерода(IV) кислота
P2O5 + 3H2O = 2H3PO4; N2O5 + H2O = 2HNO3;
оксид вода фосфорная оксид вода азотная
фосфора(V) кислота азота(V) кислота
Таким образом, каждому кислотному оксиду соответствует кислородсодержащая кислота. Несмотря на то, что оксид кремния SiO2 с водой не реагирует, ему тоже соответствует кислота H2SiO3, но её получают другими способами.
б)В з а и м о д е й с т в и е со щ ё л о ч а м и
Все кислотные оксиды реагируют с щёлочами согласно общей схемы:
| КИСЛОТНЫЙ ОКСИД | + | ЩЁЛОЧЬ | = | СОЛЬ | + | ВОДА |
В образующейся соли степень окисления металла такая же, как и в исходной щёлочи. Кроме того, в состав соли входит остаток той кислоты, которая соответствует данному кислотному оксиду. Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3(указана в скобках), то в состав соли будет входить остаток этой кислоты, т. е. CO3, заряд которого равен 2–:
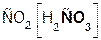 +
+ 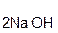 =
= 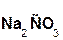 + H2O.
+ H2O.
оксид гидроксид карбонат вода
углерода(IV) натрия натрия
Если же в реакцию вступает кислотный оксид N2О5, которому соответствует кислота HNO3 (указана в скобках), то в составе образующейся соли будет остаток этой кислоты, т. е. NO3 с зарядом, равным 1–:
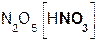 +
+ 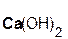 =
= 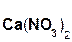 + H2O.
+ H2O.
оксид гидроксид нитрат вода
азата(V) кальция кальция
в) Р е а к ц и и с о с н о в н ы м и о к с и д а м и
Основные оксиды реагируют с кислотными оксидами с образованием солей согласно общей схемы:
| КИСЛОТНЫЙ ОКСИД | + | ОСНОВНЫЙ ОКСИД | = | СОЛЬ |
В образующейся соли степень окисления металла такая же, как и в исходном основном оксиде. Кроме того, следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид SO3, которому соответствует кислота H2SO4(указана в скобках), то в состав соли будет входить остаток этой кислоты, т. е. SO4:
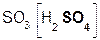 +
+ 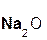 =
= 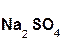 .
.
оксид оксид сульфат
серы(VI) натрия натрия
Если же в реакцию вступает кислотный оксид Р2О5, которому соответствует кислота Н3РО4 (указана в скобках), то в составе образующейся соли будет остаток этой кислоты, т. е. РO4:
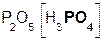 + 3
+ 3 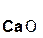 =
= 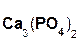 .
.
оксид оксид фосфат
фосфора(V) кальция кальция
Получение оксидов
Для получения оксидов используют различные способы:
1. Взаимодействие простых веществ с кислородом:
С + O2 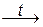 СO2; S + O2
СO2; S + O2 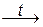 SO2; 4Al + 3O2
SO2; 4Al + 3O2 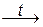 2Al2O3.
2Al2O3.
2. Взаимодействие сложных веществ с кислородом:
2H2S + 3O2 = 2SO2 + 2H2O; СН4 + 2О2 = СО2 + 2Н2О.
3. Термическое разложение малорастворимых оснований. При этом образуется основный или амфотерный оксид и вода:
Mg(OH)2 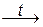 MgO + H2O; 2Al(OH)3
MgO + H2O; 2Al(OH)3 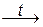 Al2O3 + 3H2O.
Al2O3 + 3H2O.
4. Термическое разложение некоторых кислот. При этом образуются кислотный оксид и вода:
H2CO3 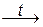 CO2 + H2O; H2SiO3
CO2 + H2O; H2SiO3 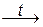 SiO2 + H2O; H2SO3
SiO2 + H2O; H2SO3 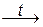 SO2 + H2O.
SO2 + H2O.
5. Термическое разложение некоторых солей, например, карбонатов или сульфитов двухвалентных металлов. При этом образуются по два оксида – основный или амфотерный и кислотный:
CaCO3 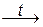 CaO + CO2; ZnCO3
CaO + CO2; ZnCO3 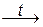 ZnO + CO2.
ZnO + CO2.
6. Действие водоотнимающих веществ (фосфорный ангидрид, концентрированная серная кислота) на некоторые кислородсодержащие кислоты:
2HNO3 + P2O5 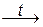 N2O5 + 2HPO3; H2SO4 + P2O5
N2O5 + 2HPO3; H2SO4 + P2O5 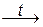 SO3 + 2HPO3.
SO3 + 2HPO3.
Некоторые оксиды являются природными соединениями (минералами): H2O – вода, SiO2 – кварц, Al2O3 – корунд, Fe2O3 – гематит, MnO2 – пиролюзит, TiO2 – рутил, SnO2 – касситерит и др.
Г и д р о к с и д ы
Некоторые основные и почти все кислотные оксиды соединяются с водой, образуя соответствующие основания и кислородсодержащие кислоты. Однако воду присоединяют не только оксиды, но и многие другие вещества. Поскольку реакций присоединения воды известно много, им было дано общее название – реакции гидратации. Слово «гидратация» происходит от греческого «hydor», обозначающего воду. Вещества, которые получаются в результате реакций гидратации, получили название гидраты. Например, спирт, присоединяя воду, образует гидрат спирта, а сахар – гидрат сахара. Соответственно, если воду присоединяет оксид, то получается гидрат оксида или сокращённо «гидроксид»:
| ОКСИД | + | вода | = | ГИДРАТ ОКСИДА или ГИДРОКСИД |
Поскольку оксиды, вступающие в эту реакцию, делятся на основные и кислотные, то и образующиеся из них гидроксиды также делятся на основные и кислотные. Основные гидроксиды – это основания, а кислотные гидроксиды – это кислородсодержаще кислоты.
Запомните:
· В результате гидратации оснόвного оксида образуется оснόвный гидроксид, являющийся основанием:
| оснόвный ОКСИД | + | вода | = | ОСНОВНЫЙ ГИДРОКСИД (ОСНОВАНИЕ) |
| Na2O | + | H2O | = | 2NaOH | |
| оксид | вода | гидроксид | (ОСНОВАНИЕ) | ||
| натрия | натрия |
Пример:
· В результате гидратации кислотного оксида образуется кислотный гидроксид, являющийся кислородсодержащей кислотой:
| КИСЛОТНЫЙ ОКСИД | + | вода | = | КИСЛОТНЫЙ ГИДРОКСИД (КИСЛОРОДСОДЕРЖ. КИСЛОТА) |
| СO2 | + | H2O | = | H2СO3 | |
| оксид | вода | гидроксид | (КИСЛОРОДСОДЕРЖ. КИСЛОТА) | ||
| углерода(IV) | углерода(IV) |
Пример:
Таким образом, основания и кислородсодержащие кислоты являются гидроксидами, т. е. гидратами соответствующих оксидов:
NaOH – гидрат оксида натрия или гидроксид натрия – основание;
H2СO3 – гидрат оксида углерода(IV) или гидроксид углерода(IV) – кислородсодержащая (угольная) кислота.
Формулы важнейших оксидов, соответствующих им гидроксидов и их названия приведены в следующей таблице:
| Элементы | Оксиды | Гидроксиды | |
| Элементы-металлы | Основные оксиды | Основные гидроксиды (основания) | |
| Na | Na2O | NaOH | гидроксид натрия |
| K | K2O | KOH | гидроксид калия |
| Ca | CaO | Ca(OH)2 | гидроксид кальция |
| Ba | BaO | Ba(OH)2 | гидроксид бария |
| Fe | FeO | Fe(OH)2 | гидроксид железа(II) |
| Cu | CuO | Cu(OH)2 | гидроксид меди(II) |
| Элементы-неметаллы | Кислотные оксиды | Кислотные гидроксиды (кислоты) | |
| C | CO2 | H2CO3 | гидроксид углерода(IV), угольная кислота |
| Si | SiO2 | H2SiO3 | гидроксид кремния(IV), кремниевая кислота |
| N | N2O5 | HNO3 | гидроксид азота(V), азотная кислота |
| P | P2O5 | H3PO4 | гидроксид фосфора(V), фосфорная кислота |
| S | SO3 | H2SO4 | гидроксид серы(VI), серная кислота |
| Cl | Cl2O7 | HClO4 | гидроксид хлора(VII), хлорная кислота |
К и с л о т ы
Свойства кислот
Физические свойства
Некоторые кислоты существуют в виде индивидуальных веществ. Они представляют собой бесцветные жидкости (H2SO4, HNO3, HСlO4) или белые твёрдые вещества (H3PO4, H3BO3, H2SiO3).
Жидкие кислоты различаются по вязкости и летучести. Кислоты с высокой вязкостью («маслянистые жидкости») – обычно нелетучи, не обладают запахом. К ним относится, например, серная кислота. Кислоты с низкой вязкостью, как правило, летучи и обладают резким «кислотным» запахом. Это, например, азотная и уксусная кислоты.
Твёрдые неорганические кислоты (обычно нелетучи и не обладают запахом.
К другой группе относятся кислоты, представляющие собой водные растворы галогеноводородов (HF, HCl, HBr, HI) или халькогеноводородов (H2S, H2Se, H2Te). Такие кислоты представляют собой бесцветные жидкости с характерным запахом.
Химические свойства
В водных растворах кислоты проявляют ряд схожих химических свойств, называемых кислотными свойствами:
а) Э л е к т р о л и т и ч е с к а я д и с с о ц и а ц и я и и з м е н е н и е о к р а с к и и н д и к а т о р о в
По способности диссоциировать в водных растворах на ионы неорганические кислоты делятся на две группы:
· Сильные кислоты – HСlO4, HBrO4, HMnO4, H2SO4, H2SeO4, HNO3, HClO3, HBrO3, HIO3. В водных растворах они диссоциируют практически полностью и необратимо:
HСlO4 → H+ + СlO4–; H2SO4 → 2H+ + SO42–.
· Слабые кислоты – HClO, HBrO, HIO, HClO2, H2SO3, H2СO3, H2SiO3, H3PO4, H3BO3. В водных растворах они диссоциируют частично и обратимо. При этом диссоциация многоосновных кислот протекает ступенчато, например:
H3PO4 ↔ H+ + H2PO4–; H2PO4– ↔ H+ + HPO42–; HPO42– ↔ H+ + PO43–;
Поскольку в водных растворах всех кислот содержатся ионы водорода H+, они изменяют окраску индикаторов: лакмуса – с фиолетового на красный; метилоранжа – с оранжевого на красный; бесцветный фенолфталеин в присутствии кислот не изменяет свою окраску.
б) В з а и м о д е й с т в и е с м е т а л л а м и
В водных растворах многие кислоты реагируют с металлами, расположенными в ряду активности левее Н2 (например, Mg, Al, Zn, Fe). В результате этих реакций образуются сложные вещества – соли и выделяется газообразное простое вещество – водород:
| кислота | + | металл | = | СОЛЬ | + | ВОдород |
В такие реакции вступают как бескислородные (HCl, HBr), так и кислородсодержащие (H2SO4, H3PO4) кислоты, например:
2HCl + Zn = ZnCl2 + H2↑; H2SO4 + Mg = MgSO4 + H2↑;
хлорово- цинк хлорид водород серная магний сульфат водород
дородная цинка кислота магния
кислота
6HBr + 2Al = 2AlBrl3 + 3H2↑; H2SO4 + Fe = FeSO4 + H2↑.
бромо- алюми- бромид водород серная железо сульфат водород
дородная ний алюминия кислота железа(II)
кислота
Реакции этого типа относятся к реакциям замещения: атомы металлов замещают (вытесняют) атомы водорода из молекул кислот.
Следует помнить, что металлы, расположенные в ряду активности правее Н2 (Сu, Ag, Hg и др.) с указанными кислотами в водных растворах не реагируют.
в) Р е а к ц и и с о с н о в н ы м и о к с и д а м и
Кислоты реагируют с основными оксидами, образуя соли и воду:
| кислота | + | ОСНОВНЫЙ ОКСИД | = | СОЛЬ | + | ВОДА |
Следует помнить, что в образующейся соли степень окисления металла такая же, как в исходном оксиде. Примеры реакций:
2 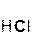 +
+  =
= 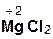 + H2O;
+ H2O;
хлорово- оксид хлорид вода
дородная магния магния
кислота
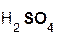 +
+ 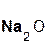 =
= 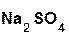 + H2O;
+ H2O;
серная оксид сульфат вода.
кислота натрия натрия
Эти реакции относятся к реакциям обмена, поскольку в процессе взаимодействия исходные сложные вещества обмениваются своими составными частями.
г) В з а и м о д е й с т в и е с о с н о в а н и я м и
Кислоты реагируют с основаниями по общей схеме:
| кислота | + | ОСНОВание | = | СОЛЬ | + | ВОДА |
Кислоты реагируют как с нерастворимыми, так и с растворимыми основаниями, например:
2
Дата: 2016-10-02, просмотров: 304.