НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ»
Изучаемый материал: Простые и сложные вещества. Явление аллотропии. Аллотропные модификации. Классификация сложных неорганических веществ. Важнейшие классы неорганических соединений. Оксиды: состав, классификация, номенклатура, свойства и получение. Гидроксиды и их классификация. Основания: состав, классификация, номенклатура, свойства и получение. Кислоты: состав, классификация, номенклатура, свойства и получение. Соли: состав, классификация, номенклатура, свойства и получение
Генетическая связь важнейших классов неорганических соединений.
В зависимости от числа элементов, атомы которых входят в состав веществ, все они делятся на простые и сложные вещества.
Простыми называются вещества, состоящие из атомов одного элемента, например: О2, Al, P4, Si, C60, Au, I2. Названия простых веществ, как правило, совпадают с названиями соответствующих химических элементов, например: литий, бор, сера. Исключение составляют углерод (простые вещества которого имеют названия – «алмаз», «графит», «карбин», «фуллерены») и кислород, одно из простых веществ которого имеет название озон.
Сложными называются вещества, в состав которых входят атомы двух и большего числа элементов, например: H2O, NaCl, HNO3, Ca3(PO4)2, Cu(OH)2.
В зависимости от состава и химических свойств, все сложные неорганические вещества подразделяются на классы, важнейшими из которых являются оксиды, кислоты, основания и соли. Общая схема классификации неорганических веществ представлена на рис. 1.
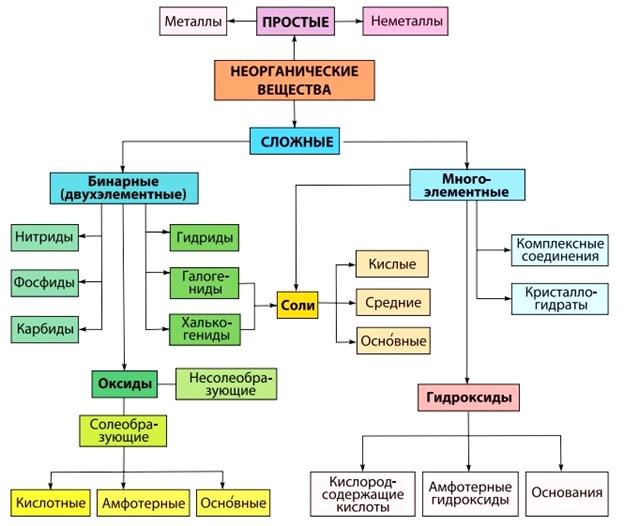 |
Рис. 1. Схема классификации неорганических веществ
О к с и д ы
Определение и классификация оксидов
Оксиды – сложные вещества, состоящие из атомов двух элементов, один из которых – кислород в степени окисления –2, например:
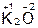 ,
, 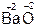 ,
, 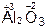 ,
, 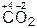 ,
, 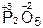 ,
, 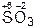 ,
, 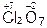 ,
, 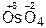 .
.
В зависимости от кислотно-основных свойств, все оксиды подразделяются на три большие группы – оснóвные, кислотные и амфотерные оксиды.
Оснóвными называются оксиды, которым соответствуют основные гидроксиды – основания.
К основным относятся оксиды металлов в степенях окисления +1, +2 (кроме Zn, Be, Sn, Pb), +3 (кроме Al, Cr, Fe), например:
| Формула основного оксида | Формула соответствующего основания |
| Li2O | LiOH |
| Na2O | NaOH |
| K2O | KOH |
| MgO | Mg(OH)2 |
| CaO | Ca(OH)2 |
| BaO | Ba(OH)2 |
| FeO | Fe(OH)2 |
| MnO | Mn(OH)2 |
| La2O3 | La(OH)3 |
Кислотными являются оксиды, которым соответствуют кислотные гидроксиды – кислородсодержащие кислоты.
К кислотным относятся оксиды неметаллов (кроме СО, NO и N2O), а также оксиды металлов – d-элементов, атомы которых находятся в высоких степенях окисления +5, +6 и +7, например:
| Формула кислотного оксида | Формула соответствующей кислоты |
| Cl2O | HClO |
| N2O3 | HNO2 |
| N2O5 | HNO3 |
| SO2 | H2SO3 |
| SO3 | H2SO4 |
| P2O5 | H3PO4 |
| Cl2O7 | HClO4 |
| CrO3 | H2CrO4 |
| Mn2O7 | HMnO4 |
Амфотерными называются оксиды, которым соответствуют амфотерные гидроксиды. К таким оксидам относятся оксиды ряда металлов, например:
| Формула амфотерного оксида | Формула амфотерного гидроксида |
| ZnO | Zn(OH)2 |
| BeO | Be(OH)2 |
| SnO | Sn(OH)2 |
| PbO | Pb(OH)2 |
| Al2O3 | Al(OH)3 |
| Cr2O3 | Cr(OH)3 |
Оснóвные, кислотные и амфотерные оксиды вступают в различные реакции солеобразования, поэтому их называют солеобразующими. Почти все известные оксиды – солеобразующие. Исключением являются оксиды CO, SiO, NO, N2O, у которых нет соответствующих гидроксидов. Эти оксиды не вступают в реакции солеобразования и поэтому называются несолеобразующими.
Номенклатура оксидов
Названия оксидов состоят из двух слов: первое слово «оксид» – производное от латинского названия кислорода (оксигениум), а второе – русское название элемента в родительном падеже. Если элемент образует несколько оксидов, то после названия элемента римской цифрой в скобках указывается его степень окисления. Примеры: Na2O – оксид натрия, CaO – оксид кальция, Al2O3 – оксид алюминия, FeO – оксид железа(II), Cr2O3 – оксид хрома(III), N2O5 – оксид азота(V).
Если в оксиде степень окисления атомов элемента чётная, то в названии этого оксида число атомов кислорода может быть указано греческими названиями чисел: 1 – моно, 2 – ди, 3 – три, 4 – тетра, которые вводятся в виде префикса к слову «оксид». При этом степень окисления элемента не указывается. Примеры: СО – монооксид углерода, СО2 – диоксид углерода, SO3 – триоксид серы, RuO4 – тетраоксид рутения.
Кислотные оксиды часто называются ангидридами соответствующих кислот: SO3 – серный ангидрид, SO2 – сернистый ангидрид, P2O5 – фосфорный ангидрид, N2O3 – азотистый ангидрид, N2O5 – азотный ангидрид. Слово «ангидрид» переводится как «безводный», следовательно, подобное название оксида SO3 дословно означает «безводная серная кислота», P2O5 – «безводная фосфорная кислота» и т. д.
Свойства оксидов
Физические свойства оксидов разнообразны. Одни из них – газообразные вещества (SO2, SO3, CO2, NO), другие – жидкости (N2O4, Mn2O7), третьи – твёрдые (CaO, SiО2, P2O5).
Химические свойства оксидов определяются их взаимодействием с водой и другими оксидами, кислотами, щелочами.
О с н о в н ы е о к с и д ы
а) В з а и м о д е й с т в и е с в о д о й.
Оснόвные оксиды Li2O, Na2O, K2O, CaO, BaO реагируют с водой согласно общей схемы:
| ОСНОВНЫЙ ОКСИД | + | ВОДА | = | ОСНОВАНИЕ |
При написании уравнений таких реакций следует помнить, что степень окисления металла в образующемся основании равна его степени окисления в исходном оксиде.
Примеры:
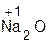 + H2O = 2
+ H2O = 2 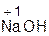 ;
; 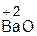 + H2O =
+ H2O = 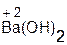 .
.
оксид вода гидроксид оксид вода гидроксид
натрия натрия бария бария
Основные оксиды, образованные такими металлами, как Cu, Fe, Cr, с водой не реагируют. Соответствующие им основания получают другими способами.
б) В з а и м о д е й с т в и е с к и с л о т а м и.
Практически все основные оксиды реагируют с кислотами с образованием солей по общей схеме:
| ОСНОВНЫЙ ОКСИД | + | кислота | = | СОЛЬ | + | ВОДА |
Следует помнить, что в образующейся соли валентность металла такая же, как в исходном оксиде, а валентность кислотного остатка такая же, как в исходной кислоте.
Примеры:
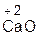 + 2
+ 2 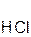 =
= 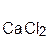 + H2O;
+ H2O; 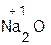 +
+ 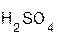 =
= 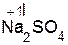 + H2O;
+ H2O;
оксид хлорово- хлорид вода оксид серная сульфат вода
кальция дородная кальция натрия кислота натрия
кислота
в) В з а и м о д е й с т в и е с к и с л о т н ы м и о к с и д а м и
Основные оксиды реагируют с кислотными оксидами с образованием солей согласно общей схемы:
| ОСНОВНЫЙ ОКСИД | + | КИСЛОТНЫЙ ОКСИД | = | СОЛЬ |
В образующейся соли степень окисления металла такая же, как и в исходном основном оксиде. Кроме того, следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид N2O5, которому соответствует кислота HNO3(указана в скобках), то в состав соли будет входить остаток этой кислоты, т. е. NO3. Его заряд, как вы уже знаете, равен 1–:
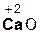 +
+ 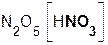 =
= 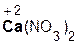 .
.
оксид оксид нитрат
кальция азота(V) кальция
Если же в реакцию вступает кислотный оксид Р2О5, которому соответствует кислота Н3РО4 (указана в скобках), то в составе образующейся соли будет остаток этой кислоты, т. е. РO4 с с зарядом, равным 3–:
3 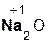 +
+ 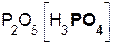 = 2
= 2 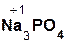 .
.
оксид оксид фосфат
натрия фосфора(V) натрия
К и с л о т н ы е о к с и д ы
а)В з а и м о д е й с т в и е с в о д о й
Кислотные оксиды, кроме оксида кремния SiO2, реагируют с водой согласно общей схемы:
| кислотный ОКСИД | + | ВОДА | = | КИСЛОРОДСОДЕРЖАЩАЯ КИСЛОТА |
Например:
SO3 + H2O = H2SO4; CO2 + H2O = H2CO3
оксид вода серная оксид вода угольная
серы(VI) кислота углерода(IV) кислота
P2O5 + 3H2O = 2H3PO4; N2O5 + H2O = 2HNO3;
оксид вода фосфорная оксид вода азотная
фосфора(V) кислота азота(V) кислота
Таким образом, каждому кислотному оксиду соответствует кислородсодержащая кислота. Несмотря на то, что оксид кремния SiO2 с водой не реагирует, ему тоже соответствует кислота H2SiO3, но её получают другими способами.
б)В з а и м о д е й с т в и е со щ ё л о ч а м и
Все кислотные оксиды реагируют с щёлочами согласно общей схемы:
| КИСЛОТНЫЙ ОКСИД | + | ЩЁЛОЧЬ | = | СОЛЬ | + | ВОДА |
В образующейся соли степень окисления металла такая же, как и в исходной щёлочи. Кроме того, в состав соли входит остаток той кислоты, которая соответствует данному кислотному оксиду. Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3(указана в скобках), то в состав соли будет входить остаток этой кислоты, т. е. CO3, заряд которого равен 2–:
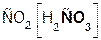 +
+ 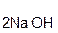 =
= 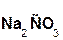 + H2O.
+ H2O.
оксид гидроксид карбонат вода
углерода(IV) натрия натрия
Если же в реакцию вступает кислотный оксид N2О5, которому соответствует кислота HNO3 (указана в скобках), то в составе образующейся соли будет остаток этой кислоты, т. е. NO3 с зарядом, равным 1–:
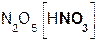 +
+ 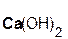 =
= 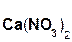 + H2O.
+ H2O.
оксид гидроксид нитрат вода
азата(V) кальция кальция
в) Р е а к ц и и с о с н о в н ы м и о к с и д а м и
Основные оксиды реагируют с кислотными оксидами с образованием солей согласно общей схемы:
| КИСЛОТНЫЙ ОКСИД | + | ОСНОВНЫЙ ОКСИД | = | СОЛЬ |
В образующейся соли степень окисления металла такая же, как и в исходном основном оксиде. Кроме того, следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид SO3, которому соответствует кислота H2SO4(указана в скобках), то в состав соли будет входить остаток этой кислоты, т. е. SO4:
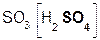 +
+ 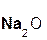 =
= 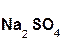 .
.
оксид оксид сульфат
серы(VI) натрия натрия
Если же в реакцию вступает кислотный оксид Р2О5, которому соответствует кислота Н3РО4 (указана в скобках), то в составе образующейся соли будет остаток этой кислоты, т. е. РO4:
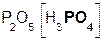 + 3
+ 3 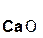 =
= 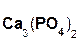 .
.
оксид оксид фосфат
фосфора(V) кальция кальция
Дата: 2016-10-02, просмотров: 344.