Традиционные русские названия бескислородных кислот составляются в последовательности: «корень русского названия соответствующего галогена или халькогена» + «суффикс «о» + «водородная»: HF – фтороводородная, HCl – хлороводородная, HBr – бромоводородная, H2S – сероводородная. Кислота HCN имеет название «циановодородная».
Названия кислородосодержащих кислот производятся от русских названий кислотоообразующих элементов с различными суффиксами, которые необходимо строго выдерживать.
Если элемент образует две кислоты, то используются суффиксы -ни -ист: первый – при максимальной степени окисления кислотообразующего элемента, а второй – если степень окисления данного элемента ниже максимальной. Пример:
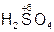 – серная кислота,
– серная кислота, 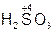 – сернистая кислота;
– сернистая кислота;
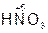 – азотная кислота,
– азотная кислота, 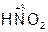 – азотистая кислота.
– азотистая кислота.
В названиях некоторых кислот суффикс -н заменяется суффиксами -ов и -ев: H2CrO4 – хромовая кислота, H2SiO3 – кремниевая кислота.
Галогены хлор, бром и иод, кроме бескислородных образуют по четыре кислородосодержащих кислоты, в которых степени окисления атомов галогенов равны +7, +5, +3 и +1. В названиях этих кислот используются соответственно суффиксы -н, -оват, -ист и -оватист: HClO4 – хлорная, HClO3 – хлорноватая, HClO2 – хлористая, HClO – хлорноватистая.
Существуют кислоты различного состава, в молекулах которого атомы элемента-кислотообразователя находятся в одной и той же степени окисления. В этом случае к названию кислоты с наименьшим содержанием атомов водорода и кислорода добавляется префикс (приставка) мета-, с наибольшим – орто-, а при промежуточном содержании атомов водорода и кислорода (в расчёте на один атом кислотообразуещего элемента) – пиро-: HPO3 – метафосфорная кислота, H3PO4 – ортофосфорная кислота, H4P2O7 – пирофосфорная кислота.
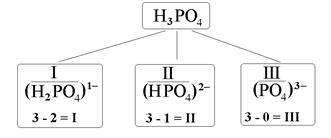 При отщеплении атомов водорода от молекул кислот образуются кислотные остатки. Общее число остатков кислоты совпадает с её основностью. Как вы уже знаете, валентность кислотного остатка равна разности между числами атомов H в формулах кислоты и данного остатка. Заряды кислотных остатков всегда отрицательны и численно совпадают с их валентностью. Например, фосфорной кислоте соответствуют три кислотных остатка – H2PO4, HPO4 и PO4, валентность которых равна, соответственно, I, II и III, а их заряды составляют 1–, 2– и 3– (рис. 2).
При отщеплении атомов водорода от молекул кислот образуются кислотные остатки. Общее число остатков кислоты совпадает с её основностью. Как вы уже знаете, валентность кислотного остатка равна разности между числами атомов H в формулах кислоты и данного остатка. Заряды кислотных остатков всегда отрицательны и численно совпадают с их валентностью. Например, фосфорной кислоте соответствуют три кислотных остатка – H2PO4, HPO4 и PO4, валентность которых равна, соответственно, I, II и III, а их заряды составляют 1–, 2– и 3– (рис. 2).
 Названия важнейших кислот и соответствующих кислотных остатков приведены в Приложении 1.
Названия важнейших кислот и соответствующих кислотных остатков приведены в Приложении 1.
Свойства кислот
Физические свойства
Некоторые кислоты существуют в виде индивидуальных веществ. Они представляют собой бесцветные жидкости (H2SO4, HNO3, HСlO4) или белые твёрдые вещества (H3PO4, H3BO3, H2SiO3).
Жидкие кислоты различаются по вязкости и летучести. Кислоты с высокой вязкостью («маслянистые жидкости») – обычно нелетучи, не обладают запахом. К ним относится, например, серная кислота. Кислоты с низкой вязкостью, как правило, летучи и обладают резким «кислотным» запахом. Это, например, азотная и уксусная кислоты.
Твёрдые неорганические кислоты (обычно нелетучи и не обладают запахом.
К другой группе относятся кислоты, представляющие собой водные растворы галогеноводородов (HF, HCl, HBr, HI) или халькогеноводородов (H2S, H2Se, H2Te). Такие кислоты представляют собой бесцветные жидкости с характерным запахом.
Химические свойства
В водных растворах кислоты проявляют ряд схожих химических свойств, называемых кислотными свойствами:
а) Э л е к т р о л и т и ч е с к а я д и с с о ц и а ц и я и и з м е н е н и е о к р а с к и и н д и к а т о р о в
По способности диссоциировать в водных растворах на ионы неорганические кислоты делятся на две группы:
· Сильные кислоты – HСlO4, HBrO4, HMnO4, H2SO4, H2SeO4, HNO3, HClO3, HBrO3, HIO3. В водных растворах они диссоциируют практически полностью и необратимо:
HСlO4 → H+ + СlO4–; H2SO4 → 2H+ + SO42–.
· Слабые кислоты – HClO, HBrO, HIO, HClO2, H2SO3, H2СO3, H2SiO3, H3PO4, H3BO3. В водных растворах они диссоциируют частично и обратимо. При этом диссоциация многоосновных кислот протекает ступенчато, например:
H3PO4 ↔ H+ + H2PO4–; H2PO4– ↔ H+ + HPO42–; HPO42– ↔ H+ + PO43–;
Поскольку в водных растворах всех кислот содержатся ионы водорода H+, они изменяют окраску индикаторов: лакмуса – с фиолетового на красный; метилоранжа – с оранжевого на красный; бесцветный фенолфталеин в присутствии кислот не изменяет свою окраску.
б) В з а и м о д е й с т в и е с м е т а л л а м и
В водных растворах многие кислоты реагируют с металлами, расположенными в ряду активности левее Н2 (например, Mg, Al, Zn, Fe). В результате этих реакций образуются сложные вещества – соли и выделяется газообразное простое вещество – водород:
| кислота | + | металл | = | СОЛЬ | + | ВОдород |
В такие реакции вступают как бескислородные (HCl, HBr), так и кислородсодержащие (H2SO4, H3PO4) кислоты, например:
2HCl + Zn = ZnCl2 + H2↑; H2SO4 + Mg = MgSO4 + H2↑;
хлорово- цинк хлорид водород серная магний сульфат водород
дородная цинка кислота магния
кислота
6HBr + 2Al = 2AlBrl3 + 3H2↑; H2SO4 + Fe = FeSO4 + H2↑.
бромо- алюми- бромид водород серная железо сульфат водород
дородная ний алюминия кислота железа(II)
кислота
Реакции этого типа относятся к реакциям замещения: атомы металлов замещают (вытесняют) атомы водорода из молекул кислот.
Следует помнить, что металлы, расположенные в ряду активности правее Н2 (Сu, Ag, Hg и др.) с указанными кислотами в водных растворах не реагируют.
в) Р е а к ц и и с о с н о в н ы м и о к с и д а м и
Кислоты реагируют с основными оксидами, образуя соли и воду:
| кислота | + | ОСНОВНЫЙ ОКСИД | = | СОЛЬ | + | ВОДА |
Следует помнить, что в образующейся соли степень окисления металла такая же, как в исходном оксиде. Примеры реакций:
2 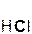 +
+ 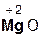 =
= 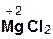 + H2O;
+ H2O;
хлорово- оксид хлорид вода
дородная магния магния
кислота
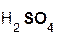 +
+ 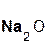 =
= 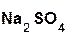 + H2O;
+ H2O;
серная оксид сульфат вода.
кислота натрия натрия
Эти реакции относятся к реакциям обмена, поскольку в процессе взаимодействия исходные сложные вещества обмениваются своими составными частями.
г) В з а и м о д е й с т в и е с о с н о в а н и я м и
Кислоты реагируют с основаниями по общей схеме:
| кислота | + | ОСНОВание | = | СОЛЬ | + | ВОДА |
Кислоты реагируют как с нерастворимыми, так и с растворимыми основаниями, например:
2 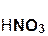 +
+ 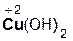 =
= 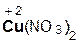 + 2H2O;
+ 2H2O;
азотная гидроксид нитрат вода
кислота меди(II) меди(II)
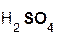 + 2
+ 2 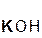 =
= 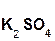 + 2H2O;
+ 2H2O;
серная гидроксид сульфат вода
кислота калия калия
Реакции этого типа, как и предыдущего, относятся к реакциям обмена.
г) В з а и м о д е й с т в и е с с о л я м и
Ещё один класс сложных веществ, с которыми кислоты могут вступать в химическое взаимодействие, – соли. Реакции этого типа идут согласно общей схемы:
| кислота | + | соль | = | новая кислота | + | новая соль |
Однако сразу заметим, что кислота реагирует в растворе с солью лишь в том случае, если в результате реакции выделяется газ (↑) или образуется нерастворимое вещество, выпадающее в осадок (↓). Примеры таких реакций:
2 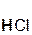 +
+ 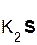 =
= 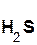 ↑ + 2
↑ + 2 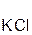 ;
;
хлоро- сульфид серо- хлорид
водородная калия водород калия
кислота
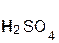 +
+ 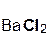 = 2
= 2 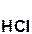 +
+ 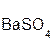 ↓.
↓.
серная хлорид хлоро- сульфат
кислота бария водородная бария
кислота
Очевидно, что реакции этого типа, как и двух предыдущих, относятся к реакциям обмена.
д) Р а з л о ж е н и е к и с л о т н а к и с л о т н ы е о к с и д ы и в о д у
Известно несколько кислот, которые достаточно легко разлагаются на соответствующий кислотный оксид и воду. К таким кислотам, называющимся неустойчивыми, относятся, например, угольная (H2CO3), сернистая (H2SO3) и кремниевая (H2SiO3) кислоты. Особенно неустойчива угольная кислота: она разлагается на кислотный оксид CO2 и воду уже при комнатной температуре:
H2CO3 = CO2 + H2O.
угольная оксид вода
кислота углерода(IV)
По этой причине угольная кислота, образующаяся в результате реакций обмена, сразу же разлагается на указанные вещества, например:
 CO2 ↑ (оксид углерода(IV)
CO2 ↑ (оксид углерода(IV)
 CaCO3 + 2HCl = CaCl2 + H2CO3
CaCO3 + 2HCl = CaCl2 + H2CO3
карбонат хлоро- хлорид угольная H2O (вода).
кальция водородная кальция кислота
кислота
Сернистая и кремниевая кислоты разлагаются на кислотные оксиды и воду при нагревании:
H2SO3 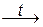 SO2 + H2O; H2SiO3
SO2 + H2O; H2SiO3 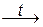 SiO2 + H2O.
SiO2 + H2O.
сернистая оксид кремниевая оксид
кислота серы(IV) кислота кремния(IV)
Получение кислот
Для получения неорганических кислот используют реакции разных типов. Важнейшими из них являются:
1. Взаимодействие некоторых простых веществ-неметаллов с водородомв специальных условиях,например:
H2 + Cl2 = 2HCl; H2 + S = H2S.
водород хлор хлоро- водород сера серо-
водород водород
Образующиеся газообразные продукты реакций – HCl и H2S растворяют в воде и получают соответствующие бескислородные кислоты – хлороводородную и сероводородную. Таким же образом можно получить и бромоводородную кислоту – раствор газа бромоводорода HBr в воде.
2. Взаимодействие нелетучей безводной серной кислоты с твёрдыми солями.
Этот способ основан на том, что нелетучая серная кислота H2SO4 при нагревании вытесняет летучие кислоты – HCl и HNO3 из их твёрдых солей. Поэтому, например, хлороводородную кислоту можно получить, нагревая смесь её соли – твёрдого хлорида натрия с безводной серной кислотой:
2NaCl + H2SO4 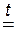 2HCl ↑ + Na2SO4;
2HCl ↑ + Na2SO4;
хлорид серная хлоро- сульфат
натрия кислота водород натрия
Газообразный хлороводород, выделяющийся в этой реакции, растворяют в воде и получают хлороводородную кислоту. Поскольку она образуется из хлорида натрия NaCl, называемого в быту просто «соль», то эту кислоту очень часто называют «соляная кислота».
Для получения азотной кислоты нагревают смесь её соли – нитрата натрия NaNO3 с безводной серной кислотой:
2NaNO3 + H2SO4 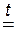 2HNO3↑ + Na2SO4;
2HNO3↑ + Na2SO4;
нитрат серная азотная сульфат
натрия кислота кислота натрия
Пары азотной кислоты, образующиеся в результате второй реакции, охлаждают до комнатной температуры, и она переходит в жидкое состояние.
3. Взаимодействие кислотных оксидов с водой.
Вы уже знаете, что кислотные оксиды, кроме SiO2, реагируют с водой с образованием кислот. Это свойство кислотных оксидов используют для получения некоторых кислородсодержащих кислот, например, серной и фосфорной:
SO3 + H2O = H2SO4; P2O5 + H2O = H3PO4.
оксид вода серная оксид вода фосфорная
серы(VI) кислота фосфора(V) кислота
Поскольку оксид кремния SiO2 с водой не реагирует, то соответствующую ему кислоту H2SiO3 получают другими способами.
О с н о в а н и я
Дата: 2016-10-02, просмотров: 316.