Основания – сложные вещества, в состав которых входят атомы металлов и гидроксогруппы ОН, например: NaOH, Ca(OH)2, La(OH)3.
1. По растворимости к воде основания подразделяются на растворимые и нерастворимые.
Растворимые в воде основания называются щелочами[1]. К ним относятся гидроксиды щелочных (LiOH, NaOH, KOH, RbOH, CsOH) и щелочноземельных металлов (Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2), а также гидрат аммиака NH3 · H2O («гидроксид аммония NH4OH»).
Примеры нерастворимых оснований: Cu(OH)2, Fe(OH)2, Bi(OH)3, Cr(OH)3.
2. По кислотно-основным свойствам все основания делятся на две группы – типичные и амфотерные основания.
Типичными являются основания, которым соответствуют основные оксиды: это все щёлочи, а также Mg(OH)2, Mn(OH)2, Fe(OH)2, La(OH)3, Bi(OH)3.
Амфотерными являются те основания, которым соответствуют амфотерные оксиды. Это Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2, Al(OH)3, Cr(OH)3.
3. По кислотности(числу гидроксогрупп в формульной единице) основания делятся на однокислотные (NaOH, KOH), двухкислотные (Ba(OH)2, Fe(OH)2), трёхкислотные (Al(OH)3, Fe(OH)3).
Номенклатура оснований. Основные остатки
Названия оснований состоят из слова «гидроксид» и названия металла в родительном падеже: KOH – гидроксид калия, Ba(OH)2 – гидроксид бария, Al(OH)3 – гидроксид алюминия. Если металл образует несколько оснований, то в их названиях римской цифрой в скобках указывается степень окисления атомов этого металла, например: Fe(OH)2 – гидроксид железа(II), Fe(OH)3 – гидроксид железа(III), Sn(OH)2 – гидроксид олова(II), Sn(OH)4 – гидроксид олова(IV).
Основание NH3∙H2O, образующееся при растворении аммиака в воде, называется гидрат аммиака. Ранее его состав выражался формулой NH4OH, однако соединение такого состава в действительности не существует.
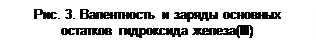
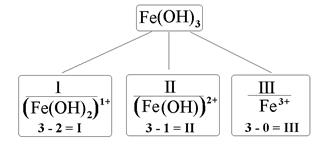 При отщеплении гидроксогрупп ОН от формульных единиц оснований образуются основные остатки. Общее число остатков основания равно его кислотности. Валентность основного остатка равна разности между числами групп ОН в формулах основания и данного остатка. Заряды основных остатков всегда положительны и численно совпадают с их валентностью. Например, гидроксиду железа(III) соответствуют три основных остатка – Fe(OH)2, Fe(OH)2 и Fe, валентность которых равна, соответственно, I, II и III, а их заряды составляют 1+, 2+ и 3+ (рис. 3).
При отщеплении гидроксогрупп ОН от формульных единиц оснований образуются основные остатки. Общее число остатков основания равно его кислотности. Валентность основного остатка равна разности между числами групп ОН в формулах основания и данного остатка. Заряды основных остатков всегда положительны и численно совпадают с их валентностью. Например, гидроксиду железа(III) соответствуют три основных остатка – Fe(OH)2, Fe(OH)2 и Fe, валентность которых равна, соответственно, I, II и III, а их заряды составляют 1+, 2+ и 3+ (рис. 3).
Формулы, значения валентности и названия остатков важнейших оснований приведены в Приложении 2.
Свойства оснований
Физические свойства. Все основания – белые или окрашенные в различные цвета твёрдые вещества. Щёлочи, за исключением гидроксида кальция, хорошо растворимы в воде. Гидроксиды щелочных металлов гигроскопичны: притягивая из воздуха влагу, они постепенно «расплываются».
Химические свойства.
а) Э л е к т р о л и т и ч е с к а я д и с с о ц и а ц и я и д е й с т в и е н а
и н д и к а т о р ы.
Все щёлочи – сильные электролиты, относящиеся к сильным основаниям. В водных растворах они необратимо и полностью диссоциируют на ионы:
NaOH → Na+ + OH– ; Ba(OH)2 → Ba2+ + 2OH–.
Наличие в растворах щелочей гидроксид-ионов OH– обусловливает их общие свойства. Так, например, растворы всех щелочей скользкие на ощупь, едкие, разрушают кожу и ткани. Они изменяют окраску индикаторов: лакмуса с фиолетовой на синюю, метилоранжа – с оранжевой на жёлтую, фенолфталеина – с бесцветной на малиновую.
Гидрат аммиака NH3 · H2O («гидроксид аммония NH4OH») – слабый электролит, диссоциирующий в растворах обратимо и частично:
NH3 · H2O ↔ NH4+ + OH–.
Вследствие этого в растворах данного основания, в отличие от щелочей, концентрация ионов OH– невелика, однако она достаточна для изменения окраски индикаторов.
б) В з а и м о д е й с т в и е с к и с л о т а м и.
Практически все основания реагируют с кислотами с образованием солей по общей схеме:
| ОСНОВание | + | кислота | = | СОЛЬ | + | ВОДА |
В образующейся соли степень окисления металла такая же, как в исходном основании, а заряд кислотного остатка такой же, как в исходной кислоте.
Примеры реакций, протекающих в соответствии с указанной схемой:
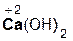 + 2
+ 2 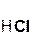 =
= 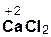 + 2H2O;
+ 2H2O;
гидроксид хлорово- хлорид вода
кальция дородная кальция
кислота
2 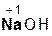 +
+ 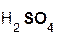 =
= 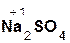 + 2H2O;
+ 2H2O;
гидроксид серная сульфат вода.
натрия кислота натрия
В результате реакции между щёлочью и кислотой образуется раствор соли, в котором уже нет ни щёлочи, ни кислоты. Такой раствор называется нейтральным. Слово «нейтральный» происходит от греческого «нейтер», что в переводе на русский язык значит «ни тот, ни другой».
Реакция между щёлочью и кислотой, в результате которой образуется нейтральный раствор, называется реакцией нейтрализации.
в) В з а и м о д е й с т в и е с к и с л о т н ы м и о к с и д а м и.
Все щёлочи реагируют с кислотными оксидами по общей схеме:
| ЩЁЛОЧЬ | + | КИСЛОТНЫЙ ОКСИД | = | СОЛЬ | + | ВОДА |
В состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3(указана в скобках), то в состав соли будет входить остаток этой кислоты, т. е. CO3:
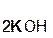 +
+ 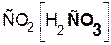 =
= 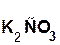 + H2O.
+ H2O.
гидроксид оксид карбонат вода
калия углерода(IV) калия
Если же в реакцию вступает кислотный оксид P2О5, которому соответствует кислота H3PO4 (указана в скобках), то в составе образующейся соли будет остаток этой кислоты, т. е. PO4 с валентностью, равной III:
3 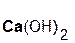 +
+ 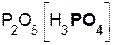 =
= 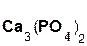 + 3H2O.
+ 3H2O.
гидроксид оксид фосфат вода
кальция фосфора(V) кальция
г) В з а и м о д е й с т в и е с с о л я м и.
Все щёлочи реагируют с солями по общей схеме:
| ЩЁЛОЧЬ | + | соль | = | НОВОЕ ОСНОВАНИЕ | + | НОВАЯ СОЛЬ |
Реакции этого типа относятся к реакциям обмена, поскольку в процессе взаимодействия исходные вещества – щёлочь и соль – обмениваются своими составными частями.
В результате таких реакций обычно выпадает осадок (↓) какого-либо одного нового вещества, например:
2KOH + CuSO4 = Cu(OH)2↓ + K2SO4;
гидроксид сульфат гидроксид сульфат
калия меди(II) меди(II) калия
Ca(OH)2 + K2CO3 = 2KOH + Ca CO3↓.
гидроксид карбонат гидроксид карбонат
кальция калия калия кальция
д) Т е р м и ч е с к о е р а з л о ж е н и е.
Все нерастворимые основания при нагревании разлагаются по общей схеме:
| нерастворимое основание | 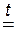
| ОКСИД металла | + | ВОДА |
Примеры реакций:
Сu(OH)2 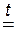 CuO + H2O; 2Fe(OH)3
CuO + H2O; 2Fe(OH)3 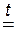 Fe2O3 + 3H2O
Fe2O3 + 3H2O
гидроксид оксид гидроксид оксид
меди(II) меди(II) железа(III) железа(III).
Амфотерныеоснования обладают свойствами как типичных оснований, так и кислот, т. е. они взаимодействуют и с кислотами, и со щелочами. В обоих случаях образуется соль и вода. Например, амфотерный гидроксид цинка взаимодействует с соляной кислотой согласно уравнению:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
При взаимодействии этого гидроксида с расплавленной щелочью образуется цинкат – соль несуществующей «цинковой кислоты» H2ZnO2 (это – формула гидроксида цинка Zn(OH)2, записанная в виде кислоты: Zn(OH)2 = H2ZnO2). Поэтому уравнение данной реакции имеет вид:
Zn(OH)2 + 2NaOH (распл) 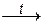 Na2ZnO2 + 2H2O.
Na2ZnO2 + 2H2O.
Если же амфотерный гидроксид реагирует со щёлочью не в расплаве, а в водном растворе, то в результате реакции образуется комплексное соединение:
Zn(OH)2 + 2NaOH = (Na2ZnO2 · 2H2O) = Na2[Zn(OH)4].
Так же взаимодействуют с кислотами и щелочами амфотерные гидроксиды бериллия, олова(II) и свинца(II).
Амфотерный гидроксид алюминия реагирует с азотной кислотой согласно уравнению:
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O.
При взаимодействии этого гидроксида с расплавленной щелочью могут образоваться соли несуществующих «алюминиевых кислот» H3AlO3 и HAlO2 – соответственно ортоалюминаты и метаалюминаты. Поэтому уравнения указанных реакций имеют вид:
Al(OH)3 + 3NaOH (распл) 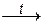 Na3AlO3 + 3H2O;
Na3AlO3 + 3H2O;
Al(OH)3 + NaOH (распл) 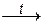 NaAlO2 + 2H2O;
NaAlO2 + 2H2O;
При взаимодействии гидроксида алюминия со щёлочью в водном растворе образуются комплексные соединения:
Al(OH)3 + 3NaOH = (Na3AlO3 · 3H2O) = Na3[Al(OH)6];
Al(OH)3 + NaOH = (NaAlO2 · 2H2O) = Na[Al(OH)4].
Амфотерные гидроксиды взаимодействуют как с кислотными, так и с оснóвными оксидами с образованием солей:
2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O; 3Zn(OH)2 + P2O5 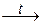 Zn3(PO4)2 + 3H2O;
Zn3(PO4)2 + 3H2O;
2Al(OH)3 + Na2O 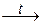 2NaAlO2 + 3H2O; Be(OH)2 + CaO
2NaAlO2 + 3H2O; Be(OH)2 + CaO 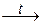 CaBeO2 + H2O.
CaBeO2 + H2O.
Получение оснований
Поскольку растворимые и нерастворимые основания отличаются между собой по свойствам, эти вещества получают разными способами.
Получение щёлочей
Для получения щёлочей можно использовать следующие реакции:
а) Взаимодействие активных металлов (Li, Na, Ca, Ba) с водой, например:
2Li + 2H2O = 2LiOH + H2↑; Ca + 2H2O = Ca(OH)2 + H2↑;
литий вода гидроксид водород кальций вода гидроксид водород
лития кальция
Поскольку эти реакции протекают бурно, на практике их используют редко.
б) Взаимодействие оксидов указанных металлов с водой:
Li2O + 2H2O = 2LiOH; CaО + H2O = Ca(OH)2.
оксид вода гидроксид оксид вода гидроксид
лития лития кальция кальция.
в) Взаимодействие некоторых солей щелочных металлов с щелочами, например:
Na2СO3 + Cа(OH)2 = 2NaOH + CaCO3↓.
карбонат гидроксид гидроксид карбонат
натрия кальция натрия кальция
г) Электролиз водных растворов солей
Некоторые щёлочи (NaOH, KOH) получают, пропуская электрический ток через водные растворы солей NaCl или KCl. При этом наряду со щёлочами образуются и другие ценные вещества – водород H2 и хлор Сl2:
2NaCl + 2H2O 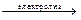 2NaOH + H2↑ + Cl2↑.
2NaOH + H2↑ + Cl2↑.
Получение нерастворимых оснований
Нерастворимые основания получают взаимодействием растворимых оснований (щёлочей) с солями, например:
NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4;
гидроксид сульфат гидроксид сульфат
натрия меди(II) меди(II) натрия.
3KOH + FeCl3 = Fe(OH)3↓ + 3KCl.
гидроксид хлорид гидроксид хлорид
калия железа(III) железа(III) калия.
Если получаемое этим способом основание является амфотерным, оно взаимодействует с избытком щёлочи. Поэтому в таком случае вместо щелочей используют водный раствор аммиака, с которым амфотерное основание не реагирует:
3NH3 · H2О + AlCl3 = Al(OH)3¯ + 3NH4Cl
гидрат хлорид гидроксид хлорид
аммиака алюминия алюминия аммония
С о л и
Дата: 2016-10-02, просмотров: 323.