 |
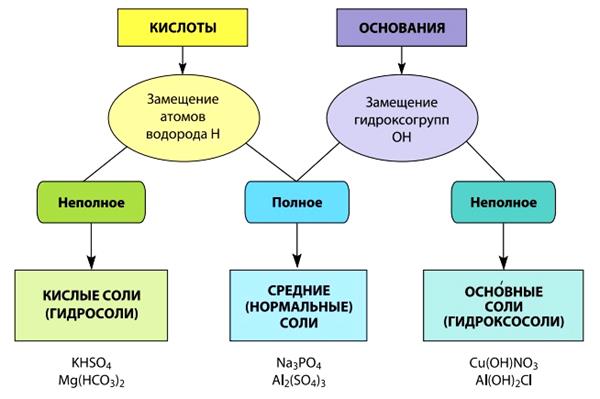
Соли можно рассматривать как продукты замещения атомов водорода в кислотах атомами металлов или групп ОН в основаниях кислотными остатками. В зависимости от степени замещения атомов водорода в молекулах кислот или гидроксогрупп ОН в формульных единицах оснований соли классифицируются следующим образом (рис. 4):
Рис. 4. Схема образования и классификации солей
Поскольку соли можно получать взаимодействием оснований с кислотами, в состав любой из солей входят основные и кислотные остатки. Поэтому можно сказать, что соли – сложные вещества, состоящие из основных и кислотных остатков.
Средние (нормальные) соли образуются при полном замещении атомов водорода в молекулах кислот атомами металлов, например:
H2SO4 + 2NaOH = Na2SO4 + 2H2O; H3PO4 + 3KOH = K3PO4 + 3H2O.
Кислые соли образуются при неполном замещении атомов водорода в молекулах кислот атомами металлов, например:
H2SO4 + NaOH = NaHSO4 + H2O; H3PO4 + KOH = KH2PO4 + H2O;
H3PO4 + 2KOH = K2HPO4 + 2H2O.
В кислотных остатках кислых солей всегда содержатся атомы водорода. Очевидно, что кислые соли образуются только многоосновными кислотами.
Оснóвные соли образуются при неполном замещении гидроксогрупп ОН в формульных единицах оснований кислотными остатками, например:
Al(OH)3 + HCl = Al(OH)2Cl + H2O; Al(OH)3 + 2HCl = AlOHCl2 + 2H2O.
Основные остатки, входящие в состав основных солей, содержат группы ОН. Очевидно, что такие соли образуются только многокислотными основаниями.
По способности растворяться в воде все соли делятся на две большие группы – растворимые и нерастворимые соли. Примеры солей каждой из этих групп приведены на следующей схеме:
| С о л и | ||

| 
| |
| Растворимые | Нерастворимые | |
| NaCl, KBr, KNO3, MgSO4, Na2CO3, ZnSO4, K2S, Al(NO3)3, K2SO3, CaCl2. | BaSO4, CaCO3, AgCl, CuS, MgSiO3, PbSO4, Ca3(PO4)2. |
Номенклатура солей
Русское название любой соли состоит из двух слов, первое из которых – систематическое название кислотного остатка в именительном падеже (см. прил. 1), а второе – русское название основного остатка в родительном падеже (см. прил. 2). Примеры названий:
· средних солей: FeSO4 – сульфат железа(II); Zn(NO3)2 – нитрат цинка;
· кислых солей: – Mg(HCO3)2 – гидрокарбонат магния(II); Ca(H2PO4)2 – дигидрофосфат кальция;
основных солей: (СaOH)3PO4 – фосфат гидроксокальция; Al(OH)2NO3 – нитрат дигидроксоалюминия.
Свойства солей
Физические свойства
Все соли – твёрдые, тугоплавкие кристаллические вещества ионного строения. Соли относятся к нелетучим веществам и поэтому не обладают запахом. Многие из них хорошо растворимы в воде, а некоторые – наоборот, практически нерастворимы в ней. Большинство солей бесцветны, хотя некоторые из них окрашены в различные цвета.
Химические свойства
Для большинства солей характерны реакции замещения и обмена, а для некоторых – ещё и реакции разложения.
1. Р е а к ц и и с м е т а л л а м и
Соли реагируют с металлами по общей схеме:
| соль | + | металл | = | новый металл | + | НОВАЯ СОЛЬ |
При этом всегда более активный металл, расположенный в ряду активности левее, вытесняет из соли менее активный металл, который расположен в этом ряду правее. Для написания уравнений реакций данного типа полезно запомнить хорошее правило: «Металл, который в ряду активности находится левее, записываем в левой части, а металл, расположенный правее – в правой части уравнения».
Примеры реакций:
3CuCl2 + 2Al = 3Cu↓ + 2AlCl3; 3AgNO3 + Fe = 3Ag↓ + Fe(NO3)3.
хлорид алюми- медь хлорид нитрат железо серебро нитрат
меди(II) ний алюминия серебра железа(III)
Очень часто образующиеся в этих реакциях менее активные металлы осаждаются на поверхности оставшихся более активных металлов в виде рыхлой корочки. Однако, если менее активным металлом является жидкая ртуть, она выделяется в виде сплошной блестящей плёнки.
2. Р е а к ц и и с к и с л о т а м и
В водных растворах соли реагируют с кислотами по общей схеме:
| соль | + | кислота | = | новая соль | + | новая кислота |
Следует помнить, что соль реагирует в растворе с кислотой лишь в том случае, если в результате реакции образуется нерастворимое вещество, выпадающее в осадок (↓), или выделяется газ (↑). Примеры реакций:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl;
хлорид серная сульфат хлоро-
бария кислота бария водородная
кислота
K2S + 2HCl = 2KCl + H2S↑
сульфид хлоро- хлорид серо-
калия водородная калия водород.
кислота
Реакции этого типа относятся к реакциям обмена, поскольку участвующие в них исходные вещества обмениваются своими составными частями.
3. Р е а к ц и и со щ ё л о ч а м и.
В водных растворах соли реагируют с щёлочами по общей схеме:
| соль | + | ЩЁЛОЧЬ | = | НОВАЯ СОЛЬ | + | НОВОЕ ОСНОВАНИЕ |
В результате этих реакций обычно выпадает осадок (↓) какого-либо одного нового вещества, например:
FeSO4 + 2NaOH = Na2SO4 + Fe(OH)2↓;
cульфат гидроксид сульфат гидроксид
железа(II) натрия натрия железа(II)
Na2СO3 + Cа(OH)2 = CaCO3↓ + 2NaOH.
карбонат гидроксид карбонат гидроксид
натрия кальция кальция натрия
4. Р е а к ц и и с д р у г и м и с о л я м и.
Соли в водных растворах вступают в реакции обмена с другими солями по общей схеме:
| соль | + | соль | = | новая соль | + | новая соль |
Следует помнить, что соль реагирует с другой солью лишь в том случае, если в результате реакции образуется осадок (↓) одной или двух новых солей:
СaCl2 + Na2CO3 = CaCO3↓ + 2NaCl;
хлорид карбонат карбонат хлорид
кальция натрия кальция натрия.
CuSO4 + BaS = CuS↓ + BaSO4↓.
сульфат сульфид сульфид сульфат
меди(II) бария меди(II) бария.
5. Т е р м и ч е с к о е р а з л о ж е н и е.
Соли некоторых кислородсодержащих кислот разлагаются с образованием основного и кислотного оксидов по общей схеме:
| соль | 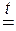
| ОСНОВНЫЙ ОКСИД | + | КИСЛОТНЫЙ ОКСИД |
В ходе таких реакций всегда образуется газообразный кислотный оксид. Он соответствует той кислоте, остаток которой содержится в исходной соли. например, при разложении соли, содержащей остаток угольной кислоты, образуется соответствующий ей кислотный оксид:
CaCO3 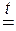 CaO + CO2↑
CaO + CO2↑
карбонат оксид оксид
кальция кальция углерода(IV)
По приведенной схеме разлагаются и некоторые соли сернистой кислоты H2SO3, которой соответствует кислотный оксид SO2:
BaSO3 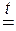 BaO + SO2↑;
BaO + SO2↑;
сульфит оксид оксид
бария бария серы(IV)
Получение солей
Способы получения солей основаны на различных реакциях с участием простых веществ, оксидов, кислот, оснований и солей. Многие соли образуются при взаимодействии:
· Металлов с неметаллами:
2Na + Cl2 = 2NaCl; Zn + S = ZnS;
· Основных оксидов с кислотами:
СaO + 2HCl = CaCl2 + H2O;
· Кислотных оксидов со щелочами:
CO2 + Ba(OH)2 = BaCO3¯ + H2O;
· Амфотерных оксидов с кислотами:
SnO + 2HCl = SnCl2 + H2O;
· Амфотерных оксидов со щелочами:
SnO + 2KOH(распл) 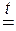 K2SnO2 + H2O; Al2O3 + 2NaOH (распл)
K2SnO2 + H2O; Al2O3 + 2NaOH (распл) 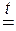 2NaAlO2 + H2O;
2NaAlO2 + H2O;
· Основных оксидов с кислотными:
BaO + CO2 = BaCO3;
· Амфотерных оксидов с кислотными оксидами:
ZnO + SO3 = ZnSO4;
· Амфотерных оксидов с основными оксидами:
ZnO + Na2O = Na2ZnO2;
· Кислот с основаниями:
HCl + NaOH = NaCl + H2O; 3H2SO4 + 2Bi(OH)3 = Bi2(SO4)3 + 6H2O;
· Амфотерных оснований со щелочами:
Cr(OH)3 + 3KOH(распл) = K3CrO3 + 3H2O;
· Металлов с кислотами:
Zn + H2SO4 = ZnSO4 + H2;
· Металлов с солями:
Zn + CuSO4 = ZnSO4 + Cu¯;
· Щелочей с солями:
2NaOH + FeCl2 = Fe(OH)2¯ + 2NaCl;
· Кислот с солями:
2HCl + K2SiO3 = H2SiO3¯ + 2KCl;
· Солей с солями:
AgNO3 + KBr = AgBr¯ + KNO3;
· Аммиака с кислотами:
NH3 + HNO3 = NH4NO3.
2.6.Генетическая связь
Дата: 2016-10-02, просмотров: 315.