Дослід 1. Визначення теплового ефекту реакції нейтралізації одноосновної кислоти розчином лугу.
1. Для проведення досліду беремо кислоти – хлоридну або нітратну та натрій або калій гідроксид.
Робота виконується у спрощеному калориметрі, який складається з двох склянок: зовнішньої місткістю 250-300 мл та внутрішньої місткістю 100 мл, вкладених один в другий та накритих картонною кришкою з отвором для термометра.
Внутрішню склянку необхідно зважити з точністю до 0,1 г, потім налити в неї з бюретки 25 мл 1М розчину кислоти та помістити стакан знову у калориметр. Опустити термометр у кислоту та заміряти температуру з точністю до 0,1°С.
Не витягаючи з розтину кислоти термометр, швидко долити до неї 25 мл 1М розчину лугу, обережно помішуючи, спостерігати зміну температури. Коли підвищення температури припиниться, відзначити максимальну температуру розчину. Після охолодження розчину до кімнатної температури необхідно зважити внутрішню склянку калориметра з розчином.
2. Наслідки експерименту:
Вага внутрішньої склянки – m1 , г.
Початкова температура – t1 , °С.
Кінцева температура – t2 , °С.
Вага внутрішньої склянки з розчином – m2 , г.
3. Обчислення
Теплота, виділена при реакції нейтралізації, витрачається на нагрів розчину: q = cn·m·(t2–t1).
Cn - питома теплоємність розчину, приймається рівною питомій теплоємності води, тобто 4,18 Дж/г. Теплотою, витраченою на нагрівання калориметру, можна знехтувати.
Вагу розчину знаходимо як різницю: m = m2–m1.
Обчислена за наслідком досліду кількість теплоти виділялась при нейтралізації 25 мл 1М розчину, тобто:
q = 25/1000 = 0,025 моль,
тому перераховуємо її на один моль та виражаємо в кДж.
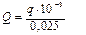 кДж/моль
кДж/моль
(Теоретичне значення цього теплового ефекту = 56,5 кДж/моль).
Відносну похибку обчислюємо за формулою:

Дослід 2. Вплив концентрації реагентів на швидкість хімічної реакції.
Залежність швидкості реакції від концентрації досліджується на прикладі реакції між натрій тіосульфатом і сульфатною кислотою:
Na2S2O3+ H2SO4 = Na2SO4+ SO2+ S↓+ H2O.
Сірка, яка виділяється, викликає помутніння розчину. Зробити попередній якісний дослід, для чого внести в пробірку 5-10 крапель розчину  з масовою часткою 2% та 3-5 крапель розчину
з масовою часткою 2% та 3-5 крапель розчину  з масовою часткою 2%, спостерігати утворення осаду.
з масовою часткою 2%, спостерігати утворення осаду.
Для проведення досліду приготувати в трьох пробірках рівні об’єми розчинів різної концентрації, добавити у дві пробірки воду, як показано в таблиці:
Таблиця 4.5.1 Результати кінетичних досліджень
| № пробірки | Кількість крапель розчину 
| Кількість крапель 
| Кількість крапель розчину 
| Умовна концентрація | Час ходу реакції | Швидкість реакції, у.о. |
| - |
У першу пробірку добавити 1 краплю розчину  з масовою часткою 2%, перемішати розчин і одночасно включити секундомір. Відрахувати час з моменту додавання кислоти до помутніння розчину. Виміри виконати почергово з останніми пробірками. Записати дані в таблицю. Побудувати графік залежності швидкості реакції від концентрації
з масовою часткою 2%, перемішати розчин і одночасно включити секундомір. Відрахувати час з моменту додавання кислоти до помутніння розчину. Виміри виконати почергово з останніми пробірками. Записати дані в таблицю. Побудувати графік залежності швидкості реакції від концентрації  , для чого по вісі абсцис відкласти відносну концентрацію, а по вісі ординат – швидкість в умовних одиницях.
, для чого по вісі абсцис відкласти відносну концентрацію, а по вісі ординат – швидкість в умовних одиницях.
Дослід 3. Вплив концентрації реагентів на хімічну рівновагу.
Вплив концентрації вивчається на прикладі оборотної реакції:
FeCl3 + 3NH4CNS ↔ Fe(CNS)3 + 3NH4Cl.
Один з компонентів цієї реакції – Fe(CNS)3 – ферум(III) роданід – забарвлений в червоний колір, а останні – безбарвні. Це дозволяє по зміні інтенсивності забарвлення розчину судити про зміщення хімічної рівноваги в системі. Для приготування рівноважної суміші налити в склянку 50 мл дистильованої води, додати 8-10 крапель розчину FeCl3, стільки ж крапель розчину NH4CNS і перемішати (повинен утворитись прозорий світло-червоний розчин). Розлити розчин із склянки в чотири пробірки, одну із яких залишити для контролю.
У першу пробірку внести декілька крапель концентрованого розчину FeCl3 , в другу – декілька крапель концентрованого розчину NH4CNS, в третю – небагато кристалічного NH4Cl, і перемішати розчини. Порівняти інтенсивність забарвлення розчинів з контрольною пробіркою і пояснити зміну кольру на основі принципу Ле-Шательє. Написати вираз для константи рівноваги даної реакції.
Зміст звіту
4.6.1 Назва роботи
4.6.2 Мета роботи.
4.6.3 Вивчення загальних відомостей
4.6.4 Виконання завдань для самостійного розв’язання
4.6.5 Аналіз хімічних дослідів.
4.6.6 Висновки.
Лабораторна робота № 5
РОЗЧИНИ
Мета роботи: вивчити загальні властивості розчинів, дати порівняльну характеристику розчинам електролітів та неелектролітів, навчитися здобувати розчини заданої концентрації.
Загальні відомості
5.1.1. Загальна характеристика розчинів
Розчини - гомогенні системи, які складаються з двох або більше компонентів : дисперсійної фази – речовини , які рівномірно розподілені у вигляді молекул , атомів, йонів у дисперсійному середовищі – розчинник . Розчинення речовин супроводиться зміною теплового ефекту. Цей факт та інші свідчать про хімічну взаємодію розчиненої речовини та розчинника.
При розчиненні речовини протікають процеси: руйнування хімічних зв'язків між частинками (атомами, молекулами, йонами) речовини, розчинника, що пов'язане з поглинанням теплоти; в цей час відбувається екзотермічний процес утворення сольватів (гідратів); дифузія сольватів (гідратів) між частинками розчинника (ендотермічний процес). Тепловий ефект розчинення - це сумарне значення вище вказаних процесів.
Розчинність речовини залежить від: природи речовини, температури, тиску (для газоподібних речовин) та інші. (Додаток Г).
Кількісно розчини характеризуються:
1. Кр - коефіцієнт розчинності, показує масу речовини, що припадає на 100 г розчинника (об'єм газоподібної речовини на 1 л розчинника)
2. ω - масова (об'ємна) частка розчиненої речовини
| ω = (mреч./mр-ну.)·100%; | ω = (Vреч./V р-ну.) ·100%. |
3. См - молярна концентрація, показує кількість розчиненої речовини, яка міститься в 1 л розчину
| СМ = υ/ Vр-ну | СМ = m/(M· Vр-ну), моль/л |
4. СN - еквівалентна концентрація (нормальна) показує число еквівалентів (Nекв.) розчиненої речовини в 1 л розчину.
СN = Nекв/Vрозч.; СN=m/(Mекв · Vрозч.)
5. Титр - відношення маси речовини до об'єму розчинника
T = mреч./Vрозч.(мл)
5.1.2. Розчини електролітів
1. При розчиненні у воді електроліти дисоціюють з утворенням йонів, тому розчини електролітів проводять електричний струм.
HCl ↔ H+ + Cl-; Al2(SO4)3 ↔ 2Al3+ +3SO42-;
NaOH ↔ Na+ + OH-; KHCO3 ↔ K+ + HCO3
2. На процес дисоціації впливає: природа речовин, природа розчинника, температура.
3. Кількісною характеристикою процесу дисоціації є:
1) ступінь дисоціації (α)
α=СM. дис. м-л /СМ заг.;
Ступінь електролітичної дисоціації визначають експериментально за величиною ізотонічного коєфіціента і -поправлення від ідеальних систем, розбавлених розчинів неелектролітів

 , k - число йонів, на яке дисоціює молекула електроліту.
, k - число йонів, на яке дисоціює молекула електроліту.
2) для слабких електролітів - константа дисоціації КД.
Для рівняння: aA + bB = cC + dD
KД = (Ссс·СDd)/(CAa·CBb); KД = Сα2/1-α (закон розбавлення Оствальда).
4. Дисоціація води. Йонний добуток води.
Чиста вода - слабкий електроліт.
Н2О ↔ H+ + OH- α=1,8·10-9 (22°C)
2H2O ↔ H3O+ + OH-; H3O+ - йон гідроксонію
КН2О = [H+] · [OH-] - йонний добуток води.
В 1 л води (t° = 22°С) [H+] = [OH-]=10-7 йонів
КН2О=10-7·10-7=10-14 - стала величина
Кислотні властивості розчинів (С.Серенсен,1909р) характеризуються величиною водневого показника рН = -lg [H+].
рН = від 1 до 14
рН = 7 - нейтральний розчин
рН < 7 - кислий
рН > 7 - лужний
5. Деякі солі при розчинені у воді підлягають гідролізу - розкладаються водою з утворенням слабких електролітів.
Zn2+ + HOH → ZnOH+ + H+; pH < 7
CO32- + HOH → HCO3-+ OH-; pH > 7
Збільшення температури сприяє прискоренню гідролізу.
5.1.2. Розчини неелектролітів
Розчини неелектролітів не проводять електричний струм, характеризуються колегативними властивостями, тобто властивості розчинів залежать лише від їхньої концентрації і не залежать від природи розчиненої речовини.
Кількісно характеризуються:
1) осмотичним тиском (Вант-Гофф, 1885р)
Pосм.= υRT/Vр-ну
2) законами Рауля:
ΔP = P0·(υреч./ (υреч. + υр-ка)
ΔP - відносне зниження тиску пари над розчином
υ - кількість речовини
ΔТкип = Ke·Cm; ΔТкрист = Kкр · Cm
ΔТкип - підвищення температури кипіння розчину в порівнянні з температурою кипіння розчинника;
ΔТкрист. – зниження температури замерзання розчину в порівнянні з температурою замерзання розчинника;
Cm - моляльна концентрація розчину (показує кількість речовини (число молів) в 1000г розчинника)
Ке - константа ебуліоскопічна
Ккр. - константа кріоскопічна
Ке, Ккр - залежать від природи розчинника
Завдання для самостійного розв'язання
5.2.1. Відповісти на запитання, виконати завдання
1. Дати характеристику дисперсійним системам.
2. Порівняти властивості та кількісну характеристику розчинів електролітів та неелектрлітів.
3. Привести приклади рівнянь реакції обміну (в молекулярному та йонному виглядах) з утворенням нерозчинної речовини, газоподібної речовини, слабкого електроліту.
4. Скласти рівняння реакцій гідролізу солей FeCl3, K2CO3, CH3COONH4. Вказати pH середовища.
5.2.2 Розв'язати задачі
1. Визначити ω, См, СN розчину сульфатної кислоти, якщо в 24,5 г розчину міститься 4,9 г H2SO4, ρр-ну = 1,139 г/см3
(20%, 2,325 М, 4,65 N)
2. Визначти pH 0,01М розчину хлоридної кислоти.
(2)
3. Визначити масу 98%-ного розчину сульфатної кислоти, необхідну для приготування 500г 25%-ного розчину
(127,6г)
Реактиви та обладнання
1. Розчини: хлоридна кислота (2N), концентрована, етанова (оцтова) кислота (2N), сульфатна кислота концентрована, натрій гідроксид (0,1N), аргентум нітрат, натрій карбонат, натрій ацетат концентрований, амоній нітрат, амоній карбонат, калій хлорид. 2. Речовини: натрій хлорид кристалічний, універсальний індикатор. 3. Обладнання: технохімічні терези, бюретка. нагрівальний прилад, хімічний посуд, мірна піпетка.
Вказівки до техніки безпеки
Дотримуватися правил роботи з розбавленими та концентрованими розчинами кислот, нагрівальними приладами, хімічним склом.
Дата: 2016-10-02, просмотров: 380.