Лабораторна робота №1
ЗДОБУВАННЯ КИСЛОТ, ГІДРОКСИДІВ ТА СОЛЕЙ
Мета роботи: повторення матеріалу про загальну характеристику основних класів неорганічних сполук.
Загальні відомості
Здобування та властивості оксидів
| Здобування | Хімічні властивості |
1. Взаємодія простих речовин з киснем (крім   ( (     ): ):
 2. Окиснення деяких складних речовин:
2. Окиснення деяких складних речовин:
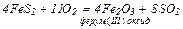
 3. Розкладання оксидів:
3. Розкладання оксидів:
 4. Розкладання гідроксидів:
4. Розкладання гідроксидів:
 5. Розкладання кислот:
5. Розкладання кислот:
 6. Розкладання солей:
6. Розкладання солей:

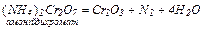 7. Взаємодія кислот-окисників з металами та неметалами:
7. Взаємодія кислот-окисників з металами та неметалами:

 8. Заміщення леткого оксиду менш летким при нагріванні:
8. Заміщення леткого оксиду менш летким при нагріванні:

| 1. Взаємодіють з водою з утворенням гідроксидів або кислот:

 2. Основні оксиди взаємодіють з
кислотними та амфотерними оксидами (при нагріванні):
2. Основні оксиди взаємодіють з
кислотними та амфотерними оксидами (при нагріванні):
 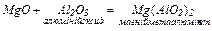 3. Основні та амфотерні оксиди взаємодіють з кислотами:
3. Основні та амфотерні оксиди взаємодіють з кислотами:
  4. Амфотерні та кислотні оксиди взаємодіють з лугами:
4. Амфотерні та кислотні оксиди взаємодіють з лугами:


 5. Деякі оксиди розкладаються:
5. Деякі оксиди розкладаються:

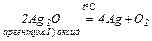
|
Здобування та властивості гідроксидів
| Здобування | Хімічні властивості |
1. Взаємодія активних металів з водою:

  2. Взаємодія оксидів лужних та лужноземельних металів з водою:
2. Взаємодія оксидів лужних та лужноземельних металів з водою:

 3. Взаємодія розчинів солей з лугами:
3. Взаємодія розчинів солей з лугами:
  4. Електроліз водних розчинів солей (в розчині в катодному просторі накопичується 4. Електроліз водних розчинів солей (в розчині в катодному просторі накопичується 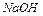 ): ):
 5. У результаті інших реакцій:
5. У результаті інших реакцій:


| 1. Гідроксиди лужних та лужно-земельних металів дисоціюють в водних розчинах:
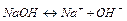
 2. Розчини гідроксидів металів та
2. Розчини гідроксидів металів та  змінюють забарвлення індикаторів (див. додаток A).
3. Взаємодіють з кислотними оксидами та кислотами: змінюють забарвлення індикаторів (див. додаток A).
3. Взаємодіють з кислотними оксидами та кислотами:

 4. Луги взаємодіють з неметалами (
4. Луги взаємодіють з неметалами ( 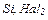 ) та деякими металами ( ) та деякими металами (  та ін.): та ін.):
  5. Взаємодіють з амфотерними, оксидами та гідроксидами: 5. Взаємодіють з амфотерними, оксидами та гідроксидами:
 
|
Здобування та властивості кислот
| Здобування | Хімічні властивості |
1. Взаємодія кислотних оксидів з водою:

 2. Окиснення деяких простих речовин:
2. Окиснення деяких простих речовин:
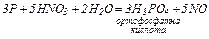 3. Взаємодія солей з кислотами (сильними чи менш леткими, ніж отримувана):
3. Взаємодія солей з кислотами (сильними чи менш леткими, ніж отримувана):
  4. Безкисневі кислоти можуть бути отримані безпосередньо з водню та неметалу:
4. Безкисневі кислоти можуть бути отримані безпосередньо з водню та неметалу:

 Водні розчини таких сполук є кислотами.
5. Гідроліз галогенангідридів:
Водні розчини таких сполук є кислотами.
5. Гідроліз галогенангідридів:
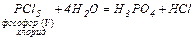
| 1. В розчинах дисоціюють

 2. Розчини кислот змінюють забарвлення індикаторів (див. додаток A)
3. Кислоти – неокисники, реагують з металами, які стоять в ряду стандартних електродних потенціалів до водню, їх
2. Розчини кислот змінюють забарвлення індикаторів (див. додаток A)
3. Кислоти – неокисники, реагують з металами, які стоять в ряду стандартних електродних потенціалів до водню, їх  : :
 4. Кислоти - окисники реагують майже з усіма металами, при цьому водень не виділяється:
4. Кислоти - окисники реагують майже з усіма металами, при цьому водень не виділяється:
 5. Взаємодіють з оксидами та гідроксидами металів:
5. Взаємодіють з оксидами та гідроксидами металів:
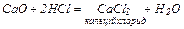
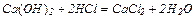 6. Реагують з солями, якщо утворюються слабкі електроліти:
6. Реагують з солями, якщо утворюються слабкі електроліти:

|
Здобування та властивості солей
| Здобування | Хімічні властивості |
1. Взаємодія металів та неметалів:
 2. Взаємодія металів з кислотами:
2. Взаємодія металів з кислотами:
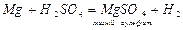
 3. Взаємодія основних та кислотних оксидів:
3. Взаємодія основних та кислотних оксидів:
 4. Взаємодія основних та амфотерних оксидів з кислотами:
4. Взаємодія основних та амфотерних оксидів з кислотами:
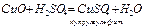 5. Взаємодія гідроксидів з кислотними оксидами:
5. Взаємодія гідроксидів з кислотними оксидами:
 6. Взаємодія гідроксидів з кислотами:
6. Взаємодія гідроксидів з кислотами:

  7. Взаємодія металів з розчинами солей:
7. Взаємодія металів з розчинами солей:
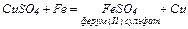 8. Взаємодія кислот з солями:
8. Взаємодія кислот з солями:
 9. Взаємодія двох солей:
9. Взаємодія двох солей:
 10. Взаємодія лугів з амфотерними металами, оксидами, та гідроксидами:
10. Взаємодія лугів з амфотерними металами, оксидами, та гідроксидами:
 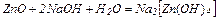 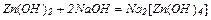
| 1. Розчинні у воді солі, утворені сильними гідроксидами та сильними кислотами, дисоціюють за схемою:
 Розчинні у воді солі, утворені слабкими гідроксидами та (або) слабкими кислотами, гідролізують:
Розчинні у воді солі, утворені слабкими гідроксидами та (або) слабкими кислотами, гідролізують:

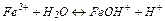

 2. Розчини солей реагують з металами, що мають менше значення
2. Розчини солей реагують з металами, що мають менше значення  (стандартний електродний потенціал), ніж метал, що утворює катіон солі: (стандартний електродний потенціал), ніж метал, що утворює катіон солі:
 3. Розчини солей взаємодіють з лугами:
3. Розчини солей взаємодіють з лугами:
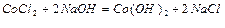 4. Взаємодіють з кислотами:
4. Взаємодіють з кислотами:
 5. Розчини солей реагують між собою, якщо утворюються слабкі електроліти: 5. Розчини солей реагують між собою, якщо утворюються слабкі електроліти:
 6. Деякі солі розкладаються при нагріванні:
6. Деякі солі розкладаються при нагріванні:


|
1.2 Завдання для самостійного розв’язання:
| Варіант | Скласти рівняння реакцій * | Скласти графічні формули | ||
| здобування речовин | хімічних властивостей | взаємних перетворень | ||

| 
| 
| 
| |

| 
| 
| 
| |

| 
| 
| 
| |

| 
| 
| 
| |

| 
| 
| 
| |

| 
| 
| 
| |

| 
| 
| 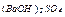
| |

| 
| 
| 
| |

| 
| 
| 
| |

| 
| 
| 
| |

| 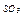
| 
| 
| |
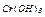
| 
| 
| 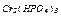
| |

| 
| 
| 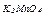
| |

| 
| 
| 
| |

| 
| 
| 
| |

| 
| 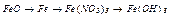
| 
| |
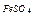
| 
| 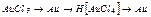
| 
| |

| 
| 
| 
| |
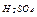
| 
| 
| 
| |

| 
| 
| 
| |

| 
| 
| 
| |

| 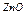
| 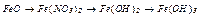
| 
| |
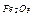
| 
| 
| 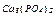
| |

| 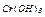
| 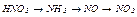
| 
| |

| 
| 
| 
|
*в молекулярному та іонному вигляді, дати назви всім речовинам
Обладнання та реактиви
1. Обладнання: простіший прилад для здобування та відводу газу. 2 Речовини: магній, магній гідроксид, плюмбум (II) оксид, індикатори: лакмус, фенолфталеїн. 3. Розчини: хлоридна кислота, сульфатна кислота, натрій гідроксид, кальцій гідроксид, нікол (II) cульфат, алюміній хлорид, натрій ацетат, плюмбум (II) ацетат, кобальт (ІІ) нітрат.
Вказівки до техніки безпеки
Дотримуватися правил роботи з хімічними речовинами: кислотами, лугами, солями; з нагрівальними приладами, скляним посудом.
Зміст звіту
1.6.1 Назва роботи.
1.6.2 Мета роботи.
1.6.3 Вивчення загальних відомостей.
1.6.4 Виконання завдань для самостійного розв’язання
1.6.5 Аналіз хімічних дослідів (хід виконання, спостереження, рівняння хімічних реакцій).
1.6.6 Висновки.
Лабораторна робота №2
Загальні відомості
Маси (об’єми) реагуючих між собою речовин підкоряються закону еквівалентів. Згідно з цим законом маси (об’єми) реагуючих між собою речовин  та
та  (
(  та
та  ) пропорційні їх еквівалентним маса (молярним масам еквівалентів)
) пропорційні їх еквівалентним маса (молярним масам еквівалентів)  та
та  (
(  та
та  ):
):
 або
або 
Молярною масою еквівалента або еквівалентною масою називається масова кількість елемента, яка сполучається з однією (точніше з 1,008) масовою частиною водню або вісьмома масовими частинами кисню чи заміщує їх у сполуках.
Об’єм, який має за даних умов молярна маса еквівалента речовини у газовому стані, називається молярним об’ємом еквівалента цієї речовини.
Виходячи з того, що молярний об’єм будь-якого газу за нормальних умов дорівнює 
 , молярний об’єм еквівалента водню
, молярний об’єм еквівалента водню  дорівнює
дорівнює 
 ; молярний об’єм еквівалента кисню
; молярний об’єм еквівалента кисню  дорівнює
дорівнює 
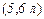 . Молярна маса еквівалента речовини (як простої так і складної) може набувати різного значення і залежить від того, до якої реакції вступає ця речовина.
. Молярна маса еквівалента речовини (як простої так і складної) може набувати різного значення і залежить від того, до якої реакції вступає ця речовина.
Завдання для самостійного розв’язання
Розв’язати задачі
1. Визначити  нітрогену та формулу сполуки, яка містить 82,35 % нітрогену та 17,65 % гідрогену.
нітрогену та формулу сполуки, яка містить 82,35 % нітрогену та 17,65 % гідрогену.
(  )
)
2. Визначити  арґентуму, якщо 2,39 г цинку виділяють з розчину солі арґентуму 7,9 г срібла.
арґентуму, якщо 2,39 г цинку виділяють з розчину солі арґентуму 7,9 г срібла.  (
(  )
)
3. 1 г металу сполучається з масою хлору, що займає простір об’ємом 0,34 л при 37 °С та тискові 97,99 кПа. Обчислити молярну масу еквіваленту металу. (  )
)
4. З 1,35 г оксиду металу добуто 3,15 г його нітрату. Обчислити молярну масу еквіваленту металу. (  )
)
5. Залізо масою 7 г витісняє із кислоти 3,2 л водню виміряного при температурі 39 °С та тискові 1 атм. Яка валентність заліза в утвореній сполуці? ( 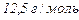 )
)
Обладнання та реактиви
1. Обладнання: прилад для визначення еквівалента металу; термометр; барометр; циліндри на 25 та 100 мл.
2. Реактиви: наважка металу; хлоридна кислота (4N).
Вказівки до техніки безпеки
Дотримуватися правил роботи з кислотами, скляним посудом.
Зміст звіту
2.6.1 Назва роботи.
2.6.2 Мета роботи.
2.6.3 Вивчення загальних відомостей.
2.6.4 Виконання завдань для самостійного розв’язання.
2.6.5 Аналіз досліду, математична обробка результатів експерименту.
2.6.6 Висновки
Лабораторна робота № 3
ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Мета роботи: навчитися визначати ступені окислення елементів та складати рівняння окислювально-відновних реакцій.
Загальні відомості
3.1.1 Окислення і відновлення. Класифікація окисно-відновних реакцій.
Реакції, що відбуваються із зміною ступеня окиснення атомів, що входять до складу реагуючих речовин, називаються окисно-відновними. Окисно-відновні реакції поділяються на три типи:
1. Міжмолекулярні реакції. Ступінь окиснення змінюють атоми, що входять до складу різних вихідних речовин, наприклад:
 ;
;  .
.
2. Внутрішньомолекулярні реакції. Атоми, що змінюють ступінь окиснення, входять до складу однієї сполуки (іноді це атоми одного елементу з різними ступенями окиснення), наприклад:
 ;
; 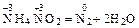 .
.
3. Реакція диспропорціювання. Атоми одного й того самого елемента з певним ступенем окиснення є як окисниками, так і відновниками, наприклад:
 ;
;  .
.
Реакції диспропорціювання (або самоокислення - самовідновлення характерні для речовин, що містять атоми з проміжними ступенями окиснення).
Метод електронного балансу
Стехіометричні коефіцієнти у рівняннях окисно-відновних реакцій зручно визначати, користуючись методом електронного балансу. Цей метод ґрунтується на порівнянні ступенів окиснення атомів у початкових і кінцевих умовах. Для встановлення коефіцієнтів виходять з того положення, що число електронів, відданих відновником, повинно дорівнювати числу електронів, приєднаних окисником. Існує певний алгоритм складання рівнянь окисно-відновних реакцій.
1. Записати схему рівняння.

2. Визначити, які атоми змінюють ступінь окиснення.

Отже, відновником є 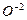 , окисником -
, окисником - 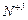 .
.
3. Скласти електронні рівняння процесів окиснення та відновлення. Підібрати коефіцієнти в цих схемах так, щоб загальне число електронів, які віддає відновник, дорівнювало загальному числу електронів, що приєднує окисник.

4. Розставити знайдені коефіцієнти у молекулярному рівнянні.

5. Підібрати інші коефіцієнт таким чином, щоб загальне число атомів кожного елемента було однаковим у лівій та правій частинах рівняння.

Завдання для самостійного розв’язання
3.2.1 Відповісти на запитання та виконати завдання
1. Які реакції називають окисно-відновними? Що таке окисники, відновники, процеси окиснення, відновлення?
2. Які із сполук  ,
,  ,
,  ,
, 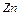 ,
,  ,
, 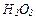 ,
,  ,
,  ,
,  ,
,  здатні бути тільки окисниками, які тільки відновниками, які здатні виявляти і окисні і відновні властивості в залежності від умов реакцій?
здатні бути тільки окисниками, які тільки відновниками, які здатні виявляти і окисні і відновні властивості в залежності від умов реакцій?
3. Користуючись методом електронного балансу розставити коефіцієнти в рівняннях окисно-відновних реакцій. Вказати окисник та відновник, процеси окиснення та відновлення. Визначити Мекв окисників і відновників.
а) 
б) 
в) 
г) 
д) 
4. Закінчити рівняння реакцій, за допомогою електронного балансу розставити коефіцієнти, вказати окислювач і відновник.
а) 
б) 
в) 
г) 
д) 
5. Розставити коефіцієнти за допомогою методу електронного балансу в рівняннях окисно-відновних реакцій. Вказати окисники та відновники.
| Варіант | Схеми хімічних процесів |

| |

| |

| |
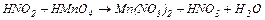
| |

| |

| |

| |

| |

| |
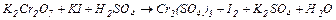
| |

| |

| |

| |

| |

| |

| |

| |

| |

| |

| |

| |
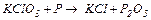
| |

| |

| |

|
Реактиви та обладнання
1. Розчини: сульфатна кислота (2N), купрум (II) сульфат, манган (II) сульфат, натрій гідроксид, бром, калій перманганат, ферум (II) сульфат, калій дихромат. 2. Речовини: цинк, залізо, кристалічні натрій сульфіт або натрій нітрит, дистильована вода. 3. Обладнання: нагрівальний прилад.
Вказівки до техніки безпеки
Дотримуватися правил роботи з розчинами кислот, солей, лугів, нагрівальним приладом.
Зміст звіту
3.6.1 Назва роботи.
3.6.2 Мета роботи.
3.6.3 Вивчення загальних відомостей.
3.6.4 Виконання завдань для самостійного розв’язання.
3.6.5 Аналіз хімічних дослідів.
3.6.6 Висновки.
Лабораторна робота №4
Загальні відомості
Основи хімічної кінетики
Вчення про швидкість і механізм хімічних реакцій називається хімічною кінетикою.
Для гомогенних процесів (система складається з однієї фази) що відбуваються без зміни об’єму, швидкість хімічної реакції (Vр-ції) визначають як зміну концентрації (∆С) реагуючих речовин, або продуктів реакції в одиницю часу (∆τ).
Vр-ції = ∆С/∆τ (моль/л·с)
Для гетерогенних процесів (система складається з двох або більше фаз) – швидкість хімічних реакцій характеризує інтенсивність хімічного процесу тобто число елементарних актів взаємодії або розкладання за одиницю часу на одиницю поверхні поділу фаз.
Швидкість хімічної реакції залежить від:
1) концентрації реагуючих речовин;
Згідно закону діючих мас ( М.М. Бекєтов, К. Гульдберг, П. Вааге) швидкість хімічної реакції прямопропорційна добутку концентрацій реагуючих речовин у ступенях, які дорівнюють коефіцієнтам.
Для рівняння  , швидкість хімічної реакції дорівнює:
, швидкість хімічної реакції дорівнює:
Vр-ції = САa · СВb  ,
,
де  – константа швидкості, чисельно дорівнює Vр-ції, якщо
– константа швидкості, чисельно дорівнює Vр-ції, якщо  (С-концентрація, моль/л),
(С-концентрація, моль/л),  ,
,  - рівноважні концентрації реагентів, моль/л.
- рівноважні концентрації реагентів, моль/л.
2) температури:
Підвищення температури реагуючих речовин внаслідок збільшення швидкості молекул зумовлює зростання загальної енергії системи, збільшення відносного вмісту активних молекул, що рівнозначно зростанню Vр-ції . Залежність швидкості хімічної реакції від температури виражається правилом Вант-Гоффа: підвищення температури на кожні 10 градусів збільшує швидкість реакції в 2 - 4 рази.

γ – температурний коефіцієнт (γ = 2 - 4)
3) використання спеціальних речовин, які змінюють Vр-ції, цей процес називається каталізом; речовини які збільшують Vр-ції називаються каталізаторами, а які зменшують Vр-ції – інгібіторами.
4) природа реагуючих речовин – будова атомів, будова молекул, міцність хімічних зв’язків.
5) інших факторів: освітлення, опромінювання тощо.
Хімічна рівновага
Стан хімічної системи, коли швидкість прямої і зворотної реакцій однакові, називається хімічною рівновагою.

пряма зворотна
Vпр. р-ції = k1САа· СВb,
або при хімічній рівновазі: 
 = k2ССс· СDd
= k2ССс· СDd
або при хімічній рівновазі: 
Kp – константа рівноваги

У випадку хімічної реакції між газоподібними речовинами Кр процесу можна виразити за допомогою парціальних тисків (Р) газів , що беруть участь у реакції

Напрям зміщення хімічної рівноваги при зміні концентрації реагуючих речовин температури і тиску (для газових реакцій) якісно визначається принципом Ле-Шательє: якщо на систему, що перебуває у стані рівноваги, чиниться який-небудь зовнішній вплив (змінюється С, Т, Р), то він сприяє перебігу тієї з двох протилежних реакцій, яка послаблює цей вплив.
Розглянемо реакцію синтезу амоніаку:
 ,
, 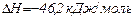
Щоб змістити рівновагу в сторону прямої реакції утворення NH3 необхідно: а) збільшити концентрацію N2 або Н2; б) оскільки пряма реакція екзотермічна, необхідно знизити температуру: в) збільшити тиск тому, що реакція супроводжується утворенням меншої кількості газоподібних молекул.
Завдання для самостійного розв’язання
4.2.1. Відповісти на запитання
1. Як можна теоретично розрахувати та експериментально визначити: а) тепловий ефект хімічної реакції; б) швидкість хімічної реакції?
2. Привести приклади рівнянь необоротних реакцій, що протікають з утворенням слабких електролітів, газоподібних речовин; оборотних реакцій.
3. Охарактеризувати фактори та закономірності проті-кання хімічних процесів.
Розв’язати задачі
1. Визначити, за якої температури реакція:
С(графіт) + H2O(г) → CO(г) + H2(г) ∆G298
стає термодинамічно можливою (G298<0) (980 К)
2. Визначити початкову швидкість реакції із константою швидкості прямої реакції k у розчині, отриманому змішуванням 2л 0,6М розчину CH3COOH і 3л 1М розчину NH4OH.
(0,144)
3. У скільки разів збільшиться швидкість реакції при збільшенні температури від 50 С до 90 С? Температурний коефіцієнт реакції дорівнює 2,5. (39,06)
4. Як треба змінити температуру, тиск, концентрацію, щоб змістити хімічну рівновагу даних реакцій в сторону прямої реакції:
а) H2(г)+I2(г)↔2HI; ∆H298>0
б) 2H2S(г)↔2H2(г)+2S(тв.); ∆H298>0
в) PCl5(г) ↔PCl3(г)+Cl2(г); ∆H298<0
4.2.3 Виконати завдання
Визначити стандартну зміну ізобарного потенціалу за стандартних умов та температури Т, користуючись таблицями термодинамічних величин (Додаток) для процесів:
| № п/п | Вихідні речовини | Продукти реакції | Кількість продукту | Т, К | ||
| A | B | C | D | |||
| N2O(г) | NH3(г) | H2O(р) | N2(г) | 0,180кг | 1435 | |
| ZnO(к) | H2(г) | ZnS(к) | H2O(р) | 0,485 кг | 972 | |
| CCl4(г) | O2(г) | CO2(г) | Cl2(г) | 0,880 кг | 899 | |
| CaO(к) | C(граф) | CaC2(к) | CO(г) | 1,360 кг | 2426 | |
| HCl(г) | O2(г) | Cl2(г) | H2O(г) | 4,480м3 | 277 | |
| CaC2(к) | H2O(р) | C2H2(г) | Ca(OH)2 | 1,008 м3 | 679 | |
| C2H4(г) | O2 (г) | CO2(г) | H2O(г) | 1,344 м3 | 3572 | |
| NH3(г) | H2SO4(р) | (NH3)2 SO4(к) | - | 1,320 кг | 1206 | |
| H2(г) | NO2(г) | NH3(г) | H2O(г) | 0,340 кг | 2747 | |
| ZnS(к) | O2(г) | SO2(г) | ZnO(к) | 1,120м3 | 2499 | |
| Na2O(к) | CO2(г) | Na2CO3(к) | - | 1,060 кг | 291 | |
| C2H6(г) | O2(г) | CO2(г) | H2O(г) | 2,016м3 | 1206 | |
| NaNO3(к) | H2SO4(р) | HNO3(р) | Na2SO4(к) | 0,315 кг | 180 | |
| Al2O3(к) | SO3(г) | Al2(SO4)3(к) | - | 1,710 кг | 288 | |
| CH4(г) | H2O(г) | CO(г) | H2(г) | 0,112 кг | 3059 | |
| SiO2(к) | NaOH(к) | H2O(р) | Na2SiO3(к) | 0,090 кг | 2236 | |
| Fe2O3(к) | CO(г) | CO2(г) | FeO(к) | 0,560м3 | 5114 | |
| CaO(к) | HCl(г) | CaCl2(к) | H2O(р) | 5,550 кг | 2089 | |
| H2S(г) | O2(г) | SO2(г) | H2O(г) | 0,640 кг | 1008 | |
| Na2CO3(к) | Ca(OH)2(к) | NaOH(к) | CaCO3(к) | 0,800 кг | 876 | |
| FeS2(к) | O2(г) | SO2(г) | Fe2O3(к) | 4,032м3 | 425 | |
| Fe(к) | Al2O3(к) | Al(к) | Fe2O3(к) | 1,350 кг | 1250 | |
| CaCO3(к) | - | CaO(к) | CO2(г
Дата: 2016-10-02, просмотров: 348. |