Дослід 1. Здобування гідроксидів активних металів. Здобути магній гідроксид  взаємодією магнію з водою. Наявність іонів
взаємодією магнію з водою. Наявність іонів 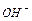 в розчині виявити індикатором.
в розчині виявити індикатором.

Дослід 2. Здобування нерозчинних у воді гідроксидів та вивчення амфотерних властивостей гідроксидів. Здобути гідроксиди  та
та  взаємодією розчинів відповідних солей з лугами. Виявити який з них є амфотерним гідроксидом, аналізуючи реакції даних гідроксидів з кислотами та лугами.
взаємодією розчинів відповідних солей з лугами. Виявити який з них є амфотерним гідроксидом, аналізуючи реакції даних гідроксидів з кислотами та лугами.
а) 
| в) 
|
б)  ? ?
| г)  ? ?
|
Дослід 3. Здобування слабких кислот. Здобути етанову (оцтову) кислоту  витісненням її із ацетату сильною кислотою, підтвердити утворення кислоти.
витісненням її із ацетату сильною кислотою, підтвердити утворення кислоти.

Дослід 4. Здобування нормальних (середніх) та кислих солей. Здобути кислотний карбон (IV) оксид, провести його взаємодію з лугом з утворенням Кальцій карбонату 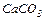 . Із кальцій карбонату здобути кислу сіль – кальцій гідрокарбонат
. Із кальцій карбонату здобути кислу сіль – кальцій гідрокарбонат 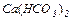 .
.
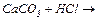


Дослід 5. Здобування основних солей. 1. Здобути основну сіль плюмбум (II) гідроксоацетат  із середньої солі плюмбум (II) ацетату та плюмбум (II) оксиду при нагріванні.
із середньої солі плюмбум (II) ацетату та плюмбум (II) оксиду при нагріванні.

2. Здобути основну сіль кобальт (ІІ) гідроксонітрат взаємодією кобальт (ІІ) нітрату з лугом натрій гідроксидом у молярному співвідношенні 1:1.

Всі реакції записати в молекулярному та іонному видах, занотувати кольори осадів і розчинів.
Зміст звіту
1.6.1 Назва роботи.
1.6.2 Мета роботи.
1.6.3 Вивчення загальних відомостей.
1.6.4 Виконання завдань для самостійного розв’язання
1.6.5 Аналіз хімічних дослідів (хід виконання, спостереження, рівняння хімічних реакцій).
1.6.6 Висновки.
Лабораторна робота №2
ВИЗНАЧЕННЯ ЕКВІВАЛЕНТА МЕТАЛУ
Мета роботи: засвоєння основних понять і законів хімії, ознайомлення з одним із методів визначення молярної маси еквівалента металу.
Загальні відомості
Маси (об’єми) реагуючих між собою речовин підкоряються закону еквівалентів. Згідно з цим законом маси (об’єми) реагуючих між собою речовин  та
та  (
(  та
та  ) пропорційні їх еквівалентним маса (молярним масам еквівалентів)
) пропорційні їх еквівалентним маса (молярним масам еквівалентів)  та
та  (
(  та
та  ):
):
 або
або 
Молярною масою еквівалента або еквівалентною масою називається масова кількість елемента, яка сполучається з однією (точніше з 1,008) масовою частиною водню або вісьмома масовими частинами кисню чи заміщує їх у сполуках.
Об’єм, який має за даних умов молярна маса еквівалента речовини у газовому стані, називається молярним об’ємом еквівалента цієї речовини.
Виходячи з того, що молярний об’єм будь-якого газу за нормальних умов дорівнює 
 , молярний об’єм еквівалента водню
, молярний об’єм еквівалента водню  дорівнює
дорівнює 
 ; молярний об’єм еквівалента кисню
; молярний об’єм еквівалента кисню  дорівнює
дорівнює 
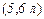 . Молярна маса еквівалента речовини (як простої так і складної) може набувати різного значення і залежить від того, до якої реакції вступає ця речовина.
. Молярна маса еквівалента речовини (як простої так і складної) може набувати різного значення і залежить від того, до якої реакції вступає ця речовина.
Взаємозв'язок між основними фізичними величинами, що використовуються в хімії
| Назва | Символ | Визначальне рівняння | Одиниці вимірювання |
| Відносна атомна маса | 
| 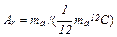

| безрозмірна одиниця
або

|
| Відносна молекулярна маса | 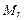
| 

| безрозмірна одиниця
або

|
| Молярна маса | 
| 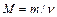
| 
|
| Маса | 
|  ; ; 
| 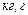
|
| Об’єм | 
|  ; ; 
| 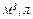
|
| Молярний об’єм | 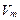
|  ;
за умов відмінних від нормальних: ;
за умов відмінних від нормальних:
 ( (  ),
де ),
де 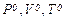 - тиск, об’єм та температура за нормальних умов, - тиск, об’єм та температура за нормальних умов,
 , , 
| 
|
| Кількість речовини | 
| 
|  
|
| Кількість частинок (молекул, атомів, іонів тощо) | 
|  ; ;

| безрозмірна одиниця |
| Число Авогадро | 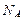
| 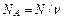 ; ; 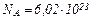
| 
|
| Густина | 
|  ; ; 
|  , ,  , ,

|
| Молярна маса еквівалента | 
| 

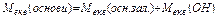
 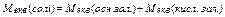
| 
|
| Фактор еквівалент-ності | 
| 



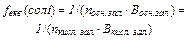 ,
де ,
де  - кількість часток, - кількість часток,
 - валентність - валентність
| безрозмірна одиниця |
| Молярний об’єм еквівалента | 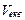
| 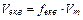
| 
|
Завдання для самостійного розв’язання
Розв’язати задачі
1. Визначити  нітрогену та формулу сполуки, яка містить 82,35 % нітрогену та 17,65 % гідрогену.
нітрогену та формулу сполуки, яка містить 82,35 % нітрогену та 17,65 % гідрогену.
(  )
)
2. Визначити  арґентуму, якщо 2,39 г цинку виділяють з розчину солі арґентуму 7,9 г срібла.
арґентуму, якщо 2,39 г цинку виділяють з розчину солі арґентуму 7,9 г срібла.  (
(  )
)
3. 1 г металу сполучається з масою хлору, що займає простір об’ємом 0,34 л при 37 °С та тискові 97,99 кПа. Обчислити молярну масу еквіваленту металу. (  )
)
4. З 1,35 г оксиду металу добуто 3,15 г його нітрату. Обчислити молярну масу еквіваленту металу. (  )
)
5. Залізо масою 7 г витісняє із кислоти 3,2 л водню виміряного при температурі 39 °С та тискові 1 атм. Яка валентність заліза в утвореній сполуці? ( 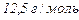 )
)
Дата: 2016-10-02, просмотров: 344.