| № | речовина | 
| 
| 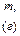
| 
| 
| 
| 
| 
| 
|
| 1 | 
| 101,1 | 10,0 | ? | ? | ? | ? | ? | ? | |
| 2 | 
| 94,5 | ? | 5,60 | ? | ? | ? | ? | ? | |
| 3 | 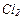
| 101,1 | 14,2 | ? | ? | ? | ? | ? | ? | |
| 4 | 
| 89,9 | ? | ? | ? | ? | ? | ? | ||
| 5 | 
| 101,2 | 6,4 | ? | ? | ? | ? | ? | ? | |
| 6 | 
| 96,8 | ? | 1,12 | ? | ? | ? | ? | ? | |
| 7 | 
| 10,0 | 6,8 | ? | ? | ? | ? | ? | ? | |
| 8 | 
| 121,2 | ? | ? | ? | ? | ? | ? | ||
| 9 | 
| 100,8 | 5,1 | ? | ? | ? | ? | ? | ? | |
| 10 | 
| 102,3 | ? | 2,24 | ? | ? | ? | ? | ? | |
| 11 | 
| 92,1 | 0,73 | ? | ? | ? | ? | ? | ? | |
| 12 | 
| 100,6 | ? | ? | ? | ? | ? | ? | ||
| 13 | 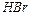
| 104,0 | 8,1 | ? | ? | ? | ? | ? | ? | |
| 14 | 
| 95,1 | ? | 4,48 | ? | ? | ? | ? | ? | |
| 15 | 
| 110,1 | ? | ? | ? | ? | ? | ? | ||
| 16 | 
| 99,9 | ? | ? | ? | ? | ? | ? | ||
| 17 | 
| 101,3 | 1,3 | ? | ? | ? | ? | ? | ? | |
| 18 | 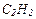
| 100,9 | ? | 8,96 | ? | ? | ? | ? | ? | |
| 19 | 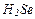
| 86,0 | 16,2 | ? | ? | ? | ? | ? | ? | |
| 20 | 
| 88,1 | ? | ? | ? | ? | ? | ? | ||
| 21 | 
| 91,2 | ? | ? | ? | ? | ? | ? | ||
| 22 | 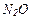
| 100,5 | ? | 3,36 | ? | ? | ? | ? | ? | |
| 23 | 
| 98,1 | 6,8 | ? | ? | ? | ? | ? | ? | |
| 24 | 
| 87,9 | ? | ? | ? | ? | ? | ? | ||
| 25 | 
| 84,7 | 4,6 | ? | ? | ? | ? | ? | ? |
Обладнання та реактиви
1. Обладнання: прилад для визначення еквівалента металу; термометр; барометр; циліндри на 25 та 100 мл.
2. Реактиви: наважка металу; хлоридна кислота (4N).
Вказівки до техніки безпеки
Дотримуватися правил роботи з кислотами, скляним посудом.
Порядок проведення лабораторної роботи
1. Зібрати прилад за рисунком

2. Перевірити прилад на герметичність: обережно від'єднати реакційну колбу (a) і, знявши затискач з гумової трубки, заповнити трубку водою з аспіратора (б) і затиснути затискачем.
3. В реакційну колбу налити 10 - 15 мл 4N розчину НСІ, повернути її в горизонтальне положення і внести у горло колби наважку металу, потім зштовхнути її у кислоту.
4. Після початку реакції зняти затискач, щоб вода вільно витікала із аспіратора у приймач (в).
5. Після закінчення реакції затиснути трубку затискачем і обережно, щоб із неї не витікала вода за допомогою циліндра зміряти об'єм води, витісненої із аспіратора у приймач.

6. Результати вимірювань записати по формі:
• Маса металу  ;
;
• Об'єм водню, який витіснено  ;
;
• Температура 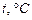 ;
;
• Абсолютна температура  ;
;
• Атмосферний тиск  ;
;
• Тиск насиченої водяної пари при температурі досліду 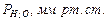 ;
;
• Тиск водню,  ;
;
• Універсальна газова стала  .
.
7. Розрахувати  металу двома методами:
металу двома методами:
1) Розрахувати масу водню, який витіснено,  по рівнянню Менделєєва - Клапейрона
по рівнянню Менделєєва - Клапейрона  , а потім на основі закону еквівалентів розрахувати молярну масу еквівалента металу
, а потім на основі закону еквівалентів розрахувати молярну масу еквівалента металу  .
.
2) Привести об’єм водню, який витіснено, 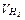 до нормальних умов за рівнянням:
до нормальних умов за рівнянням:  та за відомим еквівалентним об'ємом водню, розрахувати молярну масу еквівалента металу
та за відомим еквівалентним об'ємом водню, розрахувати молярну масу еквівалента металу  .
.
3) Знайти теоретичне значення молярної маси еквівалента цинку, а також знайти відносну похибку знайденої молярної маси еквіваленту металу.

Зміст звіту
2.6.1 Назва роботи.
2.6.2 Мета роботи.
2.6.3 Вивчення загальних відомостей.
2.6.4 Виконання завдань для самостійного розв’язання.
2.6.5 Аналіз досліду, математична обробка результатів експерименту.
2.6.6 Висновки
Лабораторна робота № 3
ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Мета роботи: навчитися визначати ступені окислення елементів та складати рівняння окислювально-відновних реакцій.
Загальні відомості
3.1.1 Окислення і відновлення. Класифікація окисно-відновних реакцій.
Реакції, що відбуваються із зміною ступеня окиснення атомів, що входять до складу реагуючих речовин, називаються окисно-відновними. Окисно-відновні реакції поділяються на три типи:
1. Міжмолекулярні реакції. Ступінь окиснення змінюють атоми, що входять до складу різних вихідних речовин, наприклад:
 ;
;  .
.
2. Внутрішньомолекулярні реакції. Атоми, що змінюють ступінь окиснення, входять до складу однієї сполуки (іноді це атоми одного елементу з різними ступенями окиснення), наприклад:
 ;
; 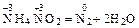 .
.
3. Реакція диспропорціювання. Атоми одного й того самого елемента з певним ступенем окиснення є як окисниками, так і відновниками, наприклад:
 ;
;  .
.
Реакції диспропорціювання (або самоокислення - самовідновлення характерні для речовин, що містять атоми з проміжними ступенями окиснення).
Метод електронного балансу
Стехіометричні коефіцієнти у рівняннях окисно-відновних реакцій зручно визначати, користуючись методом електронного балансу. Цей метод ґрунтується на порівнянні ступенів окиснення атомів у початкових і кінцевих умовах. Для встановлення коефіцієнтів виходять з того положення, що число електронів, відданих відновником, повинно дорівнювати числу електронів, приєднаних окисником. Існує певний алгоритм складання рівнянь окисно-відновних реакцій.
1. Записати схему рівняння.

2. Визначити, які атоми змінюють ступінь окиснення.

Отже, відновником є 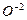 , окисником -
, окисником - 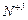 .
.
3. Скласти електронні рівняння процесів окиснення та відновлення. Підібрати коефіцієнти в цих схемах так, щоб загальне число електронів, які віддає відновник, дорівнювало загальному числу електронів, що приєднує окисник.

4. Розставити знайдені коефіцієнти у молекулярному рівнянні.

5. Підібрати інші коефіцієнт таким чином, щоб загальне число атомів кожного елемента було однаковим у лівій та правій частинах рівняння.

Завдання для самостійного розв’язання
3.2.1 Відповісти на запитання та виконати завдання
1. Які реакції називають окисно-відновними? Що таке окисники, відновники, процеси окиснення, відновлення?
2. Які із сполук  ,
,  ,
,  ,
, 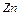 ,
,  ,
, 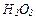 ,
,  ,
,  ,
,  ,
,  здатні бути тільки окисниками, які тільки відновниками, які здатні виявляти і окисні і відновні властивості в залежності від умов реакцій?
здатні бути тільки окисниками, які тільки відновниками, які здатні виявляти і окисні і відновні властивості в залежності від умов реакцій?
3. Користуючись методом електронного балансу розставити коефіцієнти в рівняннях окисно-відновних реакцій. Вказати окисник та відновник, процеси окиснення та відновлення. Визначити Мекв окисників і відновників.
а) 
б) 
в) 
г) 
д) 
4. Закінчити рівняння реакцій, за допомогою електронного балансу розставити коефіцієнти, вказати окислювач і відновник.
а) 
б) 
в) 
г) 
д) 
5. Розставити коефіцієнти за допомогою методу електронного балансу в рівняннях окисно-відновних реакцій. Вказати окисники та відновники.
| Варіант | Схеми хімічних процесів |

| |

| |

| |
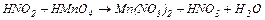
| |

| |

| |

| |

| |

| |
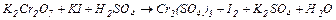
| |

| |

| |

| |

| |

| |

| |

| |

| |

| |

| |

| |
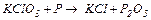
| |

| |

| |

|
Реактиви та обладнання
1. Розчини: сульфатна кислота (2N), купрум (II) сульфат, манган (II) сульфат, натрій гідроксид, бром, калій перманганат, ферум (II) сульфат, калій дихромат. 2. Речовини: цинк, залізо, кристалічні натрій сульфіт або натрій нітрит, дистильована вода. 3. Обладнання: нагрівальний прилад.
Вказівки до техніки безпеки
Дотримуватися правил роботи з розчинами кислот, солей, лугів, нагрівальним приладом.
Дата: 2016-10-02, просмотров: 368.