r раствора KI=1,0 г/мл.
М.м. KI =166 г/моль.
KI + AgNO3 ® AgI ¯ + KNO3
желтый
Ind розовый

I- Ag+ Ind-

 I- I- в точке эквивалентности:
I- I- в точке эквивалентности:
AgI желтый AgI розовый
Бюретку заполняют рабочим раствором нитрата серебра. В колбу для титрование пипеткой помещают 10 мл анализируемого раствора KI, мерным цилиндром прибавляют 1 мл разведенной СН3СООН (или 20 капель) и 3-4 капли индикатора эозината натрия.
Титруют раствором нитрата серебра на белом фоне до перехода желтой окраски осадка в розовую. Также в точке эквивалентности осадок коагулируется.
Титруют 1 раз.
V AgNO3=.,…мл
 0,1× 166 × 1
0,1× 166 × 1
T AgNO3/KI= 1000 = 0,0166 г/мл
 V AgNO3× К AgNO3 × T AgNO3 / KI ×100
V AgNO3× К AgNO3 × T AgNO3 / KI ×100
% NаCl= r×Vпип. = … %
Вывод: в 100 гр. раствора содержится .,…..г. KI.
Занятие №18
Физико-химические методы анализа
 Рефрактометрия однокомпонентных растворов.
Рефрактометрия однокомпонентных растворов.
Задачи:
1. освоить технику работы с рефрактометром
2. освоить методику определения концентрации однокомпонентных растворов по расчетной формуле.
Продолжительность занятия
90 минут (2академических часа)
Вопросы для самоподготовки
- определение показателя преломления
- факторы, влияющие на значение показателя преломления
- алгоритм работы с рефрактометром
Материальное обеспечение
реактивы
вода очищенная
исследуемый раствор
оборудование
рефрактометры
Наглядные пособия
Таблица «нулевая точка» рефрактометра
Этот метод относится к оптическим методам анализа и основан на законе преломления: луч света, проходящий через границу двух сред, преломляется.
среда 1
угол падения α
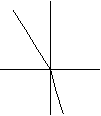 среда 2
среда 2
угол преломленияβ
Сравнение скорости света в двух средах называется показателем преломления n
скорость света в 1 среде V 1 sin α (синус угла падения)
n = скорость света во 2 среде = V 2 n = sinβ (синус угла преломления)
показатель преломления зависит от:
1. природы вещества
2. температуры
3. концентрации растворенного вещества
Поэтому методом рефрактометрии определяют концентрацию (массовую долю) раствора, имеющего нейтральную реакцию среды (возможна порча материала прибора) и с концентрацией более 3%. Особо точные определения проводят при температуре 200С, поэтому рефрактометр подключают к термостату.
Определение состоит из следующих этапов:
v определение нулевой точки рефрактометра (определение показателя преломления воды n 0 =1,333)
v определение показателя преломления анализируемого раствора n
v расчёт концентрации по формуле
n – n 0
C(ɷ%) = F
F- фактор пересчета показателя преломления, который показывает, как изменится показатель преломления, если концентрация вещества изменится на 1%. Фактор – величина, постоянная для каждого конкретного вещества и для некоторых может изменяться в зависимости от концентрации. Значения фактора можно найти в специальных рефрактометрических таблицах.
Техника выполнения
ü промойте водой призмы рефрактометра водой и насухо протрите ватой
ü нанесите на нижнюю призму рефрактометра насколько капель воды очищенной и, закрыв верхнюю призму, определите «нулевую точку» рефрактометра (см. таблицу)
ü после определения показателя воды (нулевая точка), насухо протрите призмы ватой и промойте несколькими каплями анализируемого раствора, затем снова насухо протрите ватой
ü нанесите на нижнюю призму рефрактометра несколько капель анализируемого раствора, закройте верхнюю призму и определите показатель преломления анализируемого раствора
ü по рефрактометрическим таблицам найдите фактор пересчета показателя преломления вашего раствора (проверьте соответствие концентрации!!)
ü рассчитайте концентрацию определяемого раствора
n – n 0
C(ɷ%) = F = ………..
Вывод: в 100 граммах анализируемого раствора содержится ……….
РЕФРАКТОМЕТРИЧЕСКИЕ ТАБЛИЦЫ
| Кон | Показатели преломления | Факторы | ||
| цент | растворов | показате | ||
| Наименование растворов | рация. | данной | допустимые | лей |
| % | концен | отклонения | преломле | |
| трации | ния | |||
| КАЛИЯ БРОМИД | 20 | 1,3562 | 1,3557-1,3567 | 0,001 16 |
| КАЛИЯ ИОДИД | 20 | 1,3590 | 1,3585-1,3595 | 0,0013 |
| КАЛЬЦИЯ ХЛОРИД | 20 | 1.3558 | 1,3553-1,3563 | 0,00114 |
| КАЛЬЦИЯ ХЛОРИД | 50 | 1,3870 | 1,3865-1,3875 | 0,00108 |
| МАГНИЯ СУЛЬФАТ | 50 | 1,3740 | 1.3736-1,3744 | 0,00082 |
| НАТРИЯ БРОМИД | 20 | 1,3590 | 1,3585-1,3595 | 0,0013 |
| КАЛИЯ ХЛОРИД | 3 | 1,3368 | 1,3367-1,3369 | 0,001269 |
| КАЛИЯ ХЛОРИД | 5 | 1,3394 | 1,3392-1,3396 | 0,001269 |
| КАЛИЯ ХЛОРИД | 7,5 | 1,3425 | 1,3422-1,3428 | 0,001269 |
| КАЛИЯ ХЛОРИД | 10 | 1,3457 | 1,3453-1,3461 | 0,001269 |
| НАТРИЯ ХЛОРИД | 10 | 1.3494 | 1,3489-1,3499 | 0,00164 | |||
| АММОНИЯ ХЛОРИД | 5 | 1,343 | 1,3427-1,3433 | 0,002 | |||
| АММОНИЯ ХЛОРИД | 10 | 1,352 | 1,3514-1,3526 | 0,0019 | |||
| КАЛИЯ ИОДИД | 3 | 1,3369 | 1,3368-1,337 | 0,0013 | |||
| КАЛЬЦИЯ ХЛОРИД | 2 | 1,3354 | 1,3353-1,3354 | 0,00118 | |||
| КАЛЬЦИЯ ХЛОРИД | 3 | 1,3365 | 1,3364-1,3367 | 0,00118 | |||
| КАЛЬЦИЯ ХЛОРИД | 5 | 1,3389 | 1,3387-1,3391 | 0,00118 | |||
| КАЛЬЦИЯ ХЛОРИД | 10 | 1,3446 | 1,3443-1,3449 | 0,00116 | |||
| МАГНИЯ СУЛЬФАТ | 10 | 1,3423 | 1,3420-1,3426 | 0,00093 | |||
| МАГНИЯ СУЛЬФАТ | 15 | 1.3468 | 1,3464-1.3472 | 0,00092 | |||
| МАГНИЯ СУЛЬФАТ | 20 | 1,3510 | 1,3505-1,3515 | 0.00090 | |||
| МАГНИЯ СУЛЬФАТ | 25 | 1,3553 | 1,3546-1,3559 | 0,00089 | |||
Занятие №19
Тонкослойная хроматография
Качественный анализ смеси органических веществ методом ТСХ с
детектированием в УФ-свете.
Задачи
- закрепить на практике теоретические знания
- освоить методику ТСХ (подготовка хроматографической камеры, нанесение растворов, проявление хроматограммы, определение состава анализируемого раствора)
Продолжительность занятия
90 минут (2 академических часа)
Вопросы для самоподготовки
- Что такое ТСХ? Каков механизм разделения веществ в тонком слое сорбента?
- Какие подвижные и неподвижные фазы применяются вТСХ?
- Основные этапы проведения анализа методом ТСХ
- Основные параметры разделения в ТСХ, формулы.
Материальное обеспечение
Реактивы
1) Стандартные растворы веществ–свидетелей в спирте этиловом 95% (папаверина 1мг/мл, кофеина 1 мг/мл и аскорбиновой кислоты 1 мг/мл)
2) Исследуемый раствор (задача)
3) Элюент – спирт этиловый 95%
Оборудование
1) Капилляры для нанесения проб
2) Хроматографическая камера
3) Пинцеты
4) Источник освещения с λ =254 нм
5) Хроматографическая пластинка
Техника выполнения
Простым карандашом на хроматографической пластинке нанесите линию старта растворителя (≈1,5 см от нижнего края пластинки) и линию фронта растворителя (≈ 1см от верхнего края ). На линию старта нанесите 4 точки на одинаковом расстоянии от краев пластины и друг от друга, каждая будет соответствовать одному из стандартных растворов веществ-свидетелей и исследуемому раствору. Чистым капилляром в одно касание (каждому из рабочих растворов должен строго соответствовать свой капилляр!) нанесите каждый раствор. Желательно, чтобы диаметр пятен не превышал 3 мм. Пластину высушите до удаления пятен растворителя и с помощью пинцета поместите в подготовленную хроматографическую камеру. Пластину поместите строго вертикально!, нижний край погружен не более, чем на 0,5 см, верхний край должен опираться на стенку камеры. (в одной камере одновременно может элюироваться не более 2-х пластинок! И загружаться должны одновременно! И не касаясь друг друга! Во время хроматографирования запрещается двигать камеру!)
Пластину хроматографируйте восходящим способом, следя за продвижением фронта растворителя. Когда растворитель достигнет линии фронта, пластину аккуратно выньте с помощью пинцета, подсушите до удаления паров растворителя ( под тягой).
Детектирование полученных пятен проведите в УФ-свете, помещая пластину под источник освещения с λ =254 нм и простым карандашом обведите обнаруженные пятна. Пластину вынесите из-под лампы.
Измерьте параметры l (расстояние от линии старта до середины обнаруженного пятна) и L (расстояние от линии старта до линии финиша) для всех полученных на хроматограмме пятен, рассчитайте значения факторов удерживания:
l __
Rf = L =………
Все полученные данные занесите в таблицы:
Таблица 1
Параметры удерживания индивидуальных веществ (свидетелей)
| № | название | l | L | Rf |
| 1 | папаверин | |||
| 2 | кофеин | |||
| 3 | аскорбиновая к-та |
Таблица 2
Параметры удерживания компонентов исследуемого раствора
| № | l | L | Rf | название |
| 1 | ||||
| 2 | ||||
| 3 |
По полученным данным сделайте заключение о качественном составе исследуемого раствора.
Вывод: в исследуемом растворе присутствует (ют) ………………………
Занятие №20
Фотометрия
Литература
Обязательная:
1. Пономарев В.Д. « Аналитическая химия».
2. Конспект лекций.
Дополнительная:
1. Логинов Н.Я. Воскресенский А.Г.Солодкин И.С.«Аналитическая химия».
Дата: 2019-11-01, просмотров: 322.