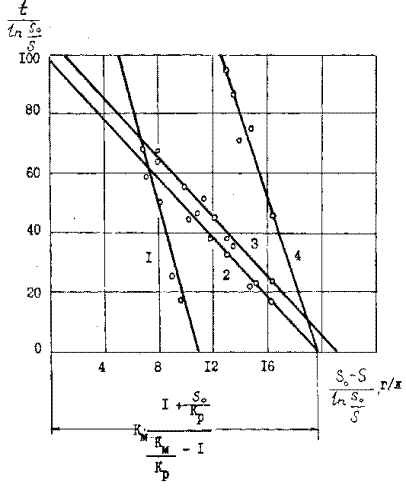
( 1 – содержание мышьяка 9,8 г/л, железа 10 г/л, 2 – то же 17,4 и 10 г/л, 3 – то же 18,6 г/л и 10 г/л, 4 – то же 17,4 г/т, без железа)
Рисунок 11
> kp , т.е. сродство «фермента» к продукту окисления ( Fe3+, As3+, As5+ и другим ингибиторам) больше, чем к субстрату – арсенопириту. Увеличение тангенса угла наклона при постоянной концентрации фермента ( бактерий) характеризует снижение скорости окисления в результате уменьшения начальной концентрации сульфидного мышьяка ( кривая 1 рис. 24) или воздействием других факторов( например отсутствие в растворе дополнительного окислителя Fe3+ ( кривая 4 рисунок 11 ). Разница в величине отрезков на оси абсцисс зависит отначальной концентрации сульфидного мышьяка ( кривые 1,2,3 рисунок 11 ) в случае Е = const., т.е. при постоянной концентрации фермента.
При бактериальном выщелачивании сульфидного мышьяка при различной концентрации бактерий ( рисунок 11) в соответствии с уравнением ( 30) линейный характер зависимости скорости реакции окисления основного субстрата – арсенопирита от концентрации «фермента» сохраняется не только на участке начальных скоростей, но и в течении всего процесса. Тангенс угла наклона прямых к оси абсцисс на рисунке 12
Влияние концентрации биомассы на скорость бактериального выщелачивание мышьяка при S 0 = 17,4 г/л
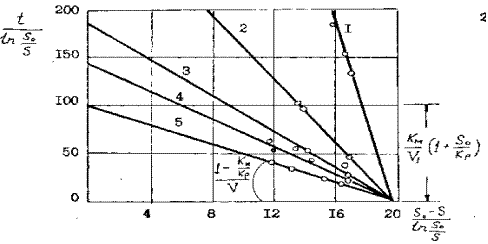
( 1 -0.25 г/л, 2 – 0,75 г/л, 3 – 1,25 г/л, ; - 1,75 г/л, 5 – 2,5 г/л )
Км = 3,6 г/л , V1 = 1,9 г/л ч, КР = 0,34 г/л, Ккат = 1,27 ч-1
Рисунок 12
обратно пропорционален концентрации бактерий. Величина отрезка, отсекаемого прямой на оси абсцисс равна 19,6. В этом случае в соответствии с ( 31 ) при начальной концентрации мышьяка 17,4 г/л соотношение km= 19,6 kp /2,2- Кр и имеет вид гиперболы, асимптотически приближающейся к прямой ( рисунок 13 ), при этом kр = 2,2, где 2,2 разница между абсциссами пересечения прямых м исходной концентрации субстрата , т.е.
19,6 – 17,4 = 2,2.
Соотношение Км и Кр в процессе бактериального выщелачивания
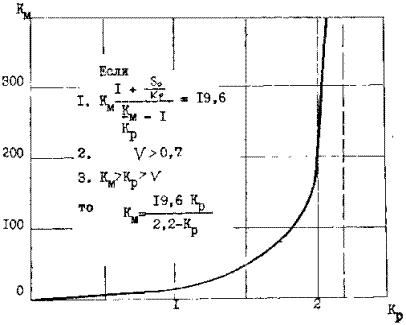
Рисунок 13
По одной кинетической кривой, как отмечалось ранее, при конкурентом ингибировании невозможно определить три кинетические величины kv, kp и Vmax, но они могут быть найдены при вышелачивании продуктов с различной исходной концентрацией мышьяка (So). Это можно осуществить при бактериальном выщелачивании мышьяка из золотомышьякового концентрата при различной плотности пульпы, т.е. при Т:Ж = 1:2,5 ; 1:5 и 1:10. Экспериментальные данные, обработанные по методу Корниш-Боуден показывают, что кинетические зависимости выражены параллельными прямыми с отрицательным тангенсом угла наклона к оси абсцисс ( рисунок 14 )
Кинетика выщелачивания сульфидного мышьяка при различной концентрации
Исходного субстрата ( Т:Ж)
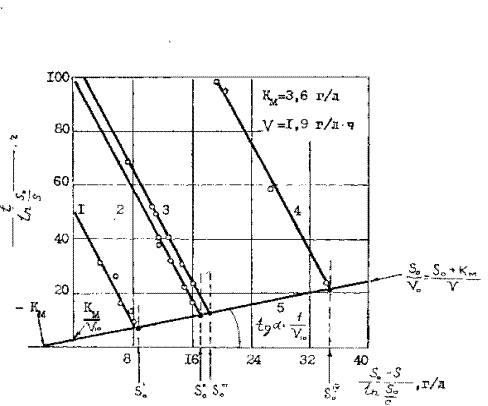
1 – S0 = 8,7 г/л ( Т:Ж = 1:10), 2 – S0 = 17,4 г/л (Т:Ж=1:5), 3 – S0 = 18,6 г/л (Т:Ж=1:5),4 - S0
4 – S0= 34,8 г/л, концентрация биомассы 2,5 г/л, начальная концентрация железа(II)-10 г/л
Рисунок 14
Путем экстраполяции ординаты 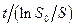 к значению
к значению 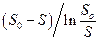 равному So, на каждой прямой получена точка с координатами So и So/V. Тогда при условии
равному So, на каждой прямой получена точка с координатами So и So/V. Тогда при условии 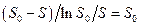 ( из уравнения ( 30 ) получается
( из уравнения ( 30 ) получается
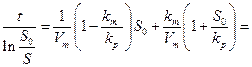
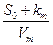 (31)
(31)
а из уравнения Михаэлиса-Ментен
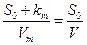 (32)
(32)
По прямой, соединяющей полученные точки с координатами 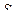 o;
o; 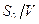 , определяются параметры
, определяются параметры 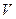 max и km. Тангенс угла наклона прямой к оси абсцисс равен 1/
max и km. Тангенс угла наклона прямой к оси абсцисс равен 1/ 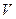 max, а отрезок, отсекаемый на этой оси равен – km. Константа Михаэлиса для бактериального выщелачивания мышьяка равна 3,6 г/л, при максимальной скорости выщелачивания 1, 9 г/л для растворов с концентрацией клеток 2,5 г/л и 0,19 г/л при концентрации клеток 0,25 г/л ( см. рисунок12 ).
max, а отрезок, отсекаемый на этой оси равен – km. Константа Михаэлиса для бактериального выщелачивания мышьяка равна 3,6 г/л, при максимальной скорости выщелачивания 1, 9 г/л для растворов с концентрацией клеток 2,5 г/л и 0,19 г/л при концентрации клеток 0,25 г/л ( см. рисунок12 ).
Из уравнения ( 28) определяется кинетическая константа бактериального выщелачивания сульфидного мышьяка с учетом того, что в единице сухой биомассы содержится 1/1,67 белка . Тогда за 1 час одна весовая часть белка биомассы А.ferrooxidans способна катализировать 1,3 частей арсенопирита. Каталитическая константа в этом случае определяется только на общее количество белка, а не на единицу веса фермента, т.к. фермент, участвующий в окислении не выделен, его вес и число активных центров неизвестны.
По уже известным величинам 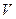 max и km определяется константа ингибирования Kp, которая при бактериальном выщелачивания мышьяка из арсенопиритового концентрата культурой, неадаптированной к этому концентрату равна 0,34 г/л.
max и km определяется константа ингибирования Kp, которая при бактериальном выщелачивания мышьяка из арсенопиритового концентрата культурой, неадаптированной к этому концентрату равна 0,34 г/л.
Таким образом, сродство продуктов выщелачивания к ферменту (1/kp) при бактериальном выщелачивании сульфидного мышьяка, равное 2,94, в 10,8 раза больше сродства исходного субстрата ( арсенопирита), равного 0,27. Это означает , что основная часть фермента клеток связывается при выщелачивании в комплекс с мышьяком, как продуктом выщелачивания и в дальнейшем в каталитическом процессе не участвует. Этим можно объяснить ингибирование процесса выщелачивания при накоплении продуктов выщелачивания.
Таким образом, кинетика процессов бактериального окисления и выщелачивания подчиняется кинетическим закономерностям ферментативного катализа, где в качестве катализаторов выступают ферменты бактериальных клеток. Ингибирование бактериального выщелачивания, например, арсенопирита в мышьяксодержащих концентратах протекает по конкурентному механизму ингибирования. Снижение скорости выщелачивания, наблюдаемое при выщелачивании практически любых сульфидных минералов и концентратов происходит за счет связывания большей части активных ферментов в непродуктивный комплекс с продуктами метаболизма. В этих условиях наиболее эффективным методом интенсификации биогидрометаллургических процессов является поддержание активно растущей биомассы бактерий в пульпе, регуляции плотности пульпы, скорости ее протока и частичного вывода продуктов окисления сульфидов в оборотные растворы, из которых они удаляются во избежания ингибирования процесса.
Дата: 2019-07-30, просмотров: 372.